Kardiotoxizität von Immuntherapien und deren Management
Autor:
Assoz. Prof. PD DDr. Peter P. Rainer, FESC, FAHA, FHFA
Leiter Herzinsuffizienz-Programm und kardiologische Ambulanzen
Universitäres Herzzentrum an der Medizinischen Universität Graz
E-Mail: peter.rainer@medunigraz.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Immuntherapien haben die Behandlung von Krebserkrankungen revolutioniert und ermöglichen lang anhaltende Remissionen bei Tumorerkrankungen mit vormals äußerst schlechter Prognose. DerEinsatz des körpereigenen Immunsystems als Waffe gegen Tumorzellen kann aber auch neuartige und schwerwiegende immunvermittelte Nebenwirkungen hervorrufen. Das kardiovaskuläre System ist seltener betroffen als andere Organe, jedoch sind die Verläufe hier oft schwerwiegend.
Keypoints
-
Eine überwiegende Zahl von Patient*innen entwickelt eine immunvermittelte Nebenwirkung unter ICI-Therapie. Kardiovaskuläre Nebenwirkungen sind vergleichsweise selten, aber häufig schwerwiegend.
-
Die ICI-induzierte Myokarditis tritt oft nach den ersten Gaben auf und hat unbehandelt eine hohe Mortalität.
-
Reizleitungsstörungen sind bei ICI-Myokarditis häufig. Ein telemetrisches Monitoring ist deshalb vor allem im floriden Stadium notwendig.
-
Normalbefunde in der Echokardiografie und cMR schließen eine Myokarditis nicht aus. Insbesondere zu Beginn der Erkrankung ist die Sensitivität niedrig. Bei begründetem Verdacht sollte eine Endomyokardbiopsie frühzeitig durchgeführt werden.
-
Die Präsentation mit Myositis, Myasthenie und Myokarditis kündigt schwere Verläufe an und sollte unmittelbar zur weiteren Diagnostik und Therapie führen.
Immuntherapien als Revolution inder Tumortherapie
Immuntherapien haben im letzten Jahrzehnt die Behandlung von malignen Melanomen und in der Folge auch von anderen Tumorerkrankungen transformiert. Dies inkludiert metastasierte und Chemotherapie-resistente Tumoren, bei welchen bei Ansprechen auf die Therapie mitunter jahrelange Remissionen erreicht werden können. Im Vordergrund stehen Immuncheckpoint-Inhibitoren (ICI), welche die Zerstörung von Tumorzellen durch das stimulierte körpereigene Immunsystem bewirken.
Zu ICI gehören zum Beispiel die PD-1-Rezeptor-Antikörper Nivolumab, Pembrolizumab und Cemiplimab, der CTLA-4-Antikörper Ipilimumab oder die PD-L1-Antikörper Atezolizumab, Avelumab und Durvalumab. Die Indikationen für den Einsatz von ICI erweitern sich ständig. Das betrifft sowohl die Tumorentitäten als auch die Erweiterung auf palliative und adjuvante Einsätze. Insgesamt werden Immuntherapien in Zukunft deutlich öfter eingesetzt werden. Somit ist auch mit einem häufigeren Auftreten von Nebenwirkungen zu rechnen.
Immunvermittelte Nebenwirkungen
Immunvermittelte Nebenwirkungen, sogenannte „immune-related adverse events“ (irAE), treten bei der Mehrheit der Patient*innen auf. irAE werden oft in vier Schweregrade eingeteilt, wobei häufig mildere Grade beobachtet werden. irAE treten häufiger nach kombinierter Immuncheckpoint-Inhibition auf. Betroffen sein können unter anderem:
häufig
-
die Haut, z.B. durch Exanthem
gelegentlich
-
der Gastrointestinaltrakt, z.B. durch Kolitis und Diarrhö
-
die Leber, z.B. durch Hepatitis
-
das endokrine System, z.B. durch Schilddrüsenfunktionsstörung, Pankreatitis, Hypophysitis
-
die Lunge, z.B. durch Pneumonitis
Je nach Organsystem und Schwere der irAE besteht die Therapie üblicherweise aus der Gabe eines Steroids verbunden mit einem Pausieren oder Absetzen der Therapie. Bei mild ausgeprägten irAE ist ein Pausieren der Therapie jedoch nicht immer notwendig. Organspezifisch können weitere Therapien erforderlich sein, z.B. eine Hormonersatztherapie bei Hypothyreose oder dem oft irreversiblen Ausfall der Hypophysenfunktion.
Kardiotoxizität und deren Management
Kardiale immunvermittelte Nebenwirkungen werden insgesamt seltener beschrieben, allerdings ist die Surveillance bezüglich dieser Nebenwirkungen oft auch nicht standardisiert. Zu den kardialen Nebenwirkungen zählen Myokarditis, Perikarditis und Rhythmusstörungen. Inwiefern die Anfachung des Immunsystems auch die Progression von Atherosklerose beschleunigt, zum Beispiel in der Form von entzündungsmediierter Ruptur vulnerabler Plaques und folgenden ischämischen kardiovaskulären Ereignissen, ist unklar. Direkte kausale Studien zu diesem Zusammenhang fehlen noch, allerdings zeigen Beobachtungsstudien, dass Patient*innen mit Immuntherapien vermehrt harte kardiovaskuläre Endpunkte wie Herzinfarkte oder kardiovaskulären Tod erleiden.
Klarer ist der unmittelbare Zusammenhang bei Myokarditis und Perikarditis. So liegt in Pharmakovigilanzstudien die Inzidenz der Myokarditis zwischen 0,5 und 2%, je nachdem ob eine isolierte oder kombinierte Immuncheckpoint-Inhibition vorliegt. Eine Besonderheit ist die berichtete hohe Mortalitätsrate der ICI-induzierten Myokarditis, welche unbehandelt bei über 50% liegt.
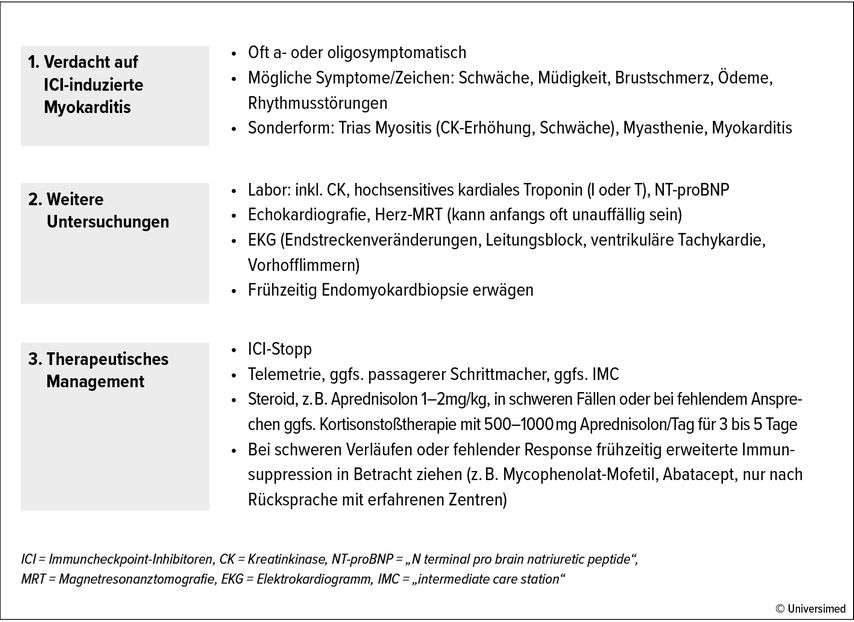
Wenn eine Myokarditis auftritt, dann typischerweise nach den ersten Behandlungszyklen. Symptome wie Brustschmerzen, Herzinsuffizienz oder Rhythmusstörungen können, aber müssen nicht vorliegen. Die ICI-induzierte Myokarditis manifestiert sich häufig mit einer Erhöhung des hochsensitiven kardialen Troponins. Eine Troponinerhöhung kann aber auch durch andere Erkrankungen bedingt sein. Diese sollten differenzialdiagnostisch in Betracht gezogen und bei Bedarf abgeklärt werden, z.B. Ischämie und akutes Koronarsyndrom, Rhythmusstörungen, hypertensive Entgleisung und andere. Eine isolierte Troponinerhöhung nach ICI-Gabe ohne weitere Hinweise auf Myokarditis oder andere Ursachen muss nicht zwangsläufig zu einem Absetzen der ICI-Therapie führen. Jedoch ist eine engmaschige Überwachung der Therapie nach Rücksprache mit einem mit Kardioonkologie vertrauten Kardiologen notwendig.
Um die kardialen Biomarker konklusiv beurteilen zu können, sollten diese bereits vor Therapiestart bestimmt werden, um den Ausgangswert und ein allfällig bereits bei Therapiestart erhöhtes Risiko aufgrund kardialer Vorerkrankungen zu kennen. Hier ist die Bestimmung eines hochsensitiven kardialen Troponins (I oder T), des NT-proBNP und der Kreatinkinase (CK) sinnvoll.
Weiterführende Untersuchungen
Die weiterführende Abklärung bei einem Verdacht auf ICI-induzierte Myokarditis beinhaltet die Durchführung eines 12-Kanal-EKG. Hier können z.B. Endstreckenveränderungen vorliegen, welche im Vergleich zu vorherigen EKG beurteilt werden sollten. Die ICI-Myokarditis zeichnet sich auch dadurch aus, dass sie häufig das Reizleitungssystem betrifft und höhergradige AV-Blockierungen hervorrufen kann.
Weiters sollte eine Echokardiografie durchgeführt und folgende Faktoren sollten überprüft werden:
-
Einschränkung der linksventrikulären systolischen Funktion inkl. Bestimmung der Ejektionsfraktion und idealerweise des myokardialen Strains
-
neue regionale Wandbewegungsstörungen
-
Perikarderguss
Auch eine kardiale Magnetresonanztomografie (cMR) sollte veranlasst werden, in der auf Nachstehendes untersucht wird:
-
Ödem
-
LGE
-
Hinweis auf Myokarditis
-
Funktion und Struktur
Besonders hervorzuheben ist, dass diese Untersuchungen vor allem in Frühstadien eine niedrige Sensitivität besitzen und Normalbefunde eine Myokarditis keinesfalls ausschließen.
Aufgrund des potenziell schweren Verlaufs, der Notwendigkeit potenter Therapien und der Tatsache, dass, wenn eine Myokarditis gesichert ist, eine ICI-Therapie in der Regel nicht fortgeführt werden kann, sollte frühzeitig die Endomyokardbiopsie (EMB) erwogen werden. Diese Untersuchung kann in erfahrenen Zentren rasch und mit niedrigen Komplikationsraten durchgeführt werden und erlaubt die Diagnosesicherung.
Therapeutisches Management
Wenn die Diagnose wahrscheinlich oder gesichert ist, muss die ICI-Therapie abgesetzt werden. Ein Rhythmusmonitoring ist aufgrund der Gefahr von Reizleitungsstörungen notwendig. Die Initialtherapie besteht aus Steroidgabe i.v., typischerweise 1–2mg/kg Aprednisolon. Bei schweren Verläufen (Reizleitungsstörung, deutliche Reduzierung derAuswurffraktion, hämodynamische Kompromittierung) ist auch eine hoch dosierte Stoßtherapie mit 500–1000 mg Aprednisolon/Tag über 3–5 Tage und folgendem Tapering über Wochen bis Monate möglich.
Eine Sonderform stellt die Manifestation in folgender Trias dar:
-
Myositis (CK-Erhöhung, Schwäche)
-
Myasthenie (oft okuläre Myasthenie: Sehstörungen, Ptose)
-
Myokarditis
Diese Präsentation kündigt oft rasch progrediente und schwere Verläufe mit drohender Atemlähmung und Reizleitungsstörung an. Hier sind eine unmittelbare Diagnostik inklusive EMB und ein prompter Therapiestart notwendig.
Zusätzlich zur Steroidtherapie werden in solchen schweren Fällen weitere Immunsuppressiva wie zum Beispiel Mycophenolat-Mofetil (MMF) oder Abatacept (Co-Stimulations-Aktivator) eingesetzt, wobei hier die Evidenz größtenteils aus kleinen Fallserien oder teilweise noch unpublizierten Registern stammt. Durch diese rasche und intensive Therapie kann jedoch bei ansonsten schlechter Prognose in damit erfahrenen Zentren die Mortalität deutlich reduziert werden. Das Auftreten einer Myokarditis als potenziell lebensbedrohliche irAE macht in der Regel den weiteren Einsatz von ICI bei betroffenen Patient*innen unmöglich.
Literatur:
beim Verfasser
Das könnte Sie auch interessieren:
Adjuvantes Osimertinib reduziert ZNS-Rezidive bei EGFR-mutierter Erkrankung
Etwa 30% der Patienten mit nicht kleinzelligem Lungenkarzinom (NSCLC) präsentieren sich mit resezierbarer Erkrankung und werden einer kurativen Operation unterzogen. Viele Patienten ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...