Innovative Therapien aus der Immunologie auch gegen solide Tumoren
Bericht:
Dr. med. Jürgen Sartorius
In der Behandlung verschiedener Leukämien und Lymphome haben die CAR-T-Zellen bereits einen festen Platz. Doch auch bei den soliden Tumoren öffnen sich Türen zu vielversprechenden immunologischen Therapien – von TRUCK bis zur «Krebsimpfung».
CAR und TRUCK: Gezielte Veränderungen von T-Zellen kommen immer schneller
Der T-Zell-Rezeptor (TCR) verleiht jeder T-Zelle ihre Spezifität für ein bestimmtes Antigen und sorgt so dafür, dass diese vom körpereigenen Immunsystem erkannt werden kann. Durch gezielten Austausch der Erkennungsregion wurde schon Ende der 1980er-Jahre begonnen, die Spezifität der deshalb so genannten chimären Antigen-Rezeptoren (CAR) im Sinne einer Therapie zu verändern, erläuterte Prof. Dr. med. Hinrich Abken, Leiter der Abteilung für Gen-Immuntherapie des Leibniz-Instituts der Universität Regensburg, in seinem Einführungsvortrag.
In den zurückliegenden Jahren wurden mehrere auf CAR-T-Zellen der zweiten Generation basierende Therapeutika gegen verschiedene Leukämie- und Lymphomarten zugelassen. Allerdings ist die Wirkung bei soliden Tumoren immer noch sehr beschränkt. So werden die CAR-T-Zellen im Körper unter anderem durch Tumornekrosefaktoren CD30-CD30L inaktiviert. Die CAR-T-Zellen wurden daraufhin weiter verändert, um ihrerseits das CD30-CD30L-System zu inaktivieren und damit die T-Zell-Aktivität zu erhalten.
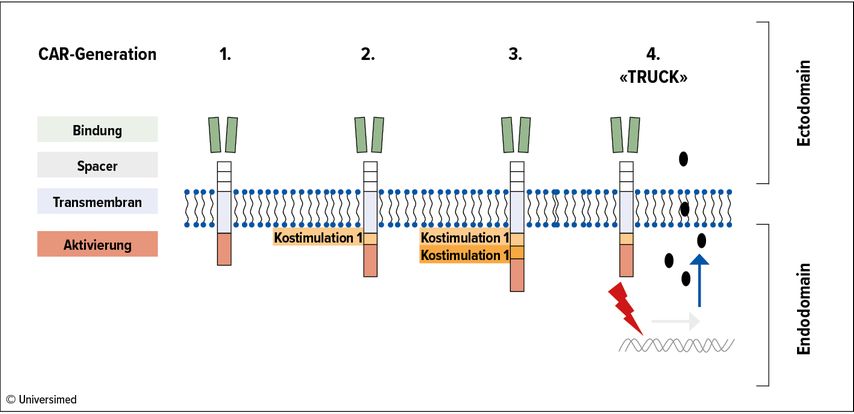
Weiterhin gibt es immer auch Zellen des Tumors, denen spezifische Antigene fehlen oder die sie verloren haben. Auch hierauf gibt es bereits Antworten1: Mit der Entwicklung von «TRUCK», «T-cells redirected for antigen-unrestricted cytokine-initiated killing», welche gezielt dafür verändert werden, Zytokine wie etwa Interleukin-12 freizusetzen. Dadurch sollen körpereigene unreife Immunzellen angeregt werden, Tumorzellen anzugreifen, die aufgrund fehlender Antigene nicht von den CAR-T-Zellen erkannt werden. «Zu der Aktivierung der CAR sind eine oder sogar mehrere Kostimulationen dazugekommen, die im Zusammenwirken die Effektivität stark verbessert», erläuterte Abken. «Bei den TRUCK sind aus lebendigen Wirkstoffen quasi lebendige Fabriken geworden, die bei Kontakt mit einem Tumorantigen sowohl sich selbst als auch andere Immunzellen weiter aktivieren können.» Abbildung 1 veranschaulicht die Entwicklung der CAR.
TRUCK treten auf vielfältige Weise mit anderen CAR-T-Zellen oder auch körpereigenen Zellen des Immunsystems in Kontakt und können somit auch als «Türöffner» für solide Tumoren fungieren. Denn im Inneren solider Tumoren gibt es häufig Zellen, die aufgrund des Selektionsdruckes die Antigene verlieren, die von den CAR-T-Zellen erkannt würden. Inzwischen können IL-18-TRUCK multiplen Lungenkrebsbefall kontrollieren und das Überleben von Versuchstieren signifikant verlängern.2 IL-12-CAR-T-Zellen können über die Expression von IL-12 andere Immunzellen dazu anregen, sich wie natürliche Killerzellen zu verhalten.3 Weiterhin können verschiedene Typen von CAR-T-Zellen und TRUCK auch ergänzend gegeben werden, wenn die molekulare Tumorbeschaffenheit dies erfordert.
Die Menge macht’s: Behandlung solider Tumoren mit infiltrierenden Lymphozyten
Einen einfachen Weg, multiple, aber unbekannte Antigene spezifisch zu erkennen und damit individuelle Tumoren zu therapieren, präsentierte Dr. med. Sebastian Klobuch, Netherlands Cancer Institute, Amsterdam. Die Kliniker*innen biopsieren einen Teil des Tumors, isolieren daraus die Lymphozyten, die den Tumor infiltriert haben, vermehren sie im Bioreaktor und infundieren Billionen von so gewonnenen tumorinfiltrierenden Lymphozyten (TIL) zurück in den/die Patient*in. Diese Methode wird in den Niederlanden aktuell gefördert und soll bei guten Ergebnissen erstattungsfähig werden. Allerdings sind auch die Erfahrungen des technischen Personals ausschlaggebend für die Kultivierung, wie Klobuch erklärte. Der Vorteil liegt darin, unbekannte und/oder durch Mutation neu entstehende Antigene der Tumorzellen erkennen zu können. Nach der Infusion der TIL erhalten die Patient*innen mehrfach hoch dosiertes IL-2, wodurch die Blutgefässe durchlässiger werden und somit viel mehr TIL in das Tumorgewebe gelangen. Darüber hinaus regt IL-2 die T-Zellen zu weiterer Aktivität und Wachstum an.
In einer Studie an Patient*innen mit Melanomen wurde gezeigt, dass insbesondere diejenigen von einer TIL-Therapie profitierten, deren Tumoren eine hohe Mutationsrate aufwiesen.4 Im Vergleich zu einer Therapie mit dem Immuncheckpoint-Inhibitor (ICI) Ipilimumab verlängerte sich das progressionsfreie Überleben (PFS) von Patient*innen mit inoperablen Melanomen im Stadium IIIc bis IV durch die TIL-Behandlung deutlich (7,2 vs. 3,1 Monate).5
Auch als Zweitlinientherapie nach Progression nach einem ICI zeigte die TIL-Behandlung eine Responderrate von 31%.6 Bei anti-PD-1-resistentem metastatischem nichtkleinzelligem Lungenkrebs (NSLC) in einer Phase-I-Studie dokumentierten die Kliniker*innen ebenfalls ein gutes Ansprechen der TIL-gestützten Therapie bei einigen Patient*innen, darunter auch Nichtraucher*innen. Andere Indikationen für einen Einsatz von TIL sieht Klobuch bei Zervix-, Plattenepithel- und Mammakarzinom sowie uvealem Melanom.
Ansätze zum therapeutischen Mehrwert von CAR-T-Zellen bei soliden Tumoren
Momentan laufen weltweit 532 klinische Studien mit CAR-T-Zellen, davon 78% zu hämatologischen und 20% zu soliden Malignitäten. Von diesen beziehen sich 19% auf Tumoren im oberen Gastrointestinaltrakt, 16% im zentralen Nervensystem sowie jeweils 10% im gynäkologischen und pädiatrischen Bereich, berichtete Dr. med. Sonia Guedan, August Pi i Sunyer Biomedical Research Institute (IDIBAPS) in Barcelona. Ihre eigenen Forschungen betreffen u.a. ebenfalls die Weiterentwicklung von CAR-T-Zellen zur Behandlung von HER2+ Brustkrebs. Mittlerweile gelang es, die Affinität der CAR-T-Zellen für dieses Antigen so weit zu erhöhen, dass auch Tumoren mit geringer HER2-Expression gleichermassen therapiert werden können wie solche mit hoher Expression dieses Antigens (noch unpubliziert).
Um andererseits die Aktivität der CAR-T-Zellen während der Therapie zu verlängern, veränderten die Forscher*innen das Oberflächenprotein CD28, das bei Aktivierung ein Signal zur Expression von insbesondere IL-6 initiiert. Dieses triggert die Immunantwort auf den Tumor. Durch den Austausch einer Aminosäure in der CD28-Region konnte die Aktivität der entsprechenden CAR-T-Zellen vervielfacht und somit therapeutisch wesentlich verbessert werden.7 Eine weitere Möglichkeit, die Effektivität der CAR-T-Zellen zu erhöhen, stellt eine Kombination mit Zellen dar, die veränderte onkolytische Adenoviren exprimieren.8 Eine solche synergistische Kombination kommt gegenwärtig bereits in einer klinischen Studie mit Pankreas- und Ovarialkarzinomen zum Einsatz.9
Die Erhöhung der Stärke der Bindung an das jeweilige Antigen in soliden Tumoren könne auch zulasten der Stabilität und Bioverfügbarkeit der CAR-T-Zellen gehen, resümierte Guedan. Deshalb sei eine ausgewogene Balance zwischen den kostimulatorischen Domänen der aufwendig aufgebauten Antigen-Rezeptoren notwendig, deren therapeutischer Wert auch durch zusätzliche Elemente unterstützt werden könne.
Immunotherapien bei der Behandlung gastrointestinaler Tumoren
Tumoren des oberen Gastrointestinaltraktes, ein wichtiges Forschungsfeld zum Einsatz innovativer Immunotherapien, waren das Thema des Vortrages von Dr. med. Elizabeth Smyth, Addenbrooke’s Hospital in Cambridge, UK. Momentan kommen diese Patient*innen nur selten ohne eine Chemotherapie aus, in fortgeschrittenen Stadien kommt Anti-PD-1-Therapie zum Einsatz. «Aber insgesamt müssen wir die Effektivität der ICI erhöhen», erklärte Smyth. Ihre Ansätze dazu sind die Kombination mit anderen ICI, die Kombination mit gezielter Therapie mit monoklonalen Antikörpern, die Blockierung der Angiogenese und neue Immuntherapeutika, basierend auf CAR-T-Zellen.
Die Kombination der beiden ICIs anti-PD-1 und anti-CTLA-4 verdoppelte das durchschnittliche PFS von 30% auf 60% nach 6 Monaten.10 Die Kombination mit einer gezielten Therapie mit Pembrolizumab zeigte ähnliche Ergebnisse.11 Die Blockierung der Angiogenese mit Lenvatinib12 oder Regorafenib kommt erst als Drittlinientherapie zum Tragen. Bisher gibt es dazu nur Studien mit kleinen Patient*innenzahlen, aber die Ansprechraten werden deutlich erhöht und die Toxizität ist tolerierbar. CAR-T-Zellen, die gegen Claudin 18.2 gerichtet sind, ein Oberflächenprotein von Magenepithelzellen, werden in einer ersten Phase-I-Dosiseskalationsstudie getestet. Die Ergebnisse lassen hoffen, in Zukunft bei bislang austherapierten gastrointestinalen Tumoren eine weitere Option zu haben.13
CAR-T-Zellen amplifizieren mRNA-Vakzine gegen Karzinome
Durch den Erfolg des Covid-19-mRNA-Impfstoffes sind auch Krebstherapeutika auf mRNA-Basis, an denen bereits seit vielen Jahren geforscht wird, in das Zentrum des Interesses gerückt. So gibt es inzwischen fixe Kombinationen von bekannten Krebsantigenen und individuell hergestellten Patient*innen-spezifischen Antigenen, die sich bereits in Phase-II-Studien gegen fortgeschrittenes Melanom, HPV16+ Kopf- und Halskrebs sowie Kolorektalkarzinome befinden.
Dr. med. Benjamin Rengstl, einer der Direktoren für klinische Entwicklung des Unternehmens BioNTech, Mainz, berichtete über Vakzin-basierte Ansätze und mRNA-Therapeutika mit dem Fokus auf «CAR T-cell-amplifying RNA vaccine» (CARVac).
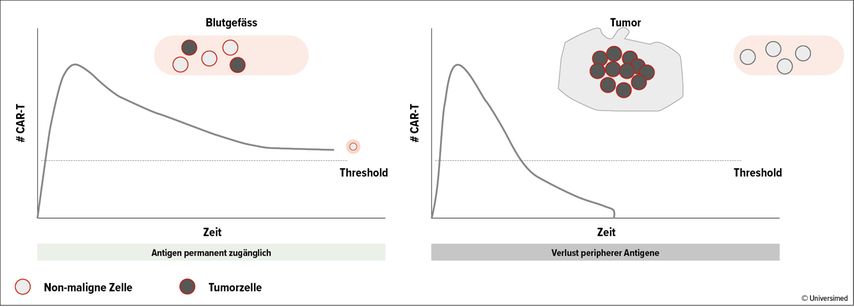
Die objektiven Responseraten von Tumorzellen im Blut und in soliden Tumoren zahlreicher Krebsarten korrelieren mit der Persistenz der therapeutisch verwendeten CAR-T-Zellen. Diese werden permanent abgebaut, persistieren aber oft in einer Konzentration, die einzelne maligne Zellen noch kontaktieren und in ausreichendem Masse eliminieren können. Bei soliden Tumoren allerdings reicht diese Konzentration nicht mehr aus, um ins Innere vorzudringen und dort Tumorzellen zu eliminieren (Abb. 2).14
Abb. 2: Die objektiven Ansprechraten korrelieren mit der Persistenz der CAR-T-Zellen. Threshold: Schwelle der effektiven Wirksamkeit. Modifiziert nach14
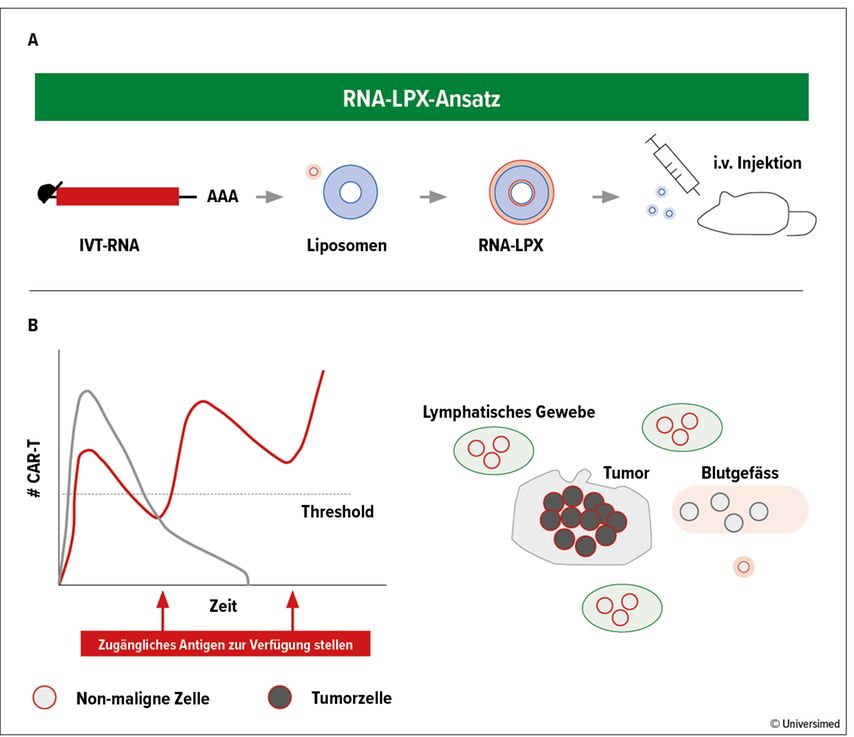
Diese Herausforderung nimmt die Entwicklung von RNA-Lipoplexen an (RNA-LPX, Abb. 3)15. Hierbei wird die für Antikörper codierende RNA an Liposomen gebunden und dann in Mäuse injiziert. Dadurch kann die RNA entweder gezielt, etwa in Milz und Lymphknoten, oder körperweit zu Antigen-präsentierenden Zellen (APCs) gebracht werden. Somit funktioniert sie wie ein Vakzin, das ein starkes Ansprechen auf das jeweilige Antigen bewirkt. Studienergebnisse zeigen, dass die RNA-LPX-«Impfung» eine wirksame Immunotherapie für Patienten mit ICI-resistentem Melanom darstellt.16
Abb. 3: A) Funktion der RNA-Lipoplexe (RNA-LPX). B) RNA-LPX steigern die Menge zugänglichen Antigens und somit die effektive Wirksamkeit der CAR-T-Zellen bei soliden Tumoren. Modifiziert nach 14, 15
Daraus könnte sich ergeben, dass nicht mutierte allgemein vorkommende Tumorantigene wie etwa Claudin 6 als Angriffspunkte für eine «Krebsimpfung» in der klinischen Praxis auch gegen solide Tumoren geeignet sind. Wird die RNA-LPX-Gabe wiederholt, bleibt die Menge der CAR-T-Zellen im Körper auf hohem Niveau.17
Quelle:
LION – Leipzig Immune ONcology Conference 2022, virtuell, 22.–23. November 2022
Literatur:
1 Holzinger A, Abken H: Pharmacology 2022; 107: 446-63 2 Chmielewski M, Abken H: Cell Rep 2017; 21: 3205-19 3 Hombach A et al.: Mol Ther 2022; 30: 593-605 4 Lauss M et al.: Nat Commun 2017; 8: 1738 5 Haanen J: 2022. Online unter https://dailyreporter.esmo.org/esmo-congress-2022/opinions/has-til-therapy-the-potential-to-change-cancer-treatment . Abgerufen am 10.2.2023 6 Sarnaik A: 2022. Online unter SITCancer.org2 7 Guedan S et al.: J Clin Invest 2020; 130: 3087-97 8 Wing A et al.: Cancer Immunol Res 2018; 6: 605-16 9 NIH: NCT05057715. 2022. Online unter ClinicalTrials.gov 10 Lorenzen S et al.: Ann Oncol 2022; 33(suppl_7): 555-80 11 Janjigian Y et al.: Nature 2021; 600: 727-30 12 Cohen D et al.: J Clin Oncol 2022; 49(suppl_4) 13 Qi C et al.: Nature Med 2022; 28: 1189-98 14 Hartmann J et al.: EMBO Mol Med 2017; 9: 1183-97 15 Kranz L et al.: Nature 2016; 534: 396-401 16 Sahin U et al.: Nature 2020; 585(7823): 107-12 17 Reinhard et al.: Science 2020; 367: 446-53 18 Holzinger A, Abken H: In: Introduction to Antibody Engineering. Hg.: Florian Rüker, Gordana Wozniak-Knopp. Springer, 2020
Das könnte Sie auch interessieren:
Adjuvantes Osimertinib reduziert ZNS-Rezidive bei EGFR-mutierter Erkrankung
Etwa 30% der Patienten mit nicht kleinzelligem Lungenkarzinom (NSCLC) präsentieren sich mit resezierbarer Erkrankung und werden einer kurativen Operation unterzogen. Viele Patienten ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...