KIT-D816V-Inhibitoren als zielgerichtete ISM-Therapien?
Bericht:
Torsten U. Banisch, PhD
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die Behandlung nichtfortschreitender Mastozytosen, wie der indolenten systemischen Mastozytose (ISM), beschränkte sich bisher auf nichtzielgerichtete Therapien und die Behandlung und Kontrolle von Symptomen.1–3 Die ersten klinischen Daten zur Wirkung neu entwickelter, spezifischer KIT-D816V-Inhibitoren zeigen erstmals Potenzial für zielgerichtete ISM-Therapien.4–6
Keypoints
-
Die nichtfortschreitenden Mastozytosen, darunter ISM, werden klinisch durch Hautläsionen, Anaphylaxie, gastroenterologische Symptome und Osteopenie/Osteoporose charakterisiert.
-
Bisherige Behandlungen von ISM erfolgten mit unspezifischen Therapieoptionen wie BSC-Medikamenten, Antihistaminika oder Omalizumab.
-
Neue KIT-D816V-Inhibitoren (Elenestinib, Bezuclastinib, Avapritinib) haben eine hohe Spezifität und konnten ihren Nutzen bereits in vorklinischen Studien zeigen.4–6
-
Die Behandlung mit Avapritinib erzielte Verbesserungen der ISM-Symptome gegenüber Placebo und führte zur Reduktion von Serum-Tryptase-Leveln, Mastzelllast und KIT-D816V-VAF.28
-
Aktuell laufen mehrere Phase-II-Studien zur Wirksamkeit von KIT-D816V-Inhibitoren bei ISM (PIONEER, SUMMIT, HARBOR).22,28,31
Mastozytosen entstehen durch eine Anhäufung und Aktivierung neoplastischer Mastzellen in der Haut, im Knochenmark oder in den inneren Organen.7–10 Sie werden in 95% der Fälle durch eine somatische «Gain of function»-Mutation der Rezeptor-Tyrosinkinase KIT (KIT D816V) verursacht.11–13
Diese äusserst heterogene Krankheit kann in nichtfortschreitende und fortgeschrittene systemische Mastozytosen unterteilt werden. Zur nichtfortschreitenden Kategorie zählen kutane Mastozytosen, die systemische Mastozytose des Knochenmarks und die indolente systemische Mastozytose (ISM), der häufigste Subtyp der systemischen Mastozytosen.14–16
Patient:innen mit ISM weisen häufig lebenslang Hautläsionen und gastroenterologische, neurokognitive, muskuloskelettale und systemische Störungen wie Anaphylaxie auf, die bei systemischen Mastozytosen besonders häufig und schwerwiegend ist.
Diese Symptome führen zu einer geringen Lebensqualität mit deutlichen Einschränkungen in Alltag und Arbeitsleben.13,17,18
Der Grossteil der ISM-Patient:innen wird derzeit polypharmazeutisch entsprechend «best supportive care» (BSC) behandelt.1–3 Die eingesetzten Therapeutika haben jedoch oft weitreichende Nebenwirkungen, zudem ist die Mehrzahl der Patient:innen resistent/refraktär gegen die bisherigen Behandlungsoptionen.19–21
Da es zurzeit keine wirksamen oder zugelassenen Therapien für KIT-D816V-verursachte ISM gibt, besteht ein hoher Bedarf an neuen, wirkungsvollen Behandlungsoptionen.
Verfügbare Behandlungsoptionen bei nichtfortschreitender Mastozytose
Die bisherigen Behandlungsoptionen bei nichtfortschreitenden Mastozytosen beschränken sich auf BSC-Therapeutika zur Symptombehandlung, darunter Antihistaminika, Omalizumab, Cromolyn-Natriumsalz und Allergen-Immuntherapie zur Mediatorenbehandlung oder Bisphosphonate und Denosumab zur Behandlung von Osteopenie/Osteoporose.19–21
Die Entwicklung neuer Therapien auf Grundlage des Typ-II-Tyrosinkinase-Inhibitors Imatinib oder eine Behandlung mit zielgerichteten Antikörpern scheiterten bisher an der Dosistoxizität.17
Entwicklung zielgerichteter KIT-D816V-Therapien
Die zugrunde liegende KIT-D816V-Mutation betrifft die Aktivierungsdomäne der Rezeptor-Tyrosinkinase KIT und resultiert in einem konstitutiv aktiven Protein. Dieses führt zu einer Überproliferation betroffener Mastzellen, deren Anhäufung in verschiedenen Geweben und schliesslich zu einer verstärkten Immunantwort.
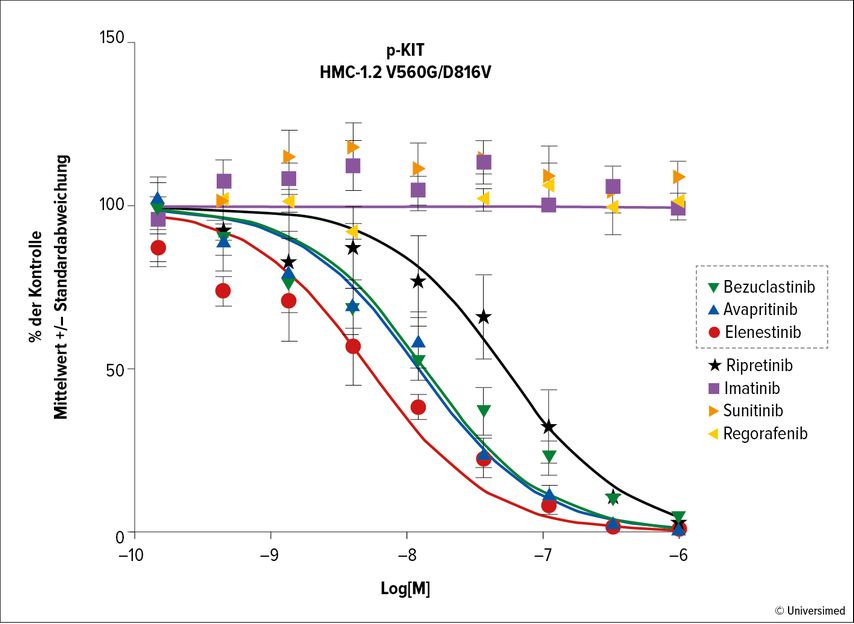
Eine neue Generation von Typ-I-Tyrosinkinase-Inhibitoren bindet selektiv die aktive Konformation der Kinase, inhibiert deren Autophosphorylierung und zeigt schon in geringen Dosen klinisch relevante Aktivitäten (Abb. 1).
Abb. 1: Bezuclastinib, Avapritinib und Elenestinib sind potente Inhibitoren von KIT D816V in humanen Mastzellen (HMC-1.2). Modifiziert nach Guarnieri A et al.4
Der KIT-Inhibitor Elenestinib (BLU-263) zeichnete sich in vorklinischen Studien durch robuste Inhibition von KIT D816V und durch ein gutes Sicherheitsprofil aus.4,22 Zudem zeigten Analysen, dass nur eine minimale Penetration ins ZNS vorliegt, wodurch das Auftreten von Nebenwirkungen minimiert werden sollte.4,23
Der KIT-Inhibitor Bezuclastinib (CGT 9486) hat eine nachweislich hohe Spezifität für KIT-Mutationen in den Exons 9, 11, 17 und 18 und für die D816V-Mutation. Die vorklinischen Analysen belegen eine Reduktion von Exon-17-Mutationen und eine damit zusammenhängende verringerte Tumorbelastung.5 Bezuclastinib zeigt zudem einen klinisch relevanten Nutzen bei der Behandlung von Patient:innen mit fortgeschrittener systemischer Mastozytose und führt nachweislich zu einer Senkung von Serum-Tryptase-Leveln und zu einer Reduktion der Mastzelllast und der KIT-D816V-Varianten-Allelfrequenz (VAF).24
Der KIT-Inhibitor Avapritinib (BLU-285) hat eine hohe Spezifität für Mutationen der Aktivierungsdomäne von KIT und des Thrombozyten-Wachstumsfaktor-Rezeptors alpha (PDGFRA).17,25,26 Erste Studien zur Behandlung von fortgeschrittenen systemischen Mastozytosen mit Avapritinib konnten bereits krankheitsverändernde Effekte dokumentieren, unter anderem eine Reduktion der Mastzelllast, eine Normalisierung von Organschädigungen und schliesslich Verbesserungen der objektiven Ansprechrate und der Überlebensrate.27 Die Zulassung der Avapritinib-Monotherapie zur Behandlung erwachsener Patient:innen mit aggressiver systemischer Mastozytose (ASM), systemischer Mastozytose mit assoziiertem hämatologischem Neoplasma (SM-AHN) oder Mastzellleukämie (MCL) nach mindestens einer systemischen Therapie erfolgte in der EU im März 202223 und in der Schweiz im Juli 2023.32
PIONEER-Studie zur Wirksamkeit des KIT-D816V-Inhibitors Avapritinib
Die randomisierte, placebokontrollierte, doppelt verblindete Phase-II-Studie PIONEER untersucht die Wirkung von Avapritinib+BSC bei Patient:innen mit ISM im Vergleich zu Placebo+BSC.28
Es handelt sich um eine dreiteilige Studie, wobei Teil 1 der Studie der Festlegung einer täglichen Dosis von Avapritinib zur Anwendung in Teil 2 und 3 der Studie diente. Die erste Analyse erfolgte an 39 Patient:innen und ermittelte eine empfohlene tägliche Dosis Avapritinib von 25mg. Teil 2 der Studie umfasste einen 24 Wochen langen Trial mit Patient:innen, die mindestens 18 Jahre waren und trotz mindestens zwei vorhergegangener optimierter BSC-Behandlungen unkontrollierbare ISM-Symptome mit einem TSS («total symptom score») ≥28 zeigten. Die Patient:innen wurden 2:1 randomisiert und erhielten entweder Avapritinib (n=141) oder Placebo (n=71). Im laufenden dritten Teil der Studie werden alle Patient:innen aus Teil 2 mit einer täglichen Dosis von 25mg Avapritinib über einen geplanten Zeitraum von fünf Jahren behandelt, wobei Patient:innen aus der Placebogruppe des zweiten Teils der Studie ebenfalls zu Avapritinib übergeführt werden.
Der primäre Endpunkt der Studie ist die Änderung des TSS vom Ausgangspunkt auf einer Skala von 0 bis 110, wobei höhere Werte schwerere Symptome indizieren. Die Daten wurden mittels ISM-SAF ermittelt, eines 12-Punkte-Fragenkatalogs, bei dem täglich der Schweregrad von elf ISM-Symptomen auf einer Skala von 0–10 dokumentiert wird. Zu den Symptomen gehören Unterleibsschmerzen, Übelkeit, Durchfall, Hautläsionen, Juckreiz, Erröten, Ermüdung, Kopfschmerzen, Schwindel und Knochenschmerzen. Als zwölfter Punkt wird die Häufigkeit von Durchfall ermittelt.
Zusätzlich wurden Hautläsionen in zeitlichen Abständen bildlich erfasst und Hautbiopsien zur Quantifizierung von Mastzellinfiltraten vorgenommen.
Als wichtigste Sekundärendpunkte dienten die Anzahl an Patient:innen mit einer ≥50%igen Reduktion der Serum-Tryptase-Level, die Anzahl an Patient:innen mit einer ≥50%igen Reduktion der KIT-D816V-VAF und schliesslich die Anzahl an Patient:innen mit einer ≥50%igen Reduktion der Mastzelllast, ermittelt durch eine Knochenmarksbiopsie.28
ISM-Therapieerfolge nach 24-wöchiger Behandlungzeit
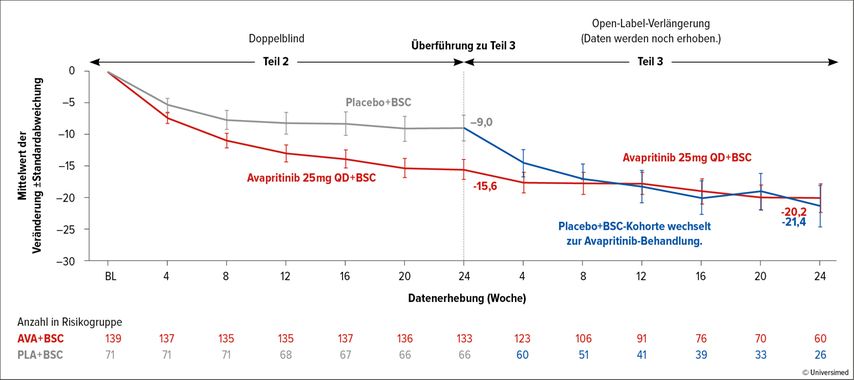
Die Endpunkte des zweiten Teils der PIONEER-Studie wurden nach einem Beobachtungszeitraum von 24 Wochen ermittelt. Hierbei konnte ein signifikant veränderter TSS-Wert bei Patient:innen unter Avapritinib von -15,6 Punkten gegenüber dem Ausgangswert ermittelt werden (95% CI: -18,6 bis -12,6) im Vergleich zu -9,2 Punkten im Kontrollarm (95% CI: -13,1 bis -5,2; p=0,003; Abb. 2).
Abb. 2: TSS-Schweregrade von ISM-Symptomen während des Behandlungszeitraumes. Modifiziert nach Gotlib J et al.28
Für die gesetzten sekundären Endpunkte konnte bei 54% der Patient:innen im Behandlungsarm eine ≥50%ige Verringerung der Serum-Tryptase-Level ermittelt werden, im Vergleich zu 0% im Kontrollarm (p<0,001). 68% der mit Avapritinib behandelten Patient:innen zeigten eine ≥50%ige Verringerung der KIT-D816V-Varianten-Allelfrequenz (VAF) im Vergleich zu 6% (p<0,001). Zudem zeigten 53% der Avapritinib-Patient:innen eine ≥50%ige Verringerung der Mastzelllast im Knochenmark gegenüber 23% im Vergleichsarm (p<0,001).28
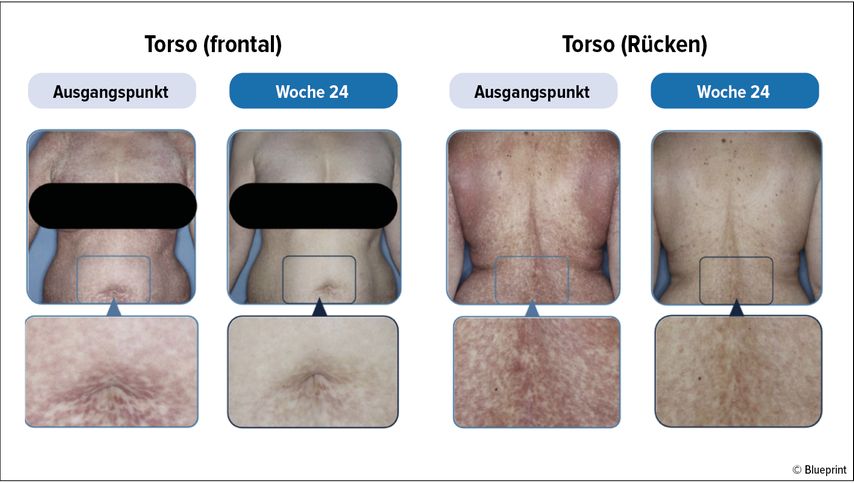
Um etwaige Veränderungen von Hautläsionen zu erfassen, wurden von freiwilligen Patient:innen unter Avapritinib (n=74) und Placebo (n=37) die meistbetroffenen Hautregionen zu Beginn der Studie und danach alle zwölf Wochen bildlich erfasst (dargestellt in Abb. 3). Die Analysen mit einem computergenerierten Algorithmus ermittelten unter anderem eine verringerte Ausdehnung der Hautläsionen von -36,6% unter Avapritinib gegenüber -1,8% unter Placebo.29
Abb. 3: Verbesserung von Ausdehnung und Färbung der Hautläsionen nach 24-wöchiger Avapritinib-Behandlung. Modifiziert nach Maurer M et al.29
Im dritten Teil der PIONEER-Studie werden sowohl Patient:innen aus dem Avapritinib-Arm als auch solche aus dem Kontrollarm mit Avapritinib behandelt. Erste Daten zeigen, dass Patient:innen, die zuvor Avapritinib erhalten haben, eine Langzeitverbesserung des TSS aufweisen.28
Verbesserte Lebensqualität während des Behandlungszeitraums
Zur Analyse der Lebensqualität während des Behandlungszeitraums dienten die Werte aus verschiedenen Fragebögen: Der EQ-VAS-Fragebogen («European Quality of Life» – visuelle Analogskala) zeigte eine Verbesserung der Werte um 19% im Behandlungszeitraum gegenüber 5% im Kontrollarm. Ein Fragebogen zur Lebensqualität von Patient:innen mit Mastozytose (MC-QoL) ermittelte eine Reduktion der Beschwerden um 34% unter Avapritinib im Vergleich zu 18% unter Placebo. Auch die SF-12-Fragebögen (physische und mentale Skalenwerte) zeigten Verbesserungen.28
Behandlungsbedingte Nebenwirkungen jeder Art traten bei 54,6% der Patient:innen im Behandlungsarm und bei 45,1% der Patient:innen im Kontrollarm auf. Die häufigsten Nebenwirkungen waren Kopfschmerzen, Übelkeit, Ödeme und Schwindelgefühl.30
HARBOR-Studie untersucht die Wirksamkeit des KIT-D816V-Inhibitors Elenestinib
Die laufende Phase-II/III-Studie HARBOR untersucht die Wirksamkeit und Sicherheit des KIT-Inhibitors Elenestinib (BLU-263)+BSC bei Patient:innen mit ISM, deren Symptome nicht adäquat mit BSC kontrolliert werden können.22 Der primäre Endpunkt der Studie ist die Anzahl an Patient:innen, die eine ≥30%ige Reduktion im TSS erreichen. Im Anschluss sollen Patient:innen im offenen Teil der Studie für maximal fünf Jahre behandelt und beobachtet werden.
Es ist anzumerken, dass erste Analysen aus der Vorklinik belegen, dass Elenestinib eine minimale ZNS-Penetranz aufweist, mit Werten weit unter denen von Avapritinib, bei äquivalenter Wirksamkeit.4
SUMMIT-Studie zur Wirksamkeit des KIT-D816V-Inhibitors Bezuclastinib
Die laufende doppelblinde, placebokontrollierte Phase-II-Studie SUMMIT untersucht die Wirkung des KIT-Inhibitors Bezuclastinib (CGT9486) bei Patient:innen mit ISM und schwelender systemischer Mastozytose (SSM), die mindesten zwei vorhergehende BSC-Behandlungen erhalten haben.31 Der primäre Endpunkt der Studie ist die absolute Änderung der krankheitsspezifischen «patient-reported outcomes» (PRO). Der Studie ist eine einjährige Analyse des Sicherheitsprofils der Bezuclastinib-Therapie angeschlossen.
Ausblick
Die ersten positiven Daten zur Wirkung von Elenestinib und Bezuclastinib und die Ergebnisse der Avapritinib-Studie unterstreichen den Nutzen von KIT-D816V-Inhibitoren bei der Behandlung von nichtfortschreitenden Mastozytosen, insbesondere bei ISM. Die vorgestellten Studien haben somit das Potenzial, erstmals zielgerichtete Therapien zur Behandlung von ISM hervorzubringen.
Quelle:
«Non-advanced mastocytosis: clinical manifestation and management», Vortrag von Prof. Dr. med. Karin Hartmann, Macrophage – Histiocyte – Mast Cell – Symposium 2023, 30. Juni 2023, Wien
Literatur:
1 Akin C et al.: J Allergy Clin Immunol 2022; 149: 1912-8 2 Pardanani A: Blood 2013; 121: 3085-94 3 Pardanani A: Am J Hematol 2021; 96: 508-25 4 Guarnieri A et al.: Cancer Res 2022; 82(Suppl. 12): 147 5 Wagner AJ: J Clin Oncol 2018; 36(Suppl. 15): 11509 6 DeAngelo DJ et al.: Nat Med 2021; 27: 2183-91 7 Lim KH et al.: Blood 2009; 113: 5727-36 8 Hermine O et al.: PLoS One 2008; 3: e2266 9 Pardanani A et al.: Blood 2009; 114: 3769-72 10 Akin C et al.: Ann Rev Med 2004; 55: 419-32 11 Garcia-Montero AC et al.: Blood 2006; 108: 2366-72 12 Chatterjee A et al.: Oncotarget 2015; 6: 18250-64 13 Orfao A et al.: Br J Haematol 2007; 138: 12-30 14 Horny HP et al.: WHO Classification of Tumours 2016 15 Hartmann K et al.: WHO Classification of Skin Tumours 2018 16 Sotlar K et al.: J Allergy Clin Immunol Pract 2022; 10(8): 1986-98.e2 17 Evans EK et al.: Sci Transl Med 2017; 9: eaao1690 18 Pardanani A: Am J Hematol 2019; 94: 363-77 19 Mesa RA et al.: Cancer 2022; 128: 3691-9 20 Cardet JC et al.: Expert Opin Pharmacother 2013; 14: 2033-45 21 Reiter A et al.: Blood 2020; 135(16): 1365-76 22 Castells M et al.: Hemasphere 2022; 6(Suppl.): 907-8 23 Fachinformation Ayvakyt®, Stand März 2022 24 DeAngelo DJ et al.: EHA Congress 2022; AB P1049 25 Evans E et al.: Blood 2015; 126: 568 26 Evans E et al.: Blood 2014; 124: 3217 27 DeAngelo DJ et al.: Nat Med 2021; 27: 2183-91 28 Gotlib J et al.: N Engl J Med 2023; doi: 10.1056/EVIDoa2200339 29 Maurer M et al.: JAllergy Clin Immunol 2023; 151: AB340, 10.1016/j.jaci.2022.12.795 30 Castells M et al.: J Allergy Clin Immunol 2023; 151: AB204, 10.1016/j.jaci.2022.12.635 31 Siebenhaar OF et al.: Blood 2021; 138(Suppl. 1): 3642 32 Fachinformation Ayvakyt®, www.swissmedic.ch
Das könnte Sie auch interessieren:
Adjuvantes Osimertinib reduziert ZNS-Rezidive bei EGFR-mutierter Erkrankung
Etwa 30% der Patienten mit nicht kleinzelligem Lungenkarzinom (NSCLC) präsentieren sich mit resezierbarer Erkrankung und werden einer kurativen Operation unterzogen. Viele Patienten ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...