Immuntherapie und Thrombose bei onkologischen Patienten
Autor:
Dr. Florian Moik
Medizinische Universität Wien
Universitätsklinik für Innere Medizin I
Klinische Abteilung für Hämatologie und Hämostaseologie
E-Mail: florian.moik@meduniwien.ac.at
Immuncheckpoint-Inhibitoren halten zunehmend Einzug in die Behandlung von Patienten mit Krebserkrankungen. Rezente Daten weisen auf ein signifikantes Risiko für thrombotische Komplikationen unter dieser neuen antineoplastischen Therapiemodalität hin.
Keypoints
-
Patienten unter einer Therapie mit Immuncheckpoint-Inhibitoren haben ein substanzielles Risiko für venöse und arterielle Thromboembolien.
-
Thrombotische Komplikationen unter Immuntherapie sind mit einer höheren Mortalität und Morbidität assoziiert.
-
Bekannte prothrombotische Risikofaktoren prädizieren das Risiko für venöse Thromboembolien unter Immuntherapie nur ungenügend.
Patienten mit Krebserkrankungen haben ein erhöhtes Risiko für thromboembolische Ereignisse.1 Dieses Risiko wird zum einen durch patientenspezifische Faktoren und die Tumorerkrankung selbst beeinflusst, zum anderen erhöhen jedoch auch krebsspezifische Therapien wie Bestrahlungen, Operationen, Platin-basierte Chemotherapien oder zielgerichtete Antiangiogenese-Wirkstoffe das thrombotische Risiko.2
In den letzten Jahren werden zunehmend Immuncheckpoint-Inhibitoren in der Behandlung maligner Erkrankungen eingesetzt. Durch eine Enthemmung der anti-tumoralen Immunantwort konnten bei einigen Krebserkrankungen eindrucksvolle Verbesserungen der Prognose erreicht werden, gekennzeichnet vor allem durch die Möglichkeit eines lang anhaltenden Therapieansprechens und Überlebens trotz fortgeschrittener Krebserkrankungen bei einem Teil der behandelten Patienten. Gerade in Hinblick auf das zugrundeliegende meist fortgeschrittene Tumorstadium, den Grad an onkologischen Vortherapien und die behandelten Tumortypen mit bekanntermaßen intermediärem bis hohem thrombotischem Risiko wäre ein gewisses zugrundeliegendes Thromboserisiko zu erwarten gewesen. Interessanterweise wurde in den wegweisenden klinischen Studien zu Immuncheckpoint-Inhibitoren nicht über die Häufigkeit von venösen Thromboembolien (VTE), also tiefen Phlebothrombosen oder Lungenembolien, oder arteriellen thrombotischen Ereignissen (ATE), also Myokardinfarkten, ischämischen Insulten und akuten peripheren arteriellen Verschlüssen, berichtet.
Risiko für thrombotische Ereignisse unter Immuntherapie
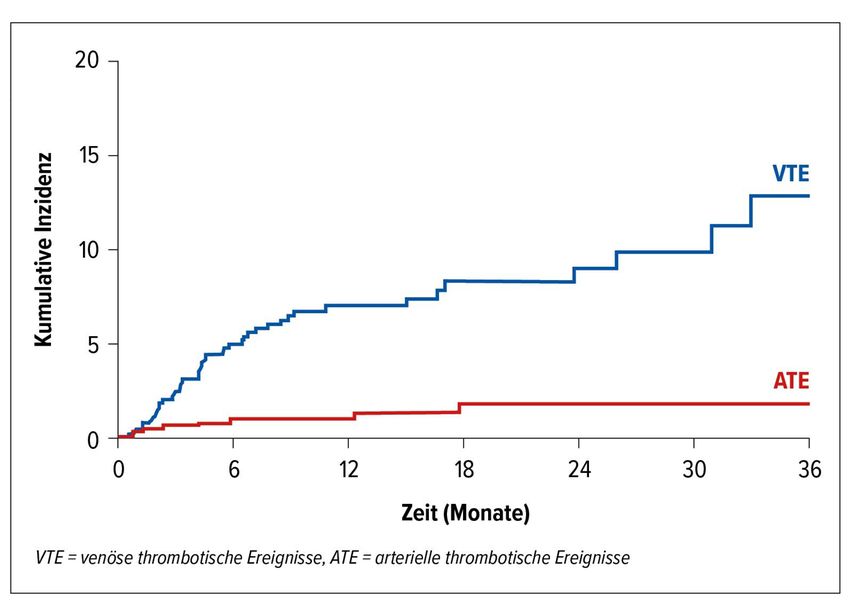
Jüngste, kumulierende Daten aus Kohortenstudien berichten nun über ein substanzielles Risiko für thrombotische Komplikationen unter Immuncheckpoint-Inhibitor-Therapien. In einer groß angelegten Kohortenstudie an der Medizinischen Universität Wien wurden alle Patienten, die zwischen 2015 und 2018 mit einem Immuncheckpoint-Inhibitor behandelt wordenwaren, eingeschlossen (n=672) und Daten zum Risiko und zu den klinischen Konsequenzen venöser und arterieller Thromboembolien gesammelt.3 Die häufigsten inkludierten Tumortypen waren Lungenkarzinome (33%), gefolgt von Melanomen (27%) und Nierenzellkarzinomen (10%). Die meisten Patienten hatten eine metastasierte Krebserkrankung (89%). Über die Dauer der Immuntherapie hinweg, mit einem medianen Beobachtungszeitraum von 8,5 Monaten, wurde eine kumulative Inzidenz für VTE von 12,9% (95% CI: 8,2–18,5) und für ATE von 1,8% (95% CI: 0,7–3,6) beobachtet (Abb. 1). Diese Raten decken sich gut mit weiteren kürzlich erschienenen Beobachtungsdaten. Kewan et al. berichten in einer Kohorte von Patienten mit metastasierten Krebserkrankungen unter Immuncheckpoint-Inhibitoren (n=552) ein Risiko für VTE von 10,5% und ATE von 1,3%.4 Sussman et al. bestätigen dieses hohe Risiko in einer Kohorte von Melanompatienten, mit einem 12-Monats-Risiko für VTE von 12,9% und für ATE von 4,5%.5
Abb. 1: Kumulative Inzidenz venöser und arterieller thromboembolischer Ereignisse bei Patienten an der MedUni Wien unter Therapie mit Immuncheckpoint-Inhibitoren im Zeitraum von 2015 bis 2018 (adaptiert nach Moik et al.)3
Klinische Konsequenzen
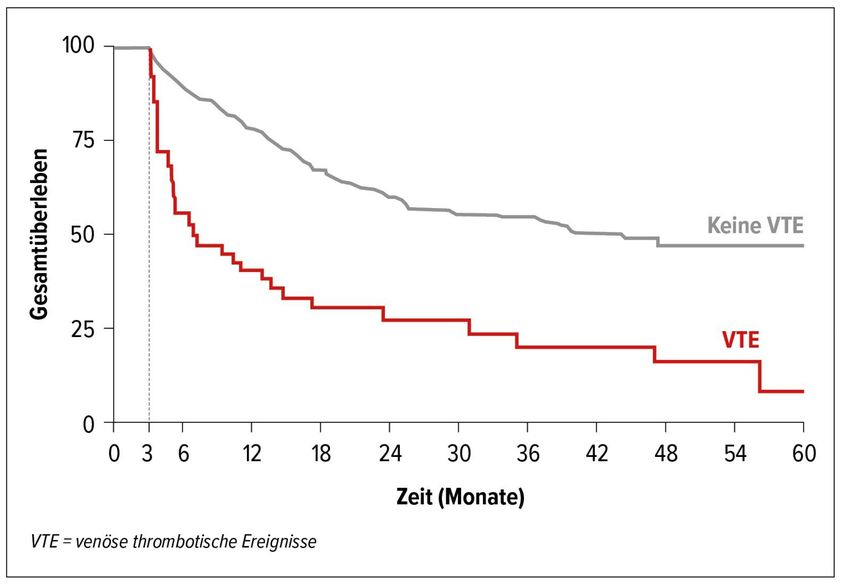
Thrombotische Komplikationen scheinen mit einer erhöhten Mortalität und Morbidität bei Patienten unter Immuncheckpoint-Inhibitor-Therapie assoziiert zu sein. Moik et al. berichten von einem dreifach erhöhten Mortalitätsrisiko nach VTE-Diagnose unter der Immuntherapie (Abb.2). Diese Assoziation ist nur zum Teil durch die direkte VTE-spezifische Mortalität erklärbar (beobachtete „case fatality rate“: 4%). Darüber hinaus scheint die VTE jedoch vor allem Indikator für aggressivere und fortschreitende Krebserkrankungen unter Immuncheckpoint-Inhibitoren zu sein, mit einem vierfach erhöhten Risiko für Tumorprogression nach einer VTE-Diagnose, gekennzeichnet durch ein medianes progressionsfreies Überleben von nur 1,7 Monaten nach VTE, verglichen mit 6,7 Monaten bei Patienten ohne VTE.
VTE und ATE führten zudem häufig zu einer Verzögerung oder sogar Abbrüchen der Immuncheckpoint-Inhibitor-Therapie, und die Antikoagulations-Therapie der VTE war gekennzeichnet durch ein signifikantes Risiko für Rezidiv-Thrombosen und Blutungen.3 Diese Beobachtungen unterstreichen die klinische Relevanz von Thromboembolien bei Patienten mit Krebs unter einer Immuntherapie.
Abb. 2: Gesamtüberleben von Patienten unter Therapie mit Immuncheckpoint-Inhibitoren in Hinblick auf das Auftreten venöser thrombotischer Ereignisse (adaptiert nach Moik et al.)3
Risikofaktoren
Das thrombotische Risiko scheint über verschiedene Tumortypen und spezifische Immuncheckpoint-Inhibitoren hinweg homogen hoch zu sein.3,4 Bekannte klinische Risikofaktoren wie Alter, Geschlecht, Allgemeinzustand oder Charlson Comorbidity Index prädizieren das VTE-Risiko unter Immuncheckpoint-Inhibitoren nicht. Interessanterweise konnte auch der Khorana-Score, ein empfohlenes Modell zur Risikostratifizierung für VTE bei ambulanten Patienten mit Krebs, das VTE-Risiko unter Immuncheckpoint-Inhibitoren nicht prädizieren.3,4 Identifizierte Risikofaktoren für VTE unter der Immuntherapie waren eine vorhergehende VTE sowie ein höheres Tumorstadium.3
Kausalität oder zugrundeliegendes Risiko?
Die substanziellen beobachteten Raten thrombotischer Komplikationen werfen die Frage nach einem zugrundeliegenden kausalen prothrombotischen Effekt einer Immuncheckpoint-Inhibitor-Therapie auf. Die enge physiologische Vernetzung des Blutgerinnungssystems mit inflammatorischen Mechanismen bietet eine pathophysiologische Rationale für das beobachtete prothrombotische Risiko. Speziell im Hinblick auf die autoimmunologischen Nebenwirkungen durch den starken systemischen inflammatorischen Stimulus durch Immuncheckpoint-Inhibitoren, in Kombination mit dem bekannten erhöhten thrombotischen Risiko von Patienten mit Autoimmunerkrankungen, scheint eine kausale Rolle der Immuntherapie in Bezug auf das hohe thrombotische Risiko möglich. Weiters gibt es Hinweise auf einen kausalen proatherosklerotischen Effekt bei Hemmung der PD-1-Signalachse, was eine konzeptuelle Basis für einen möglichen kausalen Zusammenhang der Immuncheckpoint-Inhibitor-Therapie mit ATE bietet.
Es muss jedoch betont werden, dass die aktuellen Beobachtungsdaten keine kausalen Schlüsse zulassen und robuste, vergleichende Daten zum thrombotischen Risiko unter Immuncheckpoint-Inhibitoren derzeit fehlen. Das beobachtete thrombotische Risiko von Patienten unter einer Immuntherapie könnte demnach schlicht das zugrundeliegende Basisrisiko dieser Patientenpopulation widerspiegeln, beeinflusst durch den zugrundeliegenden Tumortyp, das Tumorstadium und den oft erheblichen Grad an onkologischen Vortherapien. Nichtsdestoweniger, unabhängig von möglicher Kausalität, ist es jedoch essenziell, mehr Bewusstsein für diese potenziell lebensbedrohlichen Komplikationen unter Immuncheckpoint-Inhibitoren zu schaffen.
Durch das Entstehen einer Population an Patienten mit lang anhaltendem Therapieansprechen und verlängerten Überlebenszeiten unter dieser neuen Therapiemodalität gewinnen die Charakterisierung, die Prävention und die bessere Behandlung sekundärer Faktoren von Morbidität und Mortalität zunehmend an Bedeutung. Zukünftige Studien zur Identifizierung von Hochrisiko-Populationen basierend auf Risikofaktoren und Biomarkern spezifisch für Patienten unter Immuncheckpoint-Inhibitoren können daher dazu führen, zielgerichtete Präventionskonzepte und Strategien für thrombotische und kardiovaskuläre Komplikationen zu entwickeln, um die Prognose und die Qualität der Behandlung dieser Patienten zukünftig weiter zu verbessern.
Literatur:
1 Mulder FI et al.: Venous thromboembolism in cancer patients: a population-based cohort study. Blood 2021; 137(14): 1959-69 2 Moik F et al.: Risk prediction for cancer-associated thrombosis in ambulatory patients with cancer: past, present and future. Thromb Res 2020; 191(Suppl1): S3-11 3 Moik F et al.: Incidence, risk factors, and outcomes of venous and arterial thromboembolism in immune checkpoint inhibitor therapy. Blood 2021; 137(12): 1669-78 4 Kewan T et al.: Prognostic impact and risk factors of cancer-associated thrombosis events in stage-IV cancer patients treated with immune checkpoint inhibitors. Eur J Haematol 2021; 106(5): 682-8 5 Sussman TA et al.: Incidence of thromboembolism in patients with melanoma on immune checkpoint inhibitor therapy and its adverse association with survival. J Immunother Cancer 2021; 9(1): e001719
Das könnte Sie auch interessieren:
Adjuvantes Osimertinib reduziert ZNS-Rezidive bei EGFR-mutierter Erkrankung
Etwa 30% der Patienten mit nicht kleinzelligem Lungenkarzinom (NSCLC) präsentieren sich mit resezierbarer Erkrankung und werden einer kurativen Operation unterzogen. Viele Patienten ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...