
Immuntherapie versus zielgerichtete Therapie – Argumente und Datenlage
Ob in der Erstlinientherapie des fortgeschrittenen Melanoms – bei Vorliegen einer BRAF-Mutation – lieber eine Immuntherapie oder eine zielgerichtete Therapie eingesetzt werden sollte, wird kontrovers diskutiert. Auch zur doppelten versus Mono-Checkpoint-Blockade sind die Meinungen geteilt. Beim 30. Deutschen Hautkrebskongress (ADO 2020) wurde die Datenlage zu diesen Themenkomplexen aufgegriffen und es wurden Argumente für einzelne Vorgehensweisen ausgetauscht.
Patienten mit metastasiertem oder inoperablem Melanom, bei denen eine BRAFV600E/K-Mutation nachgewiesen wurde und die keine Kontraindikation für eine der beiden Medikationen aufweisen, können in der ersten Therapielinie eine Immuntherapie oder eine zielgerichtete Therapie erhalten. Hilfen für die Therapieentscheidung sind die in den Studien erhobenen Therapieziele, also Lebensverlängerung (Gesamtüberleben, OS), Symptomkontrolle (Ansprechrate, ORR; progressionsfreies Überleben, PFS) und der Erhalt oder die Verbesserung der Lebensqualität. Prof. Dr. Ralf Gutzmer, Medizinische Hochschule Hannover, hatte zur Aufgabe, Argumente für die zielgerichtete Erstlinientherapie zu liefern, Prof. Dr. Bastian Schilling, Uniklinikum Würzburg, brachte Argumente für die Immun-Erstlinientherapie.
BRAF/MEK-Inhibition als Erstlinientherapie – Argumente und Datenlage
Das schlagende Argument für die Patienten sei die Effektivität, bemerkte Gutzmer, und da spreche die Wirkdauer deutlich für den Beginn mit einer Immuntherapie. Unter kombinierter Therapie mit Nivolumab plus Ipilimumab wurde in der CheckMate 067-Studie eine 5-Jahres-Überlebensrate von 52% erreicht.1 Die 5-Jahres-Überlebensrate für Dabrafenib plus Trametinib in der COMBI-D/COMBI-V-Studie2 und für Vemurafenib plus Cobimetinib in der coBRIM-Studie3 lag deutlich niedriger, bei unter 35%.
Es gebe aber auch Argumente bezüglich der Wirksamkeit für die Erstlinientherapie mit einer zielgerichteten BRAF/MEK-Inhibition. Im Vergleich der Ansprechraten kam die kombinierte Immuntherapie „nur“ auf 58%, während ein Ansprechen unter den BRAF/MEK-gerichteten Regimen bei 69% der Patienten mit Dabrafenib plus Trametinib in der COMBI-D/COMBI-V-Studie, 70% mit Vemurafenib plus Cobimetinib in der coBRIM-Studie und 64–76% mit Encorafenib plus Binimetinib in der COLUMBUS-Studie4 beobachtet wurde. Auch aus der Zeit bis zum Wirkeintritt und den in der Regel reversiblen Nebenwirkungen zieht Gutzmer positive Aspekte für die zielgerichtete Therapie. Bei bestimmten Subgruppen wird eine Annäherung der 5-Jahres-Überlebensraten gesehen, beispielsweise bei Patienten mit LDH-Normwert und weniger als 3 befallenen Organen. Bei dieser Subgruppe schrumpfte der 5-Jahres-Überlebensvorteil der Immunkombination auf 9% gegenüber der zielgerichteten Therapie mit Dabrafenib/Trametinib, im Vergleich zur PD-1-Monotherapie sogar auf 3%. Ein weiterer Unterschied zwischen den Substanzklassen besteht imApplikationsweg, oral versus intravenös. Er erlebe es allerdings häufig, dass Patienten die intravenöse Applikation und nicht etwa die Tabletten bevorzugen, erklärte Gutzmer.
In der adjuvanten Situation verglich Gutzmer Ergebnisse der COMBI-AD-Studie (Dabrafenib plus Trametinib)5 mit denen der KEYNOTE-054-Studie (Pembrolizu-mab)6, die bei einem ähnlichen Patientenkollektivim Vergleich mit Placebo erhoben wurden. Das rezidivfreie Überleben (RFS) derBRAF-mutierten Patienten ist mit einer Hazard-Ratio von jeweils 0,51 und 3-Jahres-RFS-Raten von 59% bzw. 62% vergleichbar (Abb. 1). Bei vergleichbarer Effektivität rücken andere Argumente, wie die reversiblen versus zum Teil nicht reversiblen oder zumindest langfristig beeinträchtigenden Nebenwirkungen, in den Vordergrund, begründete Gutzmer den möglicherweise zu bevorzugenden adjuvanten Einsatz einer zielgerichteten Therapie.
Gutzmer resümierte, dass in der metastasierten Situation in der ersten Therapielinie grundsätzlich eine Immuntherapie gegeben werden sollte, es sei denn, es gebe spezielle Gründe für den Einsatz einer zielgerichteten Therapie. In der adjuvanten Situation seien Immun- und zielgerichtete Therapien vergleichbar effektiv, weswegen andere Kriterien entscheidend seien, die eher für die zielgerichtete Therapie sprächen. Insgesamt sei man froh über die Verfügbarkeit beider Therapiestrategien, die sich als Kombinationen oder in der Therapiesequenz ergänzen können.
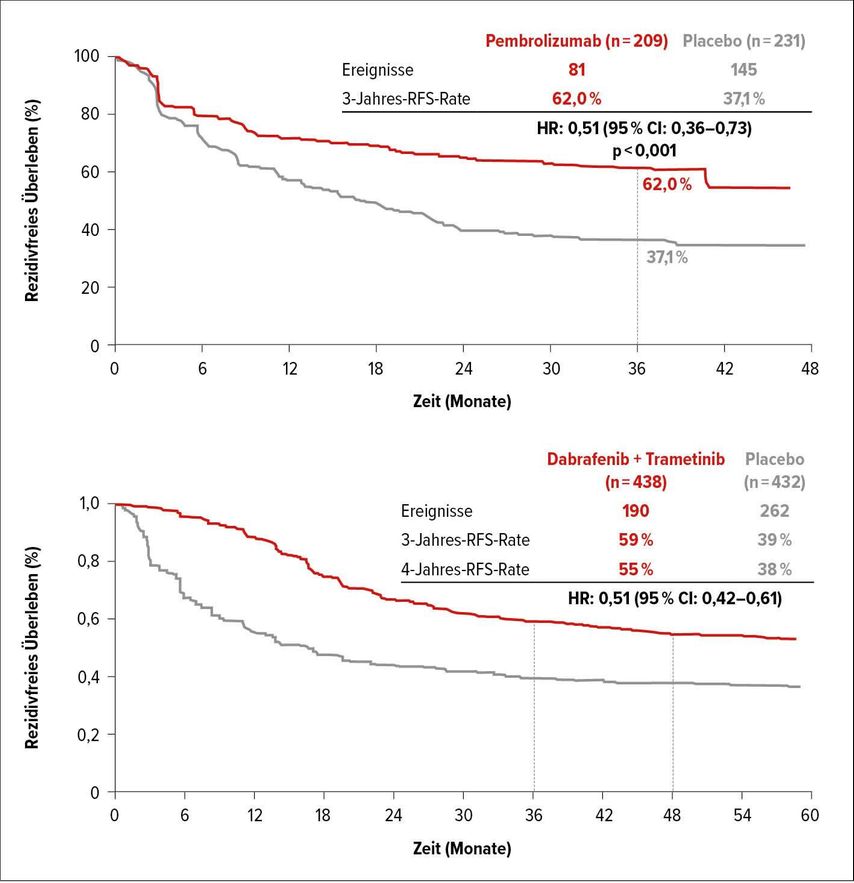
Abb. 1: Rezidivfreies Überleben (RFS) unter adjuvanter Gabe von Pembrolizumab (oben) und Dabrafenib plus Trametinib (unten), jeweils versus Placebo (nach Hauschild A et al. & Eggermont AM et al.)5, 6
Immuntherapie als Erstlinientherapie – Argumente und Datenlage
Auch Schilling erklärte, dass die Ergebnisse zum Gesamtüberleben klar für die Immuntherapie als Erstlinientherapie sprechen. Schilling ging in seinen Vergleichen nur auf die BRAF-mutierte Subgruppe unter den immunonkologischen Regimen ein. Die 5-Jahres-OS-Rate betrug für diese Patientenkohorte unter Ipilimumab plus Nivolumab 60%.1 Auch die Ergebnisse zum progressionsfreien Überleben sprächen, so Schilling, klar für die Immuntherapie mit einer 5-Jahres-PFS-Rate von 38% bei nicht erreichter Ansprechdauer unter Nivolumab plus Ipilimumab versus eine 5-Jahres-PFS-Rate von 19% und eine Ansprechdauer von ungefähr 12 Monaten unter Dabrafenib plus Trametinib.1,2 Das spätere Ansprechen, das den Immuntherapien nachgesagt werde, finde sich schon nach einem Jahr in den PFS-Daten mit ca. 60% versus ca. 50% Ansprechen nicht mehr. Nach 3 Monaten liegt die Ansprechrate noch bei etwa 80% unter Immuntherapie versus >90% unter zielgerichteter Kombination und nach 6 Monaten bei ca. 75% versus ca. 80%. Schilling wies auch darauf hin, dass der Wirksamkeitsvorteil der Immuntherapie nicht mit einer vorteilhafteren Patientencharakteristik erklärbar sei. Insbesondere bei Patienten mit schlechter Prognose, beispielsweise bei erhöhtem LDH-Wert, ist die Immuntherapie der zielgerichteten Therapie überlegen – nach 5 Jahren waren 28% versus 8% der Patienten ohne Progress. Übrigens lag die PFS-Rate schon nach 2Jahren unter BRAF/MEK-gerichteter Therapie bei nur 14%.
Dass symptomatische Patienten zur Palliation ein rasches Ansprechen und deswegen eine zielgerichtete Therapie brauchen, gelte nur in Ausnahmen, wie bei symptomatischen Hirnmetastasen oder Passagestörungen, bemerkte Schilling. Symptome wie Schmerzen, Stenosen, Asthenie etc. könnten in der Regel zunächst symptomatisch behandelt werden, allerdings unter Immuntherapie nur ohne Steroide. Ob die Ansprechrate unter der kombinierten Immuntherapie für die Subgruppe der BRAF-mutierten Patienten tatsächlich geringer sei verglichen mit der zielgerichteten Therapie, sei nicht bekannt, da die ORR-Daten diesbezüglich bisher nicht veröffentlicht wurden. Postow und Kollegen zeigten allerdings beim diesjährigen ASCO, dass auch unter der Immuntherapie mit Ipilimumab plus Nivolumab ein Ansprechen früh, meist innerhalb der ersten zwei Zyklen, erfolgt (Tab. 1).7
Patienten, die ohne Not eine BRAF/MEK-gerichtete Erstlinientherapie erhalten, haben möglicherweise sogar einen Nachteil, worauf eine aktuelle Auswertung der Studien KEYNOTE 001, 002 und 006 hinweist.8 Erhielten Patienten mit BRAF-mutiertem Melanom Pembrolizumab nach einer BRAF±MEK-gerichteten Therapie, so deuteten die Charakteristika bei Therapiebeginn auf eine schlechtere Prognose hinverglichen mit Patienten ohne vorhergegangene BRAF±MEK-Blockade. Dies bewahrheitete sich bezüglich des Ansprechens (28,4% vs. 44,2%), der 4-Jahres-PFS-Rate (15,2% versus 27,8%) und der 4-Jahres-OS-Rate (26,9% versus 49,3%).
Ein weiteres Argument, das gerne für die bevorzugte Anwendung einer zielgerichteten Therapie in der ersten Therapielinie angeführt wird, sind die schweren Nebenwirkungen unter einer Immuntherapie, konstatierte Schilling. Es sei unter der nebenwirkungsreichen Immuntherapie aber keine Abnahme der Lebensqualität beobachtet worden.9 Die Mehrheit der schweren Nebenwirkungen ist reversibel und irreversible Nebenwirkungen sind unter einer Begleittherapie häufig asymptomatisch und gut erträglich. Wichtiger sei dem aufgeklärten Patienten, dass die Immuntherapie als Erstlinientherapie häufig zu einer langen Therapiefreiheit führt.
Schilling fasste zusammen, dass (fast) alle metastasierten Melanompatienten in der ersten Therapielinie eine Immuntherapie bekommen sollten, denn:
-
Die 5-Jahres OS-Daten sprechen klar dafür.
-
Eine zielgerichtete Therapie ist in dieser Situation eine palliative (Dauer-)Therapie, während eine Immuntherapie oft ein langes Ansprechen erreicht.
-
Die Immuntherapie ist auch bei hoher LDH überlegen.
-
Die zielgerichtete Erstlinientherapie verschlechtert die Prognose möglicherweise.
-
Trotz teils erheblicher Nebenwirkungen führt die Immuntherapie nicht zu einer messbaren Reduktion der Lebensqualität.
-
Patienten brauchen nach der Immuntherapie oftmals keine Folgetherapie.
-
Die Immuntherapie wirkt (auch) schnell!
Wenn nun also die Immuntherapie die Therapie der Wahl für die Erstlinie beim fortgeschrittenen Melanom ist, soll dann die doppelte Checkpointblockade mit Nivolumab plus Ipilimumab oder eine Monotherapie mit Nivolumab oder Pembrolizumab verwendet werden? Prof. Dr. Carola Berking, Universitätsklinikum Erlangen, stellte die Datenlage zur doppelten Checkpointblockade in den Fokus und Prof. Dr. Stephan Grabbe, Universitätsmedizin der Johannes-Gutenberg-Universität Mainz, Vorteile der einfachen Checkpointblockade.
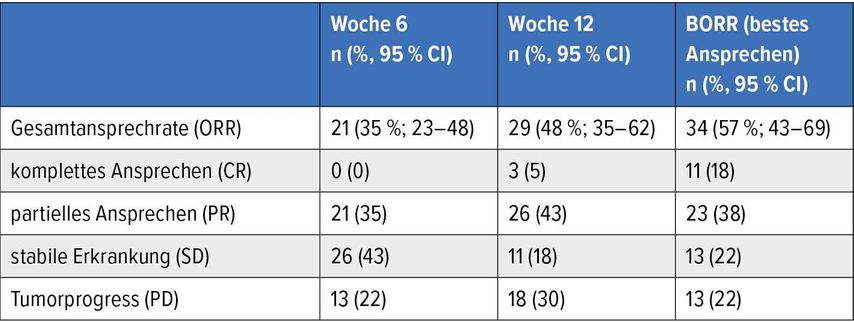
Tab. 1:Ansprechraten nach RECIST-1.1-Kriterien nach 6 bzw. 12 Wochen Immun-Kombinationstherapie (nach Hauschild A et al.)5
Doppelte Checkpointblockade in der Erstlinientherapie – Argumente und Datenlage
Nivolumab und Ipilimumab haben einen unterschiedlichen, aber komplementären Wirkmechanismus, führte Berking als erstes Argument für die doppelte Immunblockade mit einem PD-1- und einem CTLA4-Inhibitor an. Zum einen wirkt die Kombination über die CTLA4-Schiene im Lymphknoten, zum anderen über die PD-1-Schiene in der Mikroumgebung des Tumors. Ein weiteres Argument für die Kombinationstherapie sei die viel bessere Wirksamkeit auf Hirnmetastasen. Die intrakranielle Ansprechrate betrug in der australischen ABC-Studie für Patienten ohne vorhergegangene BRAF/MEK-Behandlung unter Nivolumab plus Ipilimumab 59% und war damit nahezu dreimal so hoch wie unter alleiniger Nivolumab-Therapie mit 21%.10 Auch die 3-Jahres-PFS-Rate war mit 48% versus 14% unter der Kombinationstherapiedreimal höher. Es gehe hier nicht um eine kleine Subgruppe von Patienten, betonte Berking, mehr als 60% aller Melanompatienten entwickeln im Stadium IV Hirnmetastasen, darum müsse frühzeitig eine effektive Behandlung durchgeführt werden.
Die Überlegenheit der doppelten Checkpointblockade zeige sich auch im adjuvanten11 und neoadjuvanten Setting bei Melanompatienten im Stadium IV,12,13 so Berking. In der deutschen Phase-II-Studie IMMUNED wurden 167 Patienten mit einem Melanom im Stadium IV ohne Krankheitszeichen nach Resektion mit Ipilimumab plus Nivolumab, Nivolumab oder Placebo behandelt.11 Die RFS-Rate war bereits nach 6 Monaten im Kombinationsarm deutlich höher als im Nivolumab-Mono-Arm (Abb. 2). Die neoadjuvante Gabe von Nivolumab plus Ipilimumab führe in mindestens zwei Dritteln aller Fälle zu einer hervorragenden Rate an pathologischem Ansprechen der Lymphknotenmetastasen12 und eine hohe Rate an pathologischem Ansprechen würde in ein nachhaltig rezidivfreies Überleben übersetzt,13 erklärte Berking.
Als entscheidendes Argument führte Berking aber an, dass mit der Kombination im direkten Vergleich zur Monotherapie in der CheckMate-067-Studie bei Melanompatienten im Stadium IV eine höhere Wirksamkeit sowohl bezüglich der Ansprechrate (56% vs. 45%) und des progressionsfreien Überlebens (5-Jahres-PFS: 36% vs. 29%) als auch des Gesamtüberlebens (5-Jahres-OS-Rate: 52% vs. 44%) erreicht wurde.1 Zudem bewirke die doppelte Checkpoint-Blockade ein verlängertes behandlungsfreies Intervall im Vergleich zur Monotherapie. Eine aktualisierte Untersuchung der Zeit bis zur ersten nachfolgenden Therapie zeigte, dass 33% der Patienten unter Nivolumab plus Ipilimumab versus 17% der Patienten im Nivolumab-Mono-Arm wenigstens 60 Monate behandlungsfrei lebten.14 Das behandlungsfreie Intervall wurde mit 19,7 versus 9,9 Monate durch die Kombinationstherapie fast verdoppelt.
Zu den Nebenwirkungen bemerkte Berking, dass die Mehrheit der schweren Nebenwirkungen reversibel und die Mehrheit der irreversiblen Nebenwirkungen unter einer Begleittherapie asymptomatisch und gut erträglich seien. Damit seien die Nebenwirkungen vertretbar.
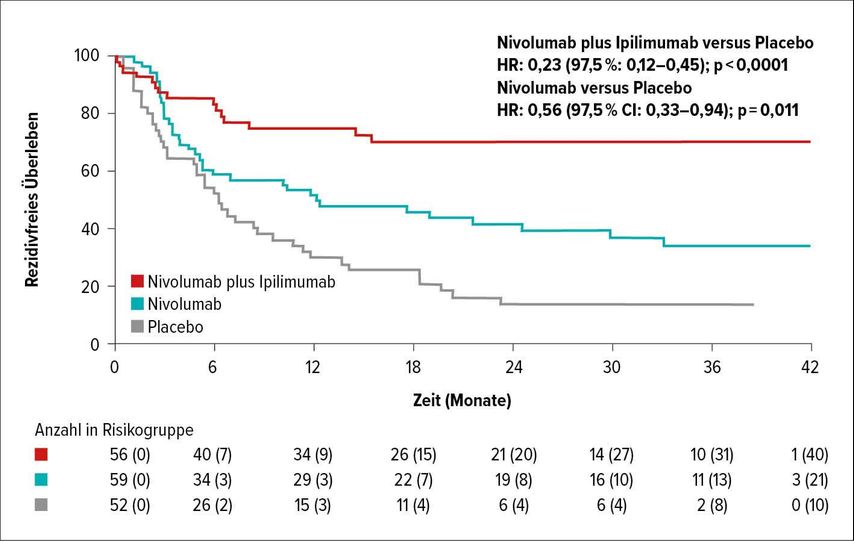
Abb. 2: Rezidivfreies Überleben (RFS) unter adjuvanter Gabe von Nivolumab/Ipilimumab vs. Nivolumab vs. Placebo bei Melanompatienten im Stadium IV ohne Krankheitszeichen nach Operation (Zimmer L et al.)11
Einfache Checkpointblockade in der Erstlinientherapie – Argumente und Datenlage
Mit einer PD-1-Monotherapie statt mit der Kombination zu beginnen sei eigentlich eine Frage der Sequenz von PD-1- und CTLA4-Inhibitor gegenüber der direkten gleichzeitigen Gabe, erklärte Grabbe. Es fehle die relevante Studie zum Vergleich zwischen diesen beiden Therapiestrategien. Die Toxizität der Immun-Kombinationstherapie ist deutlich höher als die der PD-1-Monotherapie. Das heißt, dass alle Patienten, die primär auf die Anti-PD-1-Monotherapie ansprechen und keine weitere Therapie benötigen, der Toxizität einer Immunkombination gar nicht erst ausgesetzt würden. In der CheckMate 067 konnte für Patienten des PD-1-Monotherapiearms gezeigt werden, dass 32% der Patienten nach Progress auf eine Immun-Kombinationstherapie ansprachen, allerdings nur 13% auf eine Ipilimumab-Monotherapie.15 Von den BRAF-mutierten Patienten sprachen 21% auf die Kombination und 24% auf alleiniges Ipilimumab an, von den BRAF-Wildtyp-Patienten waren es 37% versus 10%. Bei Patienten mit BRAF-Wildtyp war eine deutliche Korrelation der Kombinationstherapie mit einem längeren RFS (HR: 0,67; 95% CI: 0,53–0,85; p=0,0005) und einem längeren OS (HR: 0,51; 95% CI: 0,38–0,67; p<0,0001) im Vergleich zurMono-Ipilimumab-Therapie erkennbar.
Bericht: Dr. Ine Schmale
Quelle:
30. Deutscher Hautkrebskongress, Sitzung 18: Kontroversen in der Melanomtherapie
Literatur:
1 Larkin J et al.: Five-year survival with combined nivolumab and ipilimumab in advanced melanoma. N Engl J Med 2019; 381: 1535-46 2 Robert C et al.: Five-year outcomes with dabrafenib plus trametinib in metastatic melanoma. N Engl J Med 2019; 381: 626-36 3 McArthur GA et al.: 5-year survival update of cobimetinib plus vemurafenib BRAF V600 mutation-positive advanced melanoma: Final analysis of the coBRIM study. Vortrag am SMR-Kongress 2019 4 Dummer R et al.: Encorafenib plus binimetinib versus vemurafenib or encorafenib in patients with BRAF-mutant melanoma (COLUMBUS): A multicentre, open-label, randomised phase 3 trial. Lancet Oncol 2018; 19: 603-15
5 Hauschild A et al.: Long-term benefit of adjuvant dabrafenib plus trametinib in patients with resected stage III BRAF V600-mutant melanoma: 5-year analysis of COMBI-AD. N Engl J Med 2020; 383: 1139-48 6 Eggermont AM et al.: Pembrolizumab versus placebo after complete resection of high-risk stage III melanoma: New recurrence-free survival results from the EORTC 1325-MG/Keynote 054 double-blinded phase III trial at three-year median follow-up. ASCO 2020, Abstr. #10000 7 Postow MA et al.: Aphase II study to evaluate the need for > two doses of nivolumab + ipilimumab combination immunotherapy. ASCO 2020, Abstr. #10003 8 Puzanov I et al.: Association of BRAF V600E/K mutation status and prior BRAF/MEK inhibition with pembrolizumab outcomes in advanced melanoma: Pooled analysis of 3 clinical trials. JAMA Onocl 2020; 6: 1256-64 9 Schadendorf D et al.: Health-related quality of life results from the phase III CheckMate 067 study. Eur J Cancer 2017; 82: 80-91 10 Long GV et al.: Long-term outcomes from the randomized phase 2 study of nivolumab or nivolumab + ipilimumab in patients with melanoma brain metastases: Anti-PD1 Brain Collaboration (the ABC trial). ESMO 2019, Abstr. #1311O 11 Zimmer L et al.: Adjuvant nivolumab plus ipilimumab or nivolumab monotherapy versus placebo in patients with resected stage IV melanoma with no evidence of disease (IMMUNED): Arandomised, phase 2 trial. Lancet 2020; 395: 1558-68 12 Versluis JM et al.: Learning from clinical trials of neoadjuvant checkpoint blockade. Nat Med 2020; 26: 475-84 13 Rozeman EA et al.: Twenty-four month RFS and updated toxicity data from OpACIN-neo: A study to identify the optimal dosing schedule of neoadjuvant ipilimumab and nivolumab in stage III melanoma. ASCO 2020, Abstr. #10015 14 Regan MM et al.: Estimating treatment-free survival over extended follow-up in patients with advanced melanoma treated with immune-checkpoint inhibitors: Five-year follow-up of CheckMate 067. ASCO 2020, Abstr. #10043 15 Da Silva IP et al.: Ipilimumab alone or in combination with anti-PD-1 in patients with metastatic melanoma resistant to PD1 monotherapy. ASCO 2020, Abstr. #10005
Das könnte Sie auch interessieren:
Adjuvantes Osimertinib reduziert ZNS-Rezidive bei EGFR-mutierter Erkrankung
Etwa 30% der Patienten mit nicht kleinzelligem Lungenkarzinom (NSCLC) präsentieren sich mit resezierbarer Erkrankung und werden einer kurativen Operation unterzogen. Viele Patienten ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...


