Immuntherapeutische Ansätze bei gastrointestinalen Tumoren
Bericht: Dr. Ine Schmale
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Wie bei vielen anderen Entitäten ändert sich mit der Verfügbarkeit der Immuntherapien auch die Therapielandschaft bei den gastrointestinalen Tumoren. Insbesondere die kombinierte Therapie von Checkpoint-Inhibitoren mit etablierten Therapien anderer Wirkweise zeigen laut den beim World Congress on Gastrointestinal Cancer (WCGC) vorgestellten Studien vielversprechende Erfolge. Potenzielle neue Therapieansätze resultieren zudem aus der Weiterentwicklung der immuntherapeutischen Substanzen. Zumindest für das Pankreaskarzinom konnte auch ein kleiner Fortschritt mit einem erweiterten Chemotherapieregime gezeigt werden.
Erste Ergebnisse für Pembrolizumab beim HER2-positiven Magenkarzinom
Für die Behandlung von Patienten mit HER2-positivem, metastasiertem Adenokarzinom von Magen oder gastroösophagealem Übergang wurden in der Phase-III-Studie KEYNOTE-811 Pembrolizumab, Trastuzumab und Chemotherapie kombiniert. In der placebokontrollierten Studie erhielten 692 Patienten Trastuzumab und Chemotherapie (5-Fluorouracil plus Cisplatin oder CAPOX) mit oder ohne Pembrolizumab. Der duale primäre Endpunkt war eine Verlängerung von Gesamtüberleben (OS) und progressionsfreiem Überleben (PFS). Bei der WCGC wurde die erste geplante Interimsanalyse für die ersten 264 Studienteilnehmer mit einer Nachbeobachtungszeit von ≥8,5 Monaten präsentiert.1 Die Sicherheitspopulation (≥1 Dosis der Studienmedikation) bestand zu dem Zeitpunkt aus 433 Patienten. Im Median betrug die Nachbeobachtungszeit für die Wirksamkeitspopulation 12,0 Monate und für die Sicherheitspopulation 9,9 Monate. Die Patienten waren median 61 bis 63 Jahre alt und in etwa 80% der Fälle Männer. Um die 85% der Patienten zeigten einen Combined Positive Score (CPS) für PD-L1 ≥1 und um die 80% eine hohe HER2-Expression (Immunhistochemie: IHC 3+). Zwischen 86% und 88% der Patienten in den beiden Studienarmen innerhalb der zwei untersuchten Populationen erhielten als Chemotherapie der Wahl das CAPOX-Regime.
Im Pembrolizumab-Arm zeigten 97% der Patienten eine Tumorschrumpfung und 32% eine Tumorschrumpfung von ≥80%. Im Placeboarm wurde Entsprechendes bei 90% bzw. 15% der Patienten beobachtet. Die Ansprechrate (ORR) betrug im experimentellen bzw. im Kontrollarm 74,4 versus 51,9% (p<0,0001). Eine komplette Remission wurde bei 11% der Patienten im Pembrolizumab-haltigen Arm und bei 3% im Kontrollarm erreicht. Der ORR-Vorteil für die Pembrolizumab-haltige Therapie zeigte sich für alle untersuchten Subgruppen. Die Dauer des Ansprechens betrug median 10,6 versus 9,5 Monate. Das Sicherheitsprofil war in beiden Studienarmen vergleichbar.
Die Autoren schlussfolgerten, dass Pembrolizumab plus Trastuzumab und Chemotherapie ein potenzielles Erstlinien-Regime für Patienten mit lokal fortgeschrittenem, nicht resektablem oder metastasiertem HER2-positivem Adenokarzinom des Magens oder des gastroösophagealen Übergangs sei.
Neuer PD-1-Inhibitor beim vorbehandelten Leberzellkarzinom
Ergebnisse einer globalen Phase-II-Studie zeigen für den PD-1-gerichteten Antikörper Tislelizumab bei Patienten mit vorbehandeltem fortgeschrittenem Leberzellkarzinom eine vielversprechende und anhaltende klinische Aktivität.2 Tislelizumab ist ein neuer PD-1-Checkpoint-Inhibitor, der eine hohe Affinität und Spezifität zum PD-1-Rezeptor der T-Zellen hat, aber nur minimal am FcyR-Rezeptor auf Makrophagen bindet und damit die Antikörper-abhängige Phagozytose verhindert. Letzteres ist ein Mechanismus der T-Zell-Clearance und ein potenzieller Resistenzmechanismus gegenüber der PD-1-Therapie. Insgesamt wurden 249 Patienten in die einarmige Studie eingeschlossen, von denen 138 Patienten eine vorhergehende Therapie und 111 Patienten ≥2 Therapielinien erhalten hatten. Das mediane Alter der Patienten betrug 62 Jahre mit einer Spanne von 28 bis 90 Jahren. Bei 6,0% der Patienten wurde ein positiver PD-L1-Status festgestellt, 57,4% der Patienten wiesen keine PD-L1-Expression auf und bei 36,5% war der PD-L1-Status unbekannt. 80,3% der Patienten hatten extrahepatische Läsionen.
Ein Ansprechen zeigten insgesamt 13,3% der Patienten, bei vergleichbaren 13,8% in der zweiten Therapielinie und 12,6% bei ≥2 vorangegangenen Therapielinien. Zudem wurde bei 39% der Patienten eine stabile Erkrankung beobachtet. 79,2% der ansprechenden Patienten zeigten anhaltende Remissionen über eine Dauer von ≥12 Monaten. Im Median lebten die Patienten 13,2 Monate (95% CI: 10,8–15,0). Die 6-Monats-OS-Rate lag bei 77,2%, die 12-Monats-OS-Rate bei 54,3%. Das mediane PFS betrug 2,7 Monate. Bei 48,6% der Patienten wurden Nebenwirkungen Grad ≥3 und bei 14,5% therapieassoziierte Nebenwirkungen Grad ≥3 berichtet. 10,4% der Patienten brachen die Therapie aufgrund von Nebenwirkungen und 4,8% aufgrund von therapieassoziierten Nebenwirkungen ab. Die häufigsten Nebenwirkungen waren AST- und ALT-Anstiege (12,9 bzw. 9,2%), Asthenie (7,6%), Hypothyreoidismus (7,6%), erhöhtes Blut-Bilirubin (6,8%) und Pruritus (6,8%).
PD-1-Inhibition in der Zweitlinie beim squamösen Ösophaguskarzinom
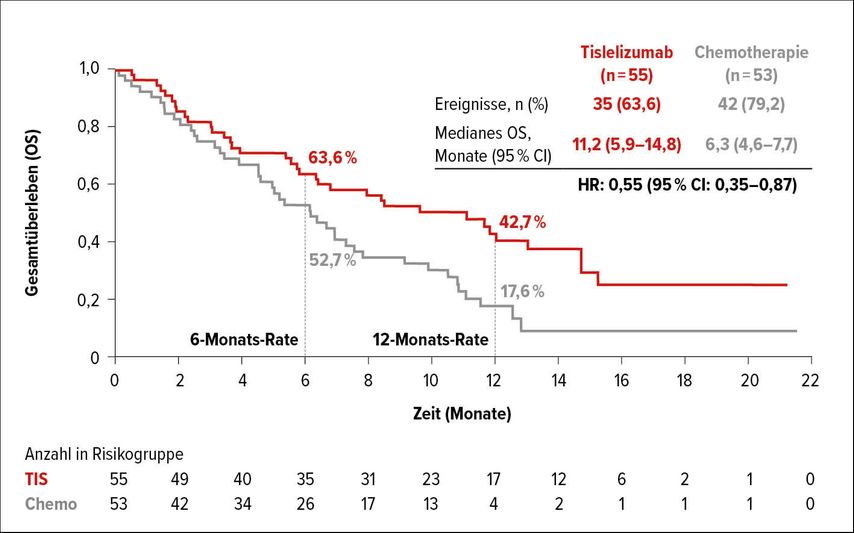
Tislelizumab wurde ebenfalls für die Therapie des fortgeschrittenen oder metastasierten squamösen Ösophaguskarzinoms untersucht. In der Phase-III-Studie RATIONALE 302 erhielten insgesamt 512 Patienten mit Progress während oder nach der Erstlinientherapie Tislelizumab (200mg, q3w) oder eine Chemotherapie nach Wahl des Prüfarztes (Paclitaxel, Docetaxel oder Irinotecan). 108 Patienten waren in Europa oder Nordamerika rekrutiert worden. Für den WCGC wurden die Ergebnisse dieser geografischen Subgruppe ausgewertet.3 Das Gesamtüberleben wurde für die gesamte Studienpopulation der RATIONALE-302-Studie (primärer Endpunkt) von median 6,3 unter Chemotherapie auf 8,6 Monate unter Tislelizumab signifikant verlängert (HR:0,70; 95% CI: 0,57–0,85; p=0,0001). Die 6-Monats-OS-Rate betrug 62,3 versus 51,8% und die 12-Monats-OS-Rate 37,4 versus 23,7%. Für Studienteilnehmer aus Europa oder Nordamerika wurde das Risiko zu versterben um 45% reduziert (HR: 0,55; 95% CI: 0,35–0,87) und das Gesamtüberleben im Median von 6,3 auf 11,2 Monate verlängert (Abb. 1). Nach 6 Monaten lebten 63,6 versus 52,7% und nach 12 Monaten 42,7 versus 17,6% der europäischen und nordamerikanischen Patienten. Bezüglich des PFS wurde in der europäisch-nordamerikanischen Population kein Unterschied zwischen den Studienarmen gesehen (HR:0,97; 95% CI: 0,64–1,47). Es sprachen 20,0% der europäischen und nordamerikanischen Patienten auf die Therapie mit Tislelizumab versus 11,3% auf die Chemotherapie an. Die mediane Dauer des Ansprechens betrug 5,1 versus 2,1 Monate. Nach 6 Monaten waren noch 42,4 versus 20,0% und nach 12 Monaten 28,3 versus 0% der ansprechenden Patienten in Remission. Eine stabile Erkrankung zeigten 30,9 versus 37,7% der Patienten.
Abb. 1: Gesamtüberleben unter Tislelizumab versus Chemotherapie in der Subgruppe der europäischen und nordamerikanischen Studienteilnehmer (nach Ajani J et al.)3
19,2% versus 26,7% der Patienten in den beiden Studienarmen brachen die Therapie aufgrund von Nebenwirkungen ab. Die häufigsten Nebenwirkungen waren Anämie (11,0 vs. 34,6%), verringerter Appetit (6,3 vs. 31,3%), Diarrhö (5,5 vs. 27,5%) und Übelkeit (2,7 vs. 27,5%). Auf Basis der Ergebnisse der RATIONALE-302-Studie stellt Tislelizumab eine potenzielle Zweitlinientherapie für Patienten mit fortgeschrittenem oder metastasiertem squamösem Ösophaguskarzinom dar, so das Fazit der Autoren.
Präoperative Therapie mit Avelumab beim fortgeschrittenen Rektalkarzinom
Beim lokal fortgeschrittenen Rektalkarzinom wurde in der italienischen Phase-II-Studie AVANA der PD-L1-Inhibitor Avelumab zusätzlich zur Chemoradiotherapie präoperativ eingesetzt.4 Primärer Studienendpunkt war die Rate an pathologischen Komplettremissionen (pCR). Im Anschluss an die Operation wurde, entsprechend dem pathologischen Ergebnis, eine adjuvante Chemotherapie mit 6 Zyklen XELOX oder Capecitabin angeschlossen. Von April 2019 bis November 2020 konnten 101 Patienten im medianen Alter von 63 Jahren rekrutiert werden. Mehr als 90% der Patienten erhielten die volle Dosis der Radiotherapie, von Capecitabin und/oder Avelumab. Eine pCR zeigten 23% und ein gutes pathologisches Ansprechen 60% der Patienten. Der Mikrosatellitenstatus war von 62 Patienten verfügbar, von denen nur 2 Patienten eine hohe Mikrosatelliteninstabilität zeigten. Die Therapie war gut handhabbar mit Grad ≥3-Nebenwirkungen bei 8% der Patienten. Die Autoren schlagen vor, den vielversprechenden Ansatz weiter zu verfolgen.
Verlängertes Überleben durch adjuvante Therapie beim Pankreaskarzinom
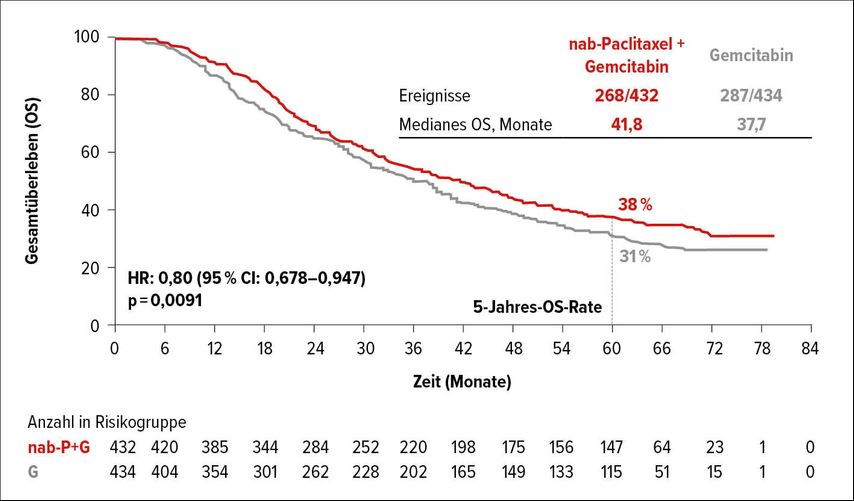
Die multizentrische, offene, randomisierte Phase-III-Studie APACT untersuchte die adjuvante Gabe von nab-Paclitaxel plus Gemcitabin gegenüber alleinigem Gemcitabin bei insgesamt 866 Patienten mit resektablem Pankreaskarzinom. Die Studie erreichte den primären Endpunkt, eine Verlängerung des unabhängig geprüften krankheitsfreien Überlebens (DFS), nicht (HR:0,88; 95% CI: 0,729–1,063), zeigte aber einen Vorteil für die Kombinationstherapie in der DFS-Auswertung der Prüfärzte (HR:0,82; 95% CI: 0,694–0,965). Auch bezüglich des OS gab es Hinweise auf einen Vorteil durch die zusätzliche nab-Paclitaxel-Gabe (HR:0,82; 95% CI: 0,680–0,996). Beim WCGC wurden nun die 5-Jahres-OS-Daten präsentiert, die auf einen möglichen Nutzen von nab-Paclitaxel hinweisen.5
Die mediane Nachbeobachtungszeit für die aktuelle OS-Analyse betrug 63,2 Monate und es waren insgesamt 555 Ereignisse eingetreten. Mit einem Median von 41,8 Monaten für die Behandlung mit nab-Paclitaxel plus Gemcitabin versus 37,7 Monate für die alleinige Gemcitabin-Therapie zeigte sich durch nab-Paclitaxel eine 20%ige Reduktion des Risikos zu versterben (HR: 0,80; 95% CI: 0,678–0,947; p=0,0091). Nach 62 Monaten waren 38 versus 31% der Patienten am Leben (Abb. 2).
Diese Ergebnisse deuten darauf hin, dass Patienten, auch wenn die Studie ihren primären Endpunkt nicht erreicht hat, möglicherweise von der zusätzlichen nab-Paclitaxel-Gabe profitieren, schlussfolgerten die Autoren.
Quelle:
World Congress on Gastrointestinal Cancer (WCGC), 30. Juni bis 3. Juli 2021, virtuell
Literatur:
1 Janjigian YY et al.: Pembrolizumab plus trastuzumab and chemotherapy for HER2+ metastatic gastric or gastroesophageal junction cancer: initial findings of the global phase 3 KEYNOTE-811 study. WCGC 2021, Abstr. #LBA-4 2 Ducreux M et al.: Results from a global phase 2 study of tislelizumab, an investigational PD-1 antibody, in patients with previously treated advanced hepatocellular carcinoma. WCGC 2021, Abstr. #O-1 3 Ajani J et al.: Randomized, phase 3 study of second-line tislelizumab vs chemotherapy in advanced or metastatic esophageal squamous cell carcinoma (RATIONALE 302) in the overall population and the Europe/North America subgroup. WCGC 2021, Abstr. #O-15 4 Salvatore L et al.: Phase II study of preoperative chemoradiotherapy plus avelumab in patients with locally advanced rectal cancer – the AVANA study. WCGC 2021, Abstr. #O-12 5 Tempero MA et al.: Phase 3 APACT trial of adjuvant nab-paclitaxel plus gemcitabine vs gemcitabine alone in patients with resected pancreatic cancer: updated 5-year overall survival. WCGC 2021, Abstr. #LBA-1
Das könnte Sie auch interessieren:
Adjuvantes Osimertinib reduziert ZNS-Rezidive bei EGFR-mutierter Erkrankung
Etwa 30% der Patienten mit nicht kleinzelligem Lungenkarzinom (NSCLC) präsentieren sich mit resezierbarer Erkrankung und werden einer kurativen Operation unterzogen. Viele Patienten ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...