Hormonrezeptorpositiver Brustkrebs – wie können wir die Prognose weiter verbessern?
Autoren:
OÄ Priv.-Doz. Dr. Kathrin Strasser-Weippl
Dr. Simon Udovica
1. Medizinische Abteilung,
Zentrum für Onkologie und Hämatologie
Wiener Gesundheitsverbund,
Klinik Ottakring, Wien
Neben Möglichkeiten der endokrinen Therapie stehen beim fortgeschrittenen hormonrezeptorpositiven Mammakarzinom neue und zielgerichtete Optionen zur Verfügung. Zudem wurden jüngst zahlreiche Studien zur Verbesserung des Therapiemonitorings und der Patientenselektion veröffentlicht. Die aktuelle Therapielandschaft und zukünftige Trends wurden bei der diesjährigen Frühjahrstagung der Österreichischen Gesellschaft für Hämatologie und Medizinische Onkologie (OeGHO) zusammengefasst.
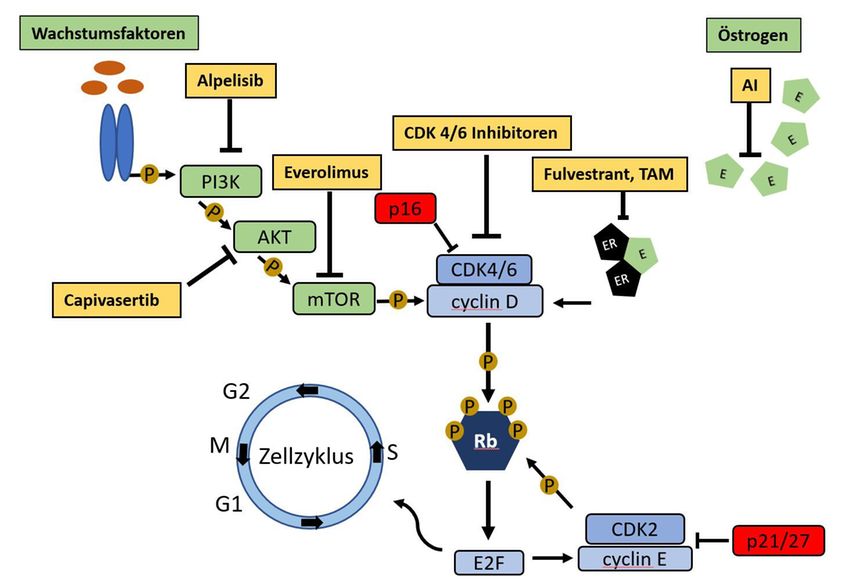
Mit dem Einsatz von Tamoxifen beim hormonrezeptorpositiven (HR+) Mammakarzinom konnte in den 1980er- und 1990er-Jahren bei einer der ersten Krebsarten der Nachweis des Nutzens einer zielgerichteten Therapie erbracht werden. Heutzutage stehen uns viele Möglichkeiten endokriner Therapie zur Verfügung, allerdings können sich im Krankheitsverlauf Resistenzen ausbilden. Resistenzmechanismen beinhalten Mutationen des Östrogenrezeptors, womit dieser Liganden-unabhängig aktiviert wird, zudem können Signalkaskaden, wie der PI3K-AKT-mTOR Pathway, hochreguliert werden. Diese Signalketten münden schlussendlich in der Aktivierung Cyclin-abhängiger Kinasen (CDKs), welche den Zellzyklus und damit die Zellteilung regulieren. Die pharmakologische Blockade dieser Signalwege kann das Ansprechen auf eine endokrine Therapie verbessern und Resistenzen überwinden.1
Ziel dieses Artikels ist es, einen Überblick über neue Medikamente und ihre Targets zu geben und zu informieren, wie wir unsere bisherigen Therapien zukünftig noch besser einsetzen können, um die Prognose von Patientinnen mit HR+ Mammakarzinom weiter zu verbessern.
Einsatz von CDK4/6-Inhibitoren beim HR+/HER2– Mammakarzinom
Mittlerweile stehen mit Palbociclib, Ribociclib und Abemaciclib drei Substanzen zur Verfügung, die mit unterschiedlichen Hormontherapien als Backbone bei prä- und postmenopausalen Frauen mit fortgeschrittenem HR+/HER2neu-negativem (HR+/HER2–) Mammakarzinom evaluiert wurden. In einer kürzlich publizierten Metaanalyse konnte ein ähnlich gutes Ansprechen für alle drei Substanzen gezeigt werden, das progressionsfreie Überleben (PFS) konnte um ca. 45% verlängert werden und das Ansprechen spiegelte sich auch im Gesamtüberleben (OS) wider, welches um etwa 25% verlängert werden konnte.2 Die Substanzen unterscheiden sich vor allem im Nebenwirkungsspektrum. Bei Palbociclib und Ribociclib ist die Knochenmarkstoxizität zu erwähnen, die jedoch nicht mit einer erhöhten Rate an febrilen Neutropenien einhergeht und mit einer Dosisreduktion generell gut behandelbar ist. Erfreulicherweise zeigten erforderliche Dosisreduktionen keinen Einfluss auf das PFS.3 Unter Abemaciclib ist die Hämatotoxizität geringer, die Substanz besitzt aber dafür eine höhere gastrointestinale Toxizität, insbesondere kommt es zu Diarrhöen, was wohl auf eine zusätzliche Hemmung von CDK9 zurückzuführen ist.4
Während die Daten für den Einsatz von CDK4/6-Inhibitoren für Patientinnen mit fortgeschrittener oder metastasierter Erkrankung einen eindeutigen Vorteil zeigen können, ist der Nutzen dieser Substanzen im adjuvanten Setting noch nicht so klar definiert. Gerade Hochrisiko-Patientinnen dürften aber auch in der adjuvanten Therapie vom Einsatz von CDK4/6-Inhibitoren profitieren. Als Landmark-Trial sei hier die monarchE-Studie genannt, in welcher Patientinnen mit lokalisierter Erkrankung, aber hohem Rezidivrisiko Abemaciclib für zwei Jahre zusätzlich zur endokrinen Therapie erhielten. Durch den Zusatz von Abemaciclib blieben nach zwei Jahren signifikant mehr Patientinnen frei von Lokalrezidiven (92,2% vs. 88,7%) und von Fernmetastasen (93,6% vs. 90,3%).5 Anders als in der monarchE-Studie konnte für Palbociclib in den Studien PALLAS und PENELOPE-B kein Benefit in der adjuvanten Situation gezeigt werden. Gründe dafür könnten die unterschiedlichen Einschlusskriterien sein. Zudem waren die Therapiedauern unterschiedlich (1 Jahr vs. 2 Jahre) und die Abbruchraten unter Palbociclib höher als unter Abemaciclib.6
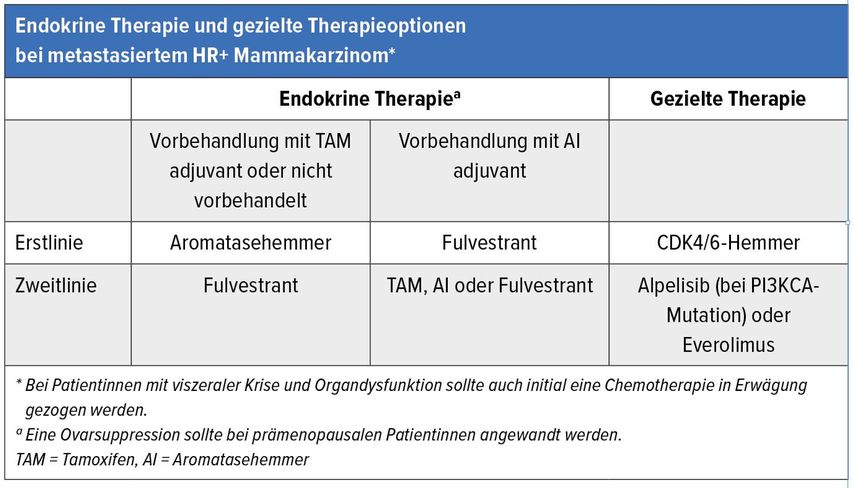
Tab. 1: Endokrine Therapie und gezielte Therapieoptionen bei metastasiertem HR+ Mammakarzinom (adaptiert nach Burstein et al.)1
Neue Therapieoptionen nach CDK4/6-Blockade bei HR+/HER2–Tumoren
CDK4/6-Inhibitoren greifen spät in die Zellzykluskontrolle ein, dennoch können sich auch über Signalwege weiter „upstream“ Resistenzmechanismen ausbilden. Einer dieser Signalwege ist der PI3K/AKT/mTOR-Signalweg, welcher über Cyclin D CDK2 aktivieren kann und damit eine Umgehung der CDK4/6-Blockade darstellt.7 Alpelisib ist ein spezifischer Inhibitor der Alpha-Subunit der Phosphoinositid-3-Kinase (PI3K) und der erste zugelassene Vertreter dieser Substanzklasse beim fortgeschrittenen HR+/HER2– Mammakarzinom. Die SOLAR-1-Studie konnte für Alpelisib in Kombination mit Fulvestrant eine Verlängerung des PFS (11,0 vs. 5,7 Monate) und des OS (39,3 vs. 31,4 Monate) bei Patientinnen mit einer PI3KCA-Mutation zeigen.8 Während in der SOLAR-1-Studie nur wenige Patientinnen mit CDK4/6-Inhibitoren vorbehandelt waren, zeigen Daten aus der BYLieve-Studie, dass auch nach vorheriger Therapie mit einem CDK4/6-Hemmer mit der Kombination von Alpelisib und Fulvestrant eine Verlängerung des PFS erreicht werden kann.9
Eine andere Option, den PI3K/AKT/mTOR-Signalweg zu hemmen, besteht durch mTOR-Inhibitoren. Hier führte Everolimus sowohl in Kombination mit Exemestan als auch mit Fulvestrant zu einer Verlängerung des PFS nach Versagen einer Therapie mit Aromatasehemmern (AI).10,11 Klinische Daten bezüglich des Einsatzes von Everolimus nach CDK4/6-Inhibition stehen leider nicht zur Verfügung. Für eine ganz neue Substanz, Capivasertib, einen AKT-Inhibitor, gibt es nun ermutigende Daten aus einer Phase-II-Studie. Hier konnte für Capivasertib in Kombination mit Fulvestrant nach Therapie mit einem AI eine signifikante Verlängerung von PFS und OS erreicht werden.12
Zukünftige Optionen liegen vermutlich in der Kombination von zielgerichteten Substanzen, auch die Rolle der Immuntherapie beim hormonsensitiven Mammakarzinom ist noch nicht final geklärt.
Verbesserung der Patientenselektion und des Therapiemonitorings
Eine große Herausforderung liegt neben der Entwicklung neuer Substanzen darin, die Patientenselektion zu verbessern. So betrug beispielweise in der monarchE-Studie für Abemaciclib die „number needed to treat“ (NNT) ∼28, um eine Rezidivfreiheit nach zwei Jahren zu erzielen (absoluter Unterschied nach zwei Jahren: 3,5%). Im metastasierten Setting sind die erforderlichen NNT niedriger, aber gerade in Hinblick auf die nicht unbeträchtlichen Toxizitäten wäre auch hier eine bessere Patientinnenselektion wünschenswert.
In der adjuvanten Situation können uns hier multigenomische Scores wie der Oncotype-DX-Score oder der Endopredict-Score helfen.13 Auf dem San Antonio Breast Cancer Symposium (SABCS) 2020 wurde ein weiterer interessanter Ansatz vorgestellt: Hier wurde die Ki-67-Expression als zusätzliche Determinante für die Notwendigkeit einer adjuvanten Chemotherapie beschrieben. So konnte bei Patientinnen mit frühem HR+/HER2/neu– Mammakarzinom (cT2 oder G3 oder Ki67 ≥15%) und 0–2 positiven Lymphknoten selbst bei mittlerem Recurrence Score von 12–25 auf eine Chemotherapie verzichtet werden, wenn es unter dreiwöchiger endokriner Therapie zu einem Abfall der Ki-67-Response gekommen war.14 Dies ist insbesondere für jüngere Patientinnen relevant, denen basierend auf den Daten der TAILORx-Studie in dieser Konstellation eine Chemotherapie empfohlen worden wäre.15
Im metastasierten Setting könnte ein Therapiemonitoring mit zirkulierenden Tumorzellen (CTCs) in Zukunft hilfreich sein und mehrere laufende Phase-III-Studien untersuchen diese Fragestellung. Vielversprechend erscheint auch die Messung der zirkulierenden Tumor-DNA (ctDNA) als Verlaufsparameter. Als Beispiel sei hier die plasmaMATCH-Studie genannt, in welcher in der zirkulierenden Tumor-DNA Mutationen in ESR1, AKT oder HER2 evaluiert wurden. Gelang es, diese Mutationen durch eine zielgerichtete Therapie zu supprimieren, so wiesen diese Patientinnen ein deutlich verlängertes PFS auf.16 In der PADA-1-Studie wurde versucht, durch einen frühzeitigen Wechsel von einem AI auf Fulvestrant bei Patientinnen mit Anstieg einer ESR1-Mutation, aber noch ohne Progress, die Prognose zu verbessern. Hier zeigte sich, dass Patientinnen mit Mutationsnachweis zwar ein deutlich kürzeres PFS aufwiesen, ein frühzeitiger Wechsel auf Fulvestrant aber leider keinen Benefit brachte.17
Zusammenfassung und Ausblick
Zusammenfassend lässt sich sagen, dass erfreulicherweise in den letzten Jahren viele neue Targets und Therapien identifiziert werden konnten. Eine mögliche zukünftige Option wird es sein, diese Therapien zu kombinieren. Eine ebenso große Rolle werden auch eine bessere Patientinnenselektion vor Therapieeinleitung und eine frühzeitige Verlaufskontrolle mittels CTCs oder ctDNA spielen, um vorhandene Therapien möglichst effizient und zielgerichtet einzusetzen.
Literatur:
1 Burstein HJ: Systemic therapy for estrogen receptor-positive, HER2-negative breast cancer. N Engl J Med 2020; 383: 2557-70 2 Kunwor R et al.: Meta-analysis of cyclin-dependent kinase (CDK) 4/6 inhibitors with endocrine therapy versus endocrine therapy alone on progression-free survival (PFS) and overall survival (OS) for metastatic breast cancer (MBC). J Clin Oncol 2020; 38(15_suppl): 1060 3 Verma S et al.: Palbociclib in combination with fulvestrant in women with hormone receptor-positive/HER2-negative advanced metastatic breast cancer: detailed safety analysis from a multicenter, randomized, placebo-controlled, phase III study (PALOMA-3). Oncologist 2016; 21(10): 1165-75 4 Marra A, Curigliano G: Are all cyclin-dependent kinases 4/6 inhibitors created equal? NPJ Breast Cancer 2019; 5: 27 5 Johnston SRD et al.: Abemaciclib combined with endocrine therapy for the adjuvant treatment of HR+, HER2−, node-positive, high-risk, early breast cancer (monarchE). J Clin Oncol 2020; 38(34): 3987-98 6Loibl S et al.: Palbociclib for residual high-risk invasive HR-positive and HER2-negative early breast cancer-the Penelope-B trial. J Clin Oncol 2021; 39(14): 1518-307 Herrera-Abreu MT et al.: Early adaptation and acquired resistance to CDK4/6 inhibition in estrogen receptor-positive breast cancer. Cancer Res 2016; 76(8): 2301-13 8 André F et al.: Alpelisib plus fulvestrant for PIK3CA-mutated, hormone receptor-positive, human epidermal growth factor receptor-2-negative advanced breast cancer: final overall survival results from SOLAR-1. Ann Oncol 2021; 32(2): 208-17 9 Rugo HS et al.: Alpelisib plus fulvestrant in PIK3CA-mutated, hormone receptor-positive advanced breast cancer after a CDK4/6 inhibitor (BYLieve): one cohort of a phase 2, multicentre, open-label, non-comparative study. Lancet Oncol 2021; 22(4): 489-98 10 Baselga J et al.: Everolimus in postmenopausal hormone-receptor-positive advanced breast cancer. NEngl J Med 2011; 366(6): 520-9 11 Kornblum N et al.: Randomized phase II trial of fulvestrant plus everolimus or placebo in postmenopausal women with hormone receptor-positive, human epidermal growth factor receptor 2-negative metastatic breast cancer resistant to aromatase inhibitor therapy: results of PrE. J Clin Oncol 2018; 36(16): 1556-63 12 Jones RH et al.: Fulvestrant plus capivasertib versus placebo after relapse or progression on an aromatase inhibitor in metastatic, oestrogen receptor-positive breast cancer (FAKTION): a multicentre, randomised, controlled, phase 2 trial. Lancet Oncol 2020; 21(3): 345-57 13 Sestak I et al.: Prediction of chemotherapy benefit by EndoPredict in patients with breast cancer who received adjuvant endocrine therapy plus chemotherapy or endocrine therapy alone. Breast Cancer Res Treat 2019; 176(2): 377-86 14Harbeck N: Endocrine therapy alone in patients with intermediate or high-risk luminal early breast cancer (0-3 lymph nodes), Recurrence Score <26 and Ki67 response after preoperative endocrine therapy: first efficacy results from the ADAPT HR+/HER2- trial (n=4,690). SABCS 2020, Abstr. #GS4-04 15 Sparano JA et al.: Adjuvant chemotherapy guided by a 21-gene expression assay in breast cancer. N Engl J Med 2018; 379(2): 111-21 16 Turner NC et al.: Circulating tumour DNA analysis to direct therapy in advanced breast cancer (plasmaMATCH): a multicentre, multicohort, phase 2a, platform trial. Lancet Oncol 2020; 21(10): 1296-308 17 Bidard FC et al.: Prognostic impact of ESR1 mutations in ER+ HER2- MBC patients prior treated with first line AI and palbociclib: an exploratory analysis of the PADA-1 trial. J Clin Oncol 2020; 38(15_suppl): 1010 18 Portman N et al.: Overcoming CDK4/6 inhibitor resistance in ER-positive breast cancer. Endocr Relat Cancer vol 2019; 26(1): R15-R30
Das könnte Sie auch interessieren:
Adjuvantes Osimertinib reduziert ZNS-Rezidive bei EGFR-mutierter Erkrankung
Etwa 30% der Patienten mit nicht kleinzelligem Lungenkarzinom (NSCLC) präsentieren sich mit resezierbarer Erkrankung und werden einer kurativen Operation unterzogen. Viele Patienten ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...