Highlights zum Thema Prostatakarzinom
Autor:
OA Dr. Franz Stoiber
Abteilung für Urologie und Andrologie
Salzkammergut Klinikum Vöcklabruck
E-Mail: franz.stoiber@ooeg.at
Die andauernde Corona-Pandemie erlaubte es uns neuerlich nicht, die aktuellen onkologischen Neuigkeiten vor Ort zu erfahren. Die perfekte virtuelle Abwicklung der Wissensvermittlung in Echtzeit durch die American Society of Clinical Oncology (ASCO) muss allerdings hervorgehoben werden. Die Präsentation zweier von fünf Late-breaking Abstracts in der Plenary Session spiegelt den gesteigerten Stellenwert der heutigen Uroonkologie wider.
Metastasiertes kastrationsresistentes Stadium
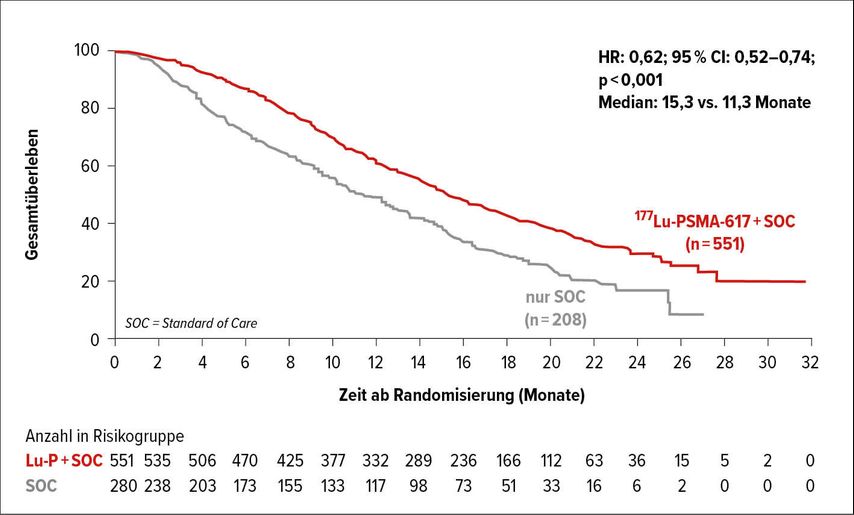
Die Gruppe um M. Morris konnte eine Steigerung des Gesamtüberlebens (OS) von 11,3 auf 15,3 Monate und eine Verlängerung des radiografisch progressionsfreien Überlebens (rPFS) von 3,6 auf 8,8 Monate mit der Therapie von 177Lutetium im metastasierten kastrationsresistenten Stadium (mCRPC) nach einem Follow-up von 20,9 Monaten erreichen.1
Der an das „PSMA-617 small molecule“ gebundene Betastrahler wird über den sich nahezu ausschließlich an Tumorzellen befindlichen PSMA-Rezeptor in die Zelle eingeschleust, um dort seine apoptotische Fähigkeit zu entfalten. Die im letzten Jahr vorgestellte TheraP2-Studie von M. Hofman konnte bereits einen serologischen Vorteil des Radionuklids 177Lutetium gegenüber Cabazitaxel in einer multizentrischen Phase-II-Studie zeigen.
Die nun einen zusätzlichen Standard im mCRPC-Stadium generierende prospektiv randomisierte Phase-III-Studie VISION inkludierte 831 Patienten, die in einer 2:1-Randomisierung entweder 177Lutetium oder den Standard of Care (SOC) erhielten, der Chemo-, 223Radium- und Strahlentherapie umfasste, die allerdings vor Randomisierung nicht erlaubt waren.
Die Patienten waren mit mindestens einer Androgen-gerichteten und 1–2 Taxan-basierten (38% Cabazitaxel) Therapien vorbehandelt und wurden vorab mittels 68Ga-PSMA-PET/CT ausgewählt, die mindestens eine metastatische Läsion und keine PSMA-PET-negativen Metastasen aufweisen musste. 87% oder 831 Patienten erfüllten diese Vorgaben. Von den geplanten 4 Zyklen innerhalb von 6 Wochen konnten median sogar 5 verabreicht werden, wobei die Range zwischen 1 und 16 extrem hoch war. Neben den coprimären Endpunkten mit einer Hazard-Ratio (HR) von 0,62 für das OS und 0,40 für das rPFS waren auch die sekundären Endpunkte wie Gesamtansprechrate (ORR) und PSA-Ansprechen sowie die Zeit bis zur ersten symptomatischen Knochenmetastase hochsignifikant. Sämtliche Subgruppen profitierten.
Die Verträglichkeit war mit einer Grad-3–5-Rate von 8,1% vs. 3,4% sehr gut, es gab keine neuen Ereignisse. Neben der Fatigue mit 7% vs. 2,4% trat die erwartete Grad-3-Knochenmarksdepression bei 23,4% auf und umfasste vorwiegend eine Anämie mit 12,9% vs. 4,9% und eine Thrombopenie von 7,9% vs. 1%. Renale Grad-3-Effekte gab es mit 3,4% vs. 2,9% nur unwesentlich mehr als in der Kontrollgruppe. 5 (0,9%) behandlungsassoziierte Todesfälle waren zu beklagen.1
Fazit zu 177Lutetium
In der Diskussion von Marie Taplin wird 177Lutetium als zusätzliche Therapieoption im mCRPC-Setting gesehen, da auch eine Verlängerung des rPFS, die in den Radium223-Studien nicht beobachtet werden konnte, die Lebensqualität der Patienten allein durch die Erkenntnis, dass ihr Tumor nicht fortschreitet, verbessert. Somit wird 177Lutetium zum Game Changer, da es das Gesamtüberleben in einer schwer vorbehandelten Patientenpopulation verlängert, die nur noch wenige therapeutische Optionen aufweist. Mit ca. 4 Monaten Überlebensvorteil reiht sich 177Lutetium in die Reihe der anderen Substanzen für die Therapie des mCRPC ein, die einen quantitativ ähnlichen Vorteil aufweisen.
Es ist mit einer breiten internationalen Zulassung sowie einer umfassenden Aufstockung von Ressourcen zu rechnen, damit nach einer multidisziplinären Therapieentscheidung möglichst viele der für diese Drittlinienoption infrage kommenden Patienten behandelt werden können. Zukünftig werden wir außerdem mit einer zunehmend früheren Anwendung im Therapiealgorithmus des metastasierten Prostatakarzinoms zu rechnen haben.
EORTC 1333/PEACE III
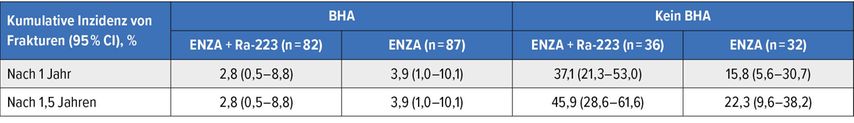
Silke Gillessen präsentierte das Update einer Sicherheitsanalyse des EORTC 1333/PEACE III Trial, der Radium223 plus Enzalutamid gegen Enzalutamid alleine vergleicht. Frühzeitig traten gehäuft Knochenbrüche sowohl im Kombinationsarm als auch im Enzalutamid-Arm auf, sodass das Data Monitoring Comitee (DMC) die Zugabe von sogenannten „bone health (protecting) agents“ (BHA) empfahl.3
Eine ähnliche Problematik wies auch die ERA2234 auf, die ein ähnliches Studiendesign, allerdings mit Abirateron, hatte und ob der gehäuften Frakturen eine höhere Mortalitätsrate im experimentellen Arm generierte. Mit der Zugabe von Denosumab oder Zoledronsäure konnte man nun die Inzidenz der Frakturen nach einem Jahr in der Radium/Enzalutamid/ADT-Kohorte von 37,1% auf 2,8% und in der Gruppe mit alleinigem Enzalutamid, das natürlich auch mit einer ADT kombiniert ist, von 15,8% auf 3,9% senken. Dieser Trend, jedwede Frakturen, ob pathologisch oder osteoporotisch bedingt, zu vermeiden, setzte sich auch in der längeren Beobachtungsphase nach 1,5 Jahren fort.3
Fazit zu PEACE III
Da Patienten mit einem metastasierten Prostatakarzinom langjährigen Therapien mit potenziell osteoporotisch wirksamen Substanzen und einer vorwiegend den Knochen befallenden Grundkrankheit ausgesetzt sind, ist die frühzeitige Osteoprotektion bei Therapieeinleitung gemäß den geltenden Leitlinien zur Vermeidung entsprechender Frakturen unverzichtbar und sollte mit mehr Aufmerksamkeit bedacht werden.
Precision Medicine
Die zunehmende Implementierung der sogenannten „Precision Medicine“ auch beim Prostatakarzinom verdanken wir vor allem der Testung des Genoms, des kompletten DNA-Sets des Organismus. Das Auffinden von Aberrationen im homologen DNA-Reparaturmechanismus, vor allem in den Genen von BRCA1/2 sowie ATM, CHEK2 oder PALB2, aber auch im Mismatch-Repair-Mechanismus, eröffnete neue Therapieoptionen, von denen die PARP-Inhibitoren für die BRCA-mutierten Prostatakarzinome und die Checkpoint-Inhibitoren für die Patienten mit Mismatch-Repair-Aberrationen bzw. Mikrosatelliten-instabilen Prostatakarzinomen („MSI-high“)5 etabliert sind oder werden.
Das Ansprechen auf diese Substanzen ist allerdings nicht für alle mutierten und somit prognostisch schlechten Karzinome gleich. Die PARP-Inhibitoren Olaparib und Rucaparib sind zwar von der FDA für mehrere Genmutationen zugelassen, jedoch ist die Wirksamkeit beim BRCA2-mutierten Karzinom am höchsten, wie die erste Biomarker-getriggerte Phase-III-Studie PROfound6 für Olaparib eindrucksvoll zeigte.
Die ATM-Mutation hingegen wies nur eine geringe Sensitivität für Olaparib auf. Der Stellenwert der PARP-Inhibitoren im Therapiealgorithmus des mCRPC ist allerdings noch unklar.
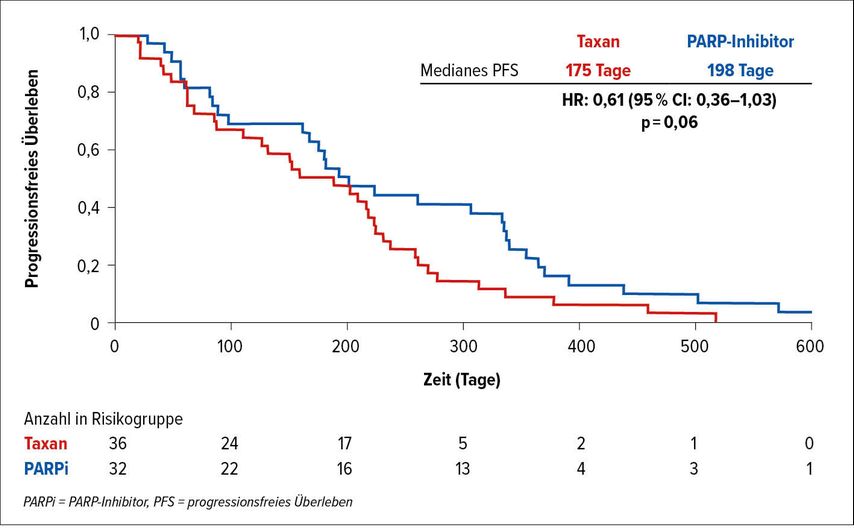
Im Abstract 5040 von C. Su findet man erste Hinweise für eine Therapiesequenz, abhängig von der vorherrschenden Mutation im HRR(Homologe-Rekombination-Reparatur)-Mechanismus, die retrospektiv aus den OS- und rPFS-Kohorten der PROfound-Studie analysiert wurden.
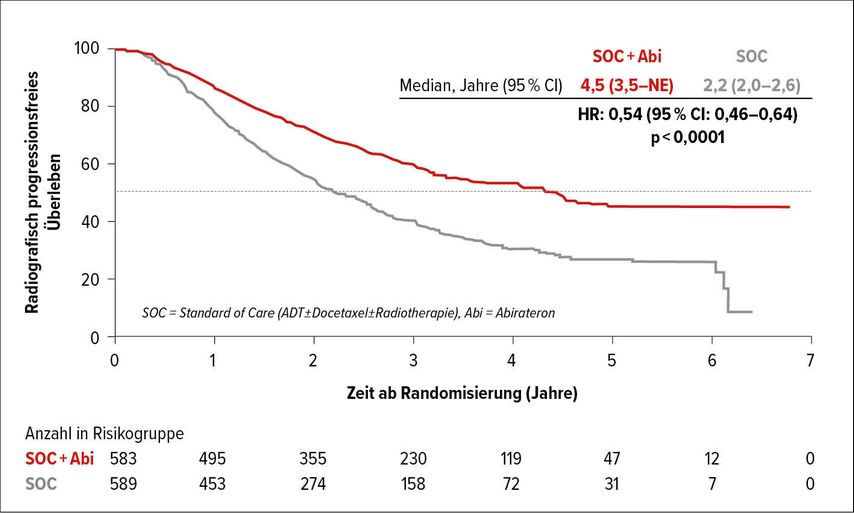
Abb. 3: Radiografisch progressionsfreies Überleben in der Gesamtpopulation: Standard of Care (ADT±Docetaxel±Radiotherapie) mit vs. ohne Abirateron (nach Fizazi et al.)8
Die 107 Patienten mit BRCA2- und ATM-Mutationen hatten Olaparib und Docetaxel für mehr als drei Wochen erhalten. Die Zeit bis zum Erreichen der PSA- oder der klinischen/radiografischen Progression diente als primärer Endpunkt. Die multivariable Regression für das PFS unter Berücksichtigung des Gleason-Scores erreichte in fast allen Analysen Signifikanz, was auf eine mögliche Rolle für den Einsatz von Taxanen vor PARP-Inhibitoren bei ATM-veränderten mCRPC-Patienten und umgekehrt bei BRCA2-veränderten Patienten hindeutet. Patienten mit BRCA2-Veränderungen sind möglicherweise resistenter gegenüber Taxanen und empfindlicher gegenüber PARP-Inhibitoren als Patienten mit ATM-Veränderungen.7
Metastasiertes hormonsensitives Stadium
Ein weiterer potenzieller Game Changer wurde von Karim Fizazi mit einer ersten Analyse der lang ersehnten prospektiv randomisierten Phase-III-PEACE-1-Studie vorgestellt. Ein noch nie dagewesenes 2,3 bzw. 2,5 Jahre verlängertes rPFS erreichten Patienten mit der Zugabe von Abirateron/Prednisolon zur Standardtherapie ADT mit oder ohne 6 Zyklen Docetaxel und mit oder ohne Radiotherapie des Primums im de novo metastasierten hormonsensitiven Prostatakarzinom (mHSPC).
Die Komplexität der vierarmigen Studie ergab sich aus der langen Rekrutierungsphase, in der sich die Standardtherapie oftmalig änderte und somit einige Amendmends des Protokolls notwendig wurden: Von November 2013–15 war die ADT der SOC und sie umfasste 273 Studienteilnehmer, 592 Patienten konnten von 2015–2017 Docetaxel zum SOC erhalten und von 2017 bis Dezember 2018 war für 308 Patienten Docetaxel obligatorisch.
Diese 1173 Patienten erhielten aufgeteilt in 1:1:1:1 entweder SOC (n=296), SOC mit Abirateron (n=292), SOC mit Radiotherapie (n=293) oder SOC mit Abirateron und Radiotherapie (n=292), wobei sich der SOC, wie oben beschrieben, ständig änderte. Letztendlich war der erste coprimäre Endpunkt, das rPFS, nach einem Follow-up von 42 Monaten hochpositiv mit einer HR von 0,5 mit obligatorischem Docetaxel bzw. 0,54 mit einem optionalen Docetaxel in der SOC-Gruppe.8
Das OS als zweiter coprimärer Endpunkt ist noch nicht reif genug und wurde noch nicht vorgestellt, sodass sich in den folgenden Diskussionen die Euphorie noch in Grenzen hielt, in dem Wissen um die OS-Daten der ENZAMET9-Studie mit Enzalutamid, die nach signifikantem rPFS-Vorteil doch keinen OS-Benefit in der Docetaxel-inkludierten Kohorte gegenüber der Gruppe mit den Androgenrezeptorenblockern der ersten Generation erreichte.
In den Subgruppen für das rPFS profitierten sämtliche Patientenkohorten, unabhängig von einer Docetaxel- oder Radiotherapie oder vom Ausmaß der Tumorlast oder des Performancestatus (0–2). Auch der sekundäre Endpunkt, die Zeit bis zur Kastrationsresistenz, war mit einer Verlängerung von ca. 2 Jahren mit einer HR von 0,4 hochpositiv und signifikant.
Die Toxizitäten zeigten keine neuen Ereignisse und waren in der Abirateron/Prednisolon-Gruppe mit der erwarteten Charakteristik und dem erwarteten Ausmaß behaftet. Die Neutropenierate lag in beiden Gruppen ausgeglichen bei 16% Grad 3.8
Fazit zu PEACE 1
Die Anerkennung des Triplets als neuer Therapiestandard im mHSPC-Stadium wurde in der Diskussion noch zurückhaltend kommentiert und folgerichtig wurden die OS-Daten eingefordert. Allerdings erscheint die Vorenthaltung einer noch nie dagewesenen Verlängerung der Zeit bis zur Krankheitsprogression von knapp 2,5 Jahren in einer mit einer schlechten Prognose behafteten und oft multimorbiden Population als ethisch diskutabel.
Daten der Real-World-Populationen, die sicher andere Risikoprofile aufweisen, werden zeigen, inwiefern diese ermutigenden rPFS-Daten der Studie bestätigt werden können. Spannend wird auch die Frage sein, ob Docetaxel einen vorteilhaften Beitrag zu ADT plus Abirateron liefern kann, währenddessen Abirateron sehr wohl den Benefit von ADT plus Docetaxel steigert. Auch deswegen ist das Triplet noch kein SOC.
Lokalisiertes Prostatakarzinom
Die kanadische Studiengruppe um Dong-Woo Kang aus Alberta untersuchte in der zweiarmigen Single-Center-Phase-II-ERASE-Studie mit 52 Patienten, ob ein hochintensives Intervalltraining drei Mal pro Woche für einen dreimonatigen Zeitraum gegenüber einer üblichen Versorgung einen Einfluss auf die biochemische Progression für eine Patientengruppe mit einem lokalisierten Prostatakarzinom hatte, die unter einer aktiven Surveillance steht.
Dabei konnte eine signifikante Verbesserung der kardiorespiratorischen Fitness (p=0,014), die zu einer signifikanten Abnahme des PSA (p=0,043), der PSA Velocity (p=0,04) und des LNCaP-Zellwachstums (p=0,024) führte, beobachtet werden.10
Fazit zu ERASE
Die erste kontrolliert randomisierte Studie ERASE (Exercise During Active Surveillance for Prostate Cancer) weist eine Korrelation zwischen intensivem Intervalltraining, verbesserter physikalischer Fitness und inhibierter biochemischer Progression bei Prostatakarzinompatienten unter aktiver Surveillance nach. Ob sich diese Verbesserungen langfristig in einem klinischen Outcome niederschlagen, muss durch weitere Studien geprüft werden.
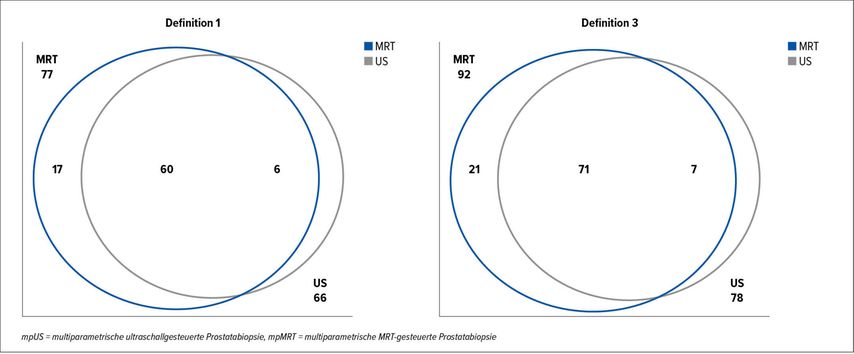
Abb. 4: Flächengewichtete Venn-Diagramme (Euler) zeigen die Krebserkennung durch mpUS, mpMRT oder beides für 2 Definitionen von hsPCa. Bei einer weniger strengen Definition des hsPCA (Definition 3: Gleason Grad ≥3+4 jeglicher Länge) betrug die Übereinstimmung 89,1% (erwartet 55,6%; κ 0,75; p<0,01) (nach Grey et al.)11
Diagnostik des Prostatakarzinoms
Im CADMUS Trial verglich Grey ADR (Abstract 5007) die multiparametrische ultraschallgesteuerte mit der multiparametrischen MRT-gesteuerten Prostatabiopsie bei der Erkennung von hochsignifikanten Prostatakarzinomen. In dieser prospektiven, multizentrischen, gepaarten Kohortenstudie aus 7 Zentren erhielten 370 Patienten beide Untersuchungen, die bei 306 ein positives Ergebnis aufwiesen. Geblindet, welche Modalität positiv war, unterzogen sich die Probanden einer gezielten Biopsie.
Als primärer Endpunkt fungierten der Anteil positiver Bildgebung und die Detektion klinisch relevanter Prostatakarzinome, die definiert waren als Grad >=4+3 jeglicher Karzinomlänge bzw. maximale Karzinomkernlänge >=6mm jedweden Grades.
Die Übereinstimmung der Detektion der Läsionen betrug 73,2%, die der signifikanten Karzinome sogar 91,1% bei erwarteten 59,8%. 4,3% weniger signifikante Karzinome entdeckte der Ultraschall. Wurde nur die weniger strenge Definiton der >=4+3-Graduierung angewandt, dann lag die Übereinstimmung zwischen beiden Untersuchungen bei 89,1%, wobei 55,6% erwartet wurden.11
Fazit zu CADMUS
Eine Annäherung des ökonomisch günstigeren multiparametrischen Ultraschalls als Biopsiegrundlage an die mpMRT-gesteuerte Biopsie konnte in dieser Arbeit nachgewiesen werden.
Literatur:
1 Morris MJ et al.: Phase III study of lutetium-177-PSMA-617 in patients with metastatic castration-resistant prostate cancer (VISION). ASCO 2021, Abstr. #LBA4 2 Hofman MS et al.: [ 177 Lu]Lu-PSMA-617 versus cabazitaxel in patients with metastatic castration-resistant prostate cancer (TheraP): a randomised, open-label, phase 2 trial. Lancet: 2021; 397(10276): 797-804 3 Gillessen S et al.: Decreased fracture rate by mandating bone protecting agents in the EORTC 1333/PEACEIII trial combining Ra223 with enzalutamide versus enzalutamide alone: an updated safety analysis. ASCO 2021, Abstr. #5002 4 Smith MR et al.: ERA 223: a phase 3 trial of radium-223 (Ra-223) in combination with abiraterone acetate and prednisone/prednisolone for the treatment of asymptomatic or mildly symptomatic chemotherapy-naïve patients (pts) with bone-predominant metastatic castration-resistant prostate cancer (mCRPC). ESMO 2018; Abstr. #2672 5 Abida W et al.: Analysis of the prevalence of microsatellite instability in prostate cancer and response to immune checkpoint blockade. JAMA Oncol 2019; 5(4): 471-8 6 Hussain M et al.: Survival with olaparib in metastatic castration-resistant prostate cancer. N Engl J Med 2020; 383(24): 2345-57 7 Su CT et al.: Differential responses to taxanes and PARP inhibitors (PARPi) in ATM- versus BRCA2-mutated metastatic castrate-resistant prostate cancer (mCRPC) patients (pts). ASCO 2021; Abstr. #5040 8 Fizazi K et al.: A phase 3 trial with a 2x2 factorial design of abiraterone acetate plus prednisone and/or local radiotherapy in men with de novo metastatic castration-sensitive prostate cancer (mCSPC): first results of PEACE-1. ASCO 2021; Abstr. #5000 9 Davis ID et al.: Enzalutamide with standard first-line therapy in metastatic prostate cancer. N Engl J Med 2019; 381(2): 121-31 10 Kang D et al.: A phase II randomized controlled trial of exercise on biochemical progression in men with prostate cancer on active surveillance. ASCO 2021; Abstr. #5080 11 Grey A et al.: The CADMUS trial: a paired cohort, blinded study comparing multiparametric ultrasound targeted biopsies with multiparametric MRI targeted biopsies in the detection of clinically significant prostate cancer. ASCO 2021; Abstr. #5008
Das könnte Sie auch interessieren:
Adjuvantes Osimertinib reduziert ZNS-Rezidive bei EGFR-mutierter Erkrankung
Etwa 30% der Patienten mit nicht kleinzelligem Lungenkarzinom (NSCLC) präsentieren sich mit resezierbarer Erkrankung und werden einer kurativen Operation unterzogen. Viele Patienten ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...