Highlights vom ASCO-Kongress zu Kopf-Hals-Tumoren
Autor:
Assoc. Prof. Priv.-Doz. Dr. Thorsten Füreder
Klinische Abteilung für Onkologie
Universitätsklinik für Innere Medizin I
Medizinische Universität Wien
Im Rahmen des diesjährigen Jahreskongresses der „American Society of Clinical Oncology“ (ASCO) wurden Ergebnisse wichtiger klinischer Studien zu Kopf-Hals-Tumoren (KHT) präsentiert, die zwar die aktuelle klinische Praxis nicht völlig neu definieren, aber trotzdem Einfluss auf die derzeitigen Therapiealgorithmen – vor allem im Bereich der Frühstadien und im lokal fortgeschrittenen Stadium – haben. Studien bei rezidivierten/metastasierten (R/M) KHT standen ähnlich wie in den Jahren zuvor vor allem im Zeichen der Immuntherapie.
Operable KHT im Früh- und lokal fortgeschrittenen Stadium
Senti-MER-Studie: Wächterlymphknoten-Biopsie vs. elektive „neck dissection“
In diese Phase-III-Studie wurden 307 Patienten mit HPV-positiven, resektablen Oropharynxkarzinomen (OPC) T1–T2 und klinischem N0 im Hals eingeschlossen.1 Nach Randomisierung in zwei Gruppen, wurde im Standardarm eine elektive „neck dissection“ durchgeführt, während der experimentelle Arm eine Biopsie des Wächterlymphknotens („sentinel node“,SN) erhielt. Wenn in der Histologie ein positiver SN detektiert wurde, wurde die Neck Dissection komplettiert, andernfalls wurden die Patienten nachbeobachtet. Der primäre Endpunkt war das rezidivfreie Überleben im Sinne eines Lymphknotenrezidivs am Hals nach zwei Jahren. Dieser Endpunkt wurde erreicht, wobei im Standardarm bei 89,6% (95% CI: 0,83–0,94) der Patienten und im experimentellen Arm bei 89,4% (95% CI: 0,82–0,94) kein Rezidiv detektierbar war. Das lokoregionale rezidivfreie Überleben (73,6%; 95% CI: 0,64–0,81 vs. 76,3%; 95% CI: 0,67–0,83) und das Gesamtüberleben (OS) (81,8%; 95% CI: 0,74–0,88 vs. 82,3%; 95% CI: 0,74–0,88) waren ebenfalls vergleichbar. Unterschiedlich war jedoch die postoperative Morbidität: Nach ein bis zwei Monaten berichtete die SN-Gruppe über weniger Schultersteifigkeit und bessere Fähigkeit, die Hände über den Kopf zu heben. Weiters war bei diesen Patienten der Krankenhausaufenthalt kürzer und weniger Physiotherapie notwendig.
E3311-Studie: transorale Roboterchirurgie, gefolgt von Niedrig- oder Standarddosis-Radiatio
Der Einfluss einer Deeskalation der postoperativen Radiatio (50Gray in 25 Fraktionen vs. 60Gray in 30 Fraktionen) auf das progressionsfreie Überleben (PFS) nach zwei Jahren wurde in dieser Phase-II-Studie evaluiert.2 P16-positive OPC T1–T2 bzw. resektable OPCN1–N2bwurden nach Resektion mittels Roboter in zwei Gruppen randomisiert, wenn sie ein intermediäres Risiko aufwiesen. Dieses war definiert durch knappe Resektionsgrenzen (<3mm), 2–4 positive Lymphknoten, Lymphknotenkapsel-Durchbruch ≤1mm oder perineurale Invasion. Patienten mit niedrigem Risiko wurden observiert und Patienten mit hohem Risiko für ein Rezidiv erhielten eine adjuvante Radiochemotherapie. Die PFS-Rate in der Gruppe mit intermediärem Risiko zeigte sich bei Patienten, die eine „Low dose“-Bestrahlung erhielten (n=102), vergleichbar mit dem Standardarm (n=104; PFS: 95,0%; 90% CI: 91,4–98,6 vs. 95,9%; 90% CI: 92,6–99,3).
Relevanz für die klinische Praxis
Die beiden oben dargestellten Studien zeigen, dass Therapiedeeskalation bei HPV-positiven OPC möglich ist, ohne das onkologische Outcome der Patienten negativ zu beeinflussen. Die Ergebnisse der Senti-MER-Studie können direkt in der klinischen Praxis angewendet werden: Bei Patienten mit HPV-positivem OPCcT1–T2/cN0ist die Wächterlymphknoten-Biopsie mit geringerer Morbidität und kürzerem Krankenaufenthalt verbunden, ohne dass das positive Outcome gefährdet ist. Ein Nachteil ist definitiv der höhere intraoperative Aufwand, um die Wächterlymphknoten mittels eines Tracers darzustellen. Die Daten der E3311-Studie müssen jedoch in einer Phase-III-Studie bestätigt werden, damit sie in der klinischen Routine Anwendung finden können.
Adjuvante Radiochemotherapie mit Hochdosis-Cisplatin vs. wöchentliches Cisplatin
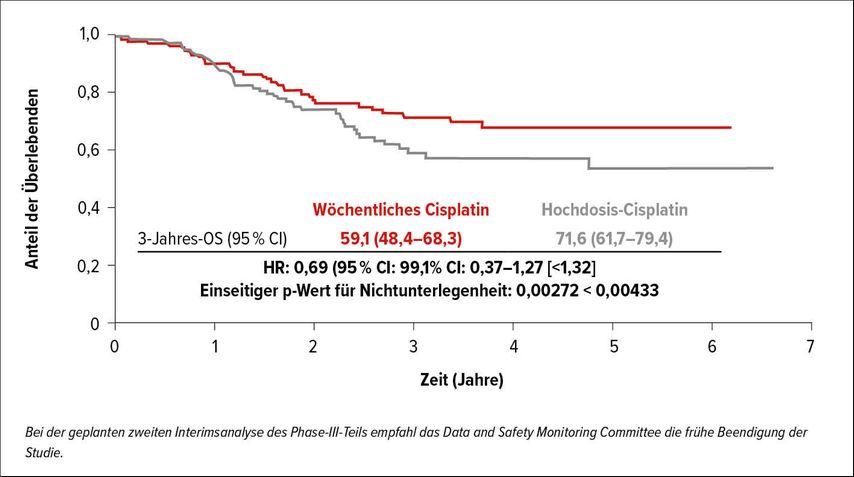
In einer japanischen Phase-II/III-Studie wurde die Frage gestellt, ob konventionelles hochdosiertes Cisplatin 100mg/m2 alle drei Wochen während postoperativer Radiatio bei KHT-Patienten im Stadium III oder IV, die ein hohes Risiko für ein Rezidiv aufwiesen (positive Resektionsränder oder Lymphknotenkapsel-Durchbruch), sich ohne Unterlegenheit durch wöchentlich in einer Dosis von 40mg/m2verabreichtes Cisplatin ersetzen lässt.3 Der primäre Endpunkt war das OS. Es wurden 261 Patienten randomisiert. Die Dreijahres-OS-Rate betrug in der Hochdosis-Cisplatin-Gruppe 59,1% und in der 40mg/m2-Gruppe 71,6% (HR: 0,69; 99,1% CI: 0,37–1,27; p=0,00272) (Abb.1). Da die Studie den Endpunkt frühzeitig erreicht hatte, wurde sie vorzeitig beendet. Das rezidivfreie Überleben war ebenfalls vergleichbar (53,0%; 95% CI: 43,4–61,7 vs. 64,5%; 95% CI: 54,8–72,6). In beiden Gruppen war die kumulative Cisplatindosis >200mg/m2. Wie erwartet, war die Toxizität verglichen mit wöchentlichen Cisplatin-Gaben in der Hochdosis-Cisplatin-Gruppe höher, v.a. im Bereich der Nephrotoxizität (39,5% vs. 29,5%).
Abb. 1: Wöchentliches Cisplatin (rot) vs. Hochdosis-Cisplatin (grau) in Hinblick auf das OS (nach Kiyota N et al.)3
Relevanz für die klinische Praxis
Die Frage der adäquaten Cisplatin-Dosierung während der Radiochemotherapie ist von hoher klinischer Relevanz und seit vielen Jahren nicht adäquat beantwortet. Am ASCO-Kongress 2017 konnte eine indische Studie die Überlegenheit von Hochdosis-Cisplatin vs. 30mg/m2 wöchentlich im postoperativen Setting zeigen. Diese rezente Studie kommt zu einem fast gegenteiligen Ergebnis. Worin besteht der Unterschied? Wichtig ist zu erwähnen, dass in der rezenten Studie die Cisplatin-Dosis mit 40mg/m2 gewählt wurde, was im Gegensatz zur indischen Studie dazu führt, dass das untere Konfidenzintervall der kumulativen CisplatinDosis ebenfalls in beiden Armen die 200mg/m2-Schwelle überschreitet. Es sei weiters darauf hingewiesen, dass aus den Ergebnissen dieser Studie keinesfalls auf eine Überlegenheit von wöchentlich verabreichtem Cisplatin geschlossen werden darf (nicht signifikant für Überlegenheit), auch wenn die OS-Kurven das suggerieren mögen. Bevor man dieses Schema in die eigene klinische Praxis implementiert, sollte man sich vor Augen halten, dass diese Daten in einer asiatischen Population generiert wurden und Phase-III-Daten aus einer kaukasischen Population fehlen. Trotzdem hat sich der Evidenzgrad für wöchentliches Cisplatin mit 40mg/m2, konkomitant zur postoperativen Radiatio verabreicht, erhöht, wobei unbedingt eine kumulative Dosis von 200mg/m2 angestrebt werden muss, wenn man sich für dieses Schema entscheidet.
Rezidivierte bzw. metastasierte (R/M) KHT
PFS2- und CPS-1–19-Daten der KEYNOTE-048-Studie
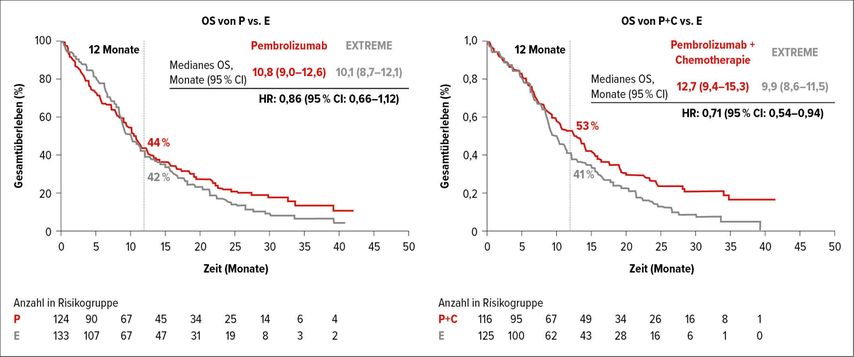
Bereits letztes Jahr wurden die Ergebnisse der Phase-III-KEYNOTE-048-Studie präsentiert. Sowohl Pembrolizumab plus platinhältige Chemotherapie plus 5-Fluoruracil (P+C) als auch Pembrolizumab-Monotherapie (P) zeigten ein überlegenes OS in den Subgruppen mit einem PD-L1-Combined Positive Score (CPS) ≥20 und ≥1 im Vergleich zu 5-FU/Cisplatin/Cetuximab (E) in der Erstlinie bei R/M KHT. Diese Studie hat den Therapiestandard in diesem Setting neu definiert.
Im Rahmen der diesjährigen ASCO- und AACR-Konferenzen wurden zwei wichtige explorative Analysen präsentiert:4,5 Das PFS2 (definiert als Zeit von Randomisierung bis Progression/Tod auf die folgende Therapielinie) und die CPS-1–19-Subgruppen. Das PFS2 ist in den CPS-≥20- und- ≥1-Subgruppen im P-Arm (HR: 0,64; 95% CI: 0,48–0,84 und HR: 0,80; 95% CI: 0,66–0,96) und im P+C-Arm (HR: 0,63; 95% CI: 0,47–0,84 und HR: 0,66; 95% CI: 0,54–0,80) länger als im Standardtherapiearm. In der CPS-1–19-Subgruppe zeigte≤ sich im Hinblick auf das OS eine HR von 0,86 (95% CI: 0,66–1,12) für P vs. E und eine HR von 0,71 (95% CI: 0,54–0,94) für P+C vs. E. (Abb. 2).
Lebensqualität und Folgetherapien: TPExtreme-Studie
Explorative Analysen im Sinne von Lebensqualitätsparametern (QoL) und der Einfluss der Folgetherapie auf das OS wurden für die TPExtreme-Studie präsentiert.6 Die TPExtreme-Studie verglich sechs Zyklen E mit vier Zyklen TPEx (Cisplatin + Docetaxel + Cetuximab), wobei, wie am ESMO-Meeting 2019 gezeigt wurde, das OS für TPEx zwar E nichtüberlegen war, aber das Toxizitätsprofil war günstiger.
QoL-Parameter wie der globale Gesundheitsstatus (p=0,03) und die körperliche Funktionsfähigkeit (p=0,009) in der Woche 18 waren besser in der TPEx-Gruppe, verglichen mit E. Interessanter waren jedoch die explorativen Analysen zu den Folgetherapien: Das mediane OS war bei Patienten, die in der Zweitlinie Immuntherapie erhielten, länger (19,5 Monate; 95% CI: 15,9–22,8) als bei Patienten, die mit Chemotherapie behandelt wurden (16,2 Monate; 95% CI: 14,8–17,3). Dieser Unterschied zeigte sich vor allem bei Patienten, die in der Erstlinie TPEx erhielten, nicht aber bei Patienten, die mit E behandelt wurden.
Nivolumab in Kombination mit Cetuximab
Kurz zusammengefasst sei noch eine einarmige Phase-I/II-Studie erwähnt, die die Kombination von Cetuximab und Nivolumab bei 45 Patienten mit R/M-KHT untersucht hat.7 Spannend an dieser Studie war weniger die Kombinationstherapie, als dass auch Patienten eingeschlossen wurden, die nach/während Immuntherapie progredient waren. Die Ansprechrate betrug 22,2%, wobei auch Patienten (wieder) ansprachen, die bereits mit Immuntherapie vorbehandelt worden waren.
Relevanz für die klinische Praxis
Die rapportierten explorativen Analysen der KEYNOTE-048- und TPExtreme-Studien bestätigen das derzeitige Vorgehen: Immuntherapie (plus/minus Chemotherapie) ist der derzeitige Goldstandard bei R/M KHT-Patienten mit CPS ≥1 in der Erstlinie. Die PFS2-Analysen zeigen, dass der Überlebensvorteil der Immuntherapie nicht nur von der CPS-≥20-Subpopulation getragen wird, sondern dass eine potenzielle Sensitivierung gegenüeber derNachfolgetherapie eine Rolle spielen könnte. Weiters scheint Immuntherapie vor allem in Kombination mit Chemotherapie der Standardtherapie mit E in der CPS-1–19-Population überlegen zu sein. Es sei jedoch erwähnt, dass weder das Studiendesign der KEYNOTE-048-Studie noch das der TPExtreme-Studie darauf ausgerichtet war, die Frage der Sequenz – also Immuntherapie gefolgt von Chemotherapie vs. die umgekehrte Reihenfolge – zu beantworten. Die Nivolumab-plus-Cetuximab-Daten spielen außerhalb von Studien in der klinischen Routine keine Rolle, zeigen jedoch einen Weg auf, wie Resistenz gegen Immuntherapie rückgängig gemacht werden könnte.
Zusammenfassung
Kurz zusammengefasst, lassen sich aus den in diesem Jahr präsentierten Studien bei KHT folgende praxisrelevante Erkenntnisse ableiten:
-
Wächterlymphknoten-Biopsie bei HPV-positiven, nodal-negativen OPC (T1–T2) ist gegenüber der elektiven „neck dissection“ gleichwertig im Hinblick auf das onkologische Outcome, aber mit besseren Morbiditätsdaten verbunden.
-
Wöchentlich konkomitant zur postoperativen Radiatio verabreichtes Cisplatin 40mg/m2 ist gegenüber dem bisherigen Goldstandard mit Cisplatin 100mg/m2 alle drei Wochen in einer asiatischen Population gleichwertig, wodurch der Evidenzgrad für dieses Schema ansteigt.
-
Pembrolizumab und vor allem Pembrolizumab + Chemotherapie sind auch in der CPS-1–19-Subpopulation effektiv und Goldstandard in der Erstlinientherapie bei R/M KHT mit CPS ≥1.
Literatur:
1 Garrel R et al.: Equivalence randomized trial comparing treatment based on sentinel node biopsy versus neck dissection in operable T1-T2N0 oral and oropharyngeal cancer. J Clin Oncol 2020;38(15_suppl): Abstr. #6501 2 Ferris RL et al.: Transoral robotic surgical resection followed by randomization to low- or standard-dose IMRT in resectable p16+ locally advanced oropharynx cancer: A trial of the ECOG-ACRIN Cancer Research Group (E3311). J Clin Oncol 2020;38(15_suppl): Abstr. #6500 3 Kiyota N et al.: Phase II/III trial of post-operative chemoradiotherapy comparing 3-weekly cisplatin with weekly cisplatin in high-risk patients with squamous cell carcinoma of head and neck (JCOG1008). J Clin Oncol 2020;38(15_suppl): Abstr. #6502 4 Harrington KJ et al.: KEYNOTE-048: Progression after the next line of therapy following pembrolizumab (P) or P plus chemotherapy (P+C) vs EXTREME (E) as first-line (1L) therapy for recurrent/metastatic (R/M) head and neck squamous cell carcinoma (HNSCC). J Clin Oncol 2020; 38(15_suppl): Abstr. #6505 5 Burtness B: Efficacy of first-line pembrolizumab by PD-L1 combined positive score <1, 1-19, and ≥20 in recurrent and/or metastatic (R/M) head and neck squamous cell carcinoma (HNSCC): KEYNOTE-048 subgroup analysis. AACR 2020 6 Guigay J et al.: TPExtreme randomized trial: Quality of Life (QoL) and survival according to second-line treatments in patients with recurrent/metastatic head and neck squamous cell carcinoma (R/M HNSCC). J Clin Oncol 2020; 38(15_suppl): Abstr. #6507 7 Chung CH et al.: Concurrent cetuximab (CTX) and nivolumab (NIVO) in patients with recurrent and/or metastatic (R/M) head and neck squamous cell carcinoma (HNSCC): Results of phase II study. J Clin Oncol 2020; 38(15_suppl): Abstr. #6515
Das könnte Sie auch interessieren:
Adjuvantes Osimertinib reduziert ZNS-Rezidive bei EGFR-mutierter Erkrankung
Etwa 30% der Patienten mit nicht kleinzelligem Lungenkarzinom (NSCLC) präsentieren sich mit resezierbarer Erkrankung und werden einer kurativen Operation unterzogen. Viele Patienten ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...