Grosse Fortschritte – zu welchem Preis?
Autorin:
Dr. med. Ursula Hasler-Strub
Leitende Ärztin Brustzentrum St. Gallen
Kantonsspital St. Gallen
E-Mail: ursula.hasler@bluewin.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Das Mammakarzinom ist weiterhin die häufigste Krebsart der westlichen Welt, die bei Frauen zum Tod führt. Über zwei Drittel aller Patientinnen können in Frühstadien geheilt werden. In der metastasierten Situation stehen zahlreiche wirksame Substanzen zurVerfügung. In der folgenden Übersicht sollen die neuesten therapeutischen Optionen und ihre möglichen Nebenwirkungen beleuchtet werden.
Keypoints
-
Aufgrund der demografischen Entwicklung mit steigendem Alter unserer Bevölkerung erwarten wir eine erhebliche Zunahme an Krebsfällen in den nächsten Jahren.
-
Es sind, wie nur bei wenigen soliden Tumoren, in der Behandlung des frühen, aber auch des metastasierten Mammakarzinoms unglaubliche Fortschritte auszumachen. Diese betreffen die Optimierung von ganzen Therapiekonzepten sowie Innovation und Weiterentwicklung neuer Substanzklassen.
-
Antibody Drug Conjugates (ADC) werden zahlreich beim Mammakarzinom eingesetzt, vielversprechende Medikamente gibt es hier beim tripelnegativen wie auch beim HER2-positiven Brustkrebs, vorerst mit reifen Daten in der metastasierten Situation.
-
Klinische Erfahrungen mit diesen Medikamenten zeigen, dass das Nebenwirkungsmanagement von entscheidender Bedeutung ist, um Toxizitäten tief und die Lebensqualität hoch zu halten.
In den letzten Jahren wurden zahlreiche Targets identifiziert, die die Behandlung des Mammakarzinoms verbessert und verfeinert haben. Es stehen uns zusätzliche Optionen in der Antihormontherapie zur Verfügung (mTOR[«mechanistic target of rapamycin»]-Inhibitoren, «Cyclin dependant kinases»[CDK]4/6- sowie PIK3CA-Inhibitoren), zahlreiche HER2(«human epidermal growth factor receptor»)-gerichtete Therapien (monoklonale Antikörper, «Antibody-drug»-Konjugate, Tyrosinkinasehemmer [TKI]) sowie PD-1(«programmed cell death protein 1»)/PD-L1-Inhibitoren, dann auch PARP(Poly[ADP-ribose]-Polymerasen)-Inhibitoren. Nun drängen verschiedene wirksame Antibody-Drug-Konjugate (ADCs) auf den Markt. Am kürzlich virtuell stattgefundenen Meeting der «European Society for Medical Oncology» (ESMO) 2021 wurden praxisverändernde Resultate aus Phase-III-Studien präsentiert. Nun gilt es zu beachten, dass der medizinische Fortschritt in Bezug auf potenziell belastende Nebenwirkungen nicht selten seinen Preis hat.
In der folgenden Übersicht wird Neues zur Mammakarzinombehandlung 2021 vorgestellt.
HR+ Mammakarzinom: Weiterentwicklung der Antihormontherapie
Eine neue Substanzklasse der sogenannten oralen selektiven Östrogenrezeptor-Degraders (SERDs) zeigt vielversprechende Resultate. Giredestrant, Amcenestrant und zahlreiche weitere Vertreter dieser Substanzklasse (einem eigentlichen oralen Fulvestrant entsprechend) werden sowohl in der metastasierten als auch in der adjuvanten Situation untersucht.1 Durch Moleküle dieser Substanzklasse können Resistenzen (verursacht durch Östrogenrezeptor1[ESR1]-Mutationen) potenziell überwunden werden, dabei wird eine hervorragende Verträglichkeit beschrieben.
Es wird neu auch für Schweizer Zentren eine Phase-III-Studie im adjuvanten Setting mit einem oralen SERD (Giredestrant) geben, welche noch in diesem Jahr rekrutieren soll (lidERA-Studie, ClinicalTrials.gov Identifier: NCT04961996).
Metastasiertes tripelnegatives Mammakarzinom: Sacituzumab Govitecan nach ≥2 Therapielinien
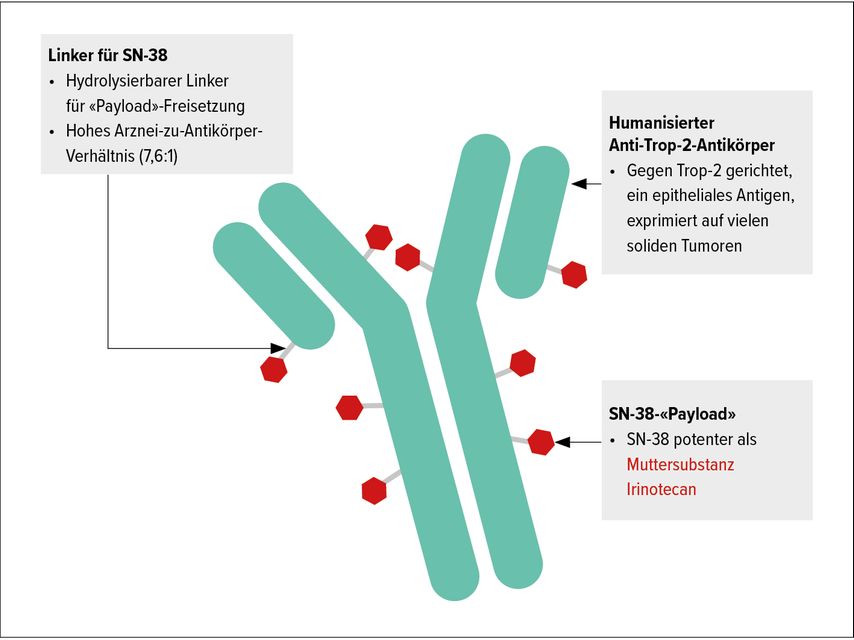
Zu Sacituzumab Govitecan (Trodelvy®) wurden am Meeting der ESMO 2020 vielversprechende Daten aus der Phase-III-Studie ASCEN gezeigt.2 Bei Sacituzumab Govitecan handelt es sich um ein ADC, zusammengesetzt aus einem monoklonalen Antikörper gegen Trop-2, einem humanen Trophoblast-Zelloberflächen-Antigen, welches in den meisten Brustkrebszellen exprimiert wird, über einen Linker verbunden mit dem Chemotherapiemolekül SN-38, einem Topoisomerase-I-Hemmer (Irinotecan, sog. «payload») (Abb. 1).
Bei Patientinnen mit metastasiertem tripelnegativem Mammakarzinom nach zwei oder mehr Therapielinien konnte gegenüber einer Behandlung nach Wahl des Arztes eine Verlängerung des medianen progressionsfreien Überlebens (PFS) und des Gesamtüberlebens (OS) demonstriert werden (Hazard-Ratio [HR] für Krankheitsprogress oder Tod: 0,41; 95% CI: 0,32–0,52; p<0,001). Das mediane Gesamtüberleben betrug 12 Monate (95% CI: 10,7–14,0) mit Sacituzumab Govitecan und ca. 6,5 Monate (95% CI: 5,8–7,7) mit Chemotherapie (HR für Tod: 0,48; 95% CI: 0,38–0,59; p<0,001). Dies ist bedeutsam, da in dieser Krankeheitssituation bis anhin kaum wirksame und/oder verträgliche Substanzen zur Verfügung standen.
Es wurden bei ca. 60% Grad-1–2-Diarrhö sowie, ebenfalls bei ca. 60%, Grad- 3-Neutropenien beobachtet. Eine Grad- 2-Diarrhö entspricht einer Zunahme der Stuhlfrequenz um 4–6 über der gewohnten Frequenz! Dies ist dem «payload» Irinotecan geschuldet; es bedarf eines erfahrenen Diarrhö-Managements.3 In zahlreichen Studien wird diese Substanz nun weiter untersucht, so z.B. in der neoaduvanten, aber auch postneoadjuvanten Behandlung. Trodelvy® (Firma Gilead, Zug) kann in der Schweiz nach entsprechender Kostengutsprache über Globomedica bezogen werden.
Substanzen beim HER2+ Mammakarzinom
Trastuzumab Deruxtecan
Letztes Jahr wurden Phase-II-Daten zur Wirksamkeit von Trastuzumab Deruxtecan (T-DXd, Enhertu®) beim bereits sehr fortgeschrittenen, HER2-positiven Mammakarzinom vorgestellt (ESMO-Meeting 2020) und im «New England Journal of Medicine» publiziert.4
Die Studie DESTINY Breast 01 wies ein deutliches Ansprechen auf Trastuzumab Deruxtecan nach median sechs Therapielinien in der metastasierten Situation nach, nach Vorbehandlung mit Trastuzumab Emtansin (T-DM1) (Abb. 2). Mit Spannung wurden nun die Phase-III-Studienresultate von DESTINY Breast 03 erwartet.
Abb. 2: Trastuzumab Deruxtecan: Phase-II-Studie bei HER2-positiven Mammakarzinomen. Gestrichelte Linie: 95% CI. (Modifiziert nach Modi et al.)6
Am ESMO-Meeting 2021 präsentierte J. Cortes diese, mit einer extrem beeindruckenden Wirksamkeit von Trastuzumab Deruxtecan in der zweiten Linie, untersucht im Vergleich mit dem bisherigen Standard, T-DM1. Mit einer HR von unglaublichen 0,28 wurde das PFS durch T-DXd hochsignifikant verlängert. Das 12-Monats-PFS konnte von 35% auf >75% gesteigert werden. Das Nebenwirkungsspektrum muss allerdings beachtet werden: Es umfasst hauptsächlich Hämatotoxizität (20% Grad-≥3-Neutropenien, >70% Nausea jeglichen Grades sowie Lungentoxizität mit Pneumonitiden bei ca. 10% (meist G1–2). In der Schweiz ist Enhertu® in dieser Indikation im Rahmen der DESTINY-Breast-12-Studie in verschiedenen Schweizer Zentren anwendbar, es existiert auch ein sog. «named patient program» (NPP).
Weitere ADC werden folgen, so gibt es bereits vielversprechende Resultate zu Trastuzumab Duocarmazin (SYD985).
Tyrosinkinasehemmer Tucatinib
Ebenfalls 2020 wurde der TKI Tucatinib (Tukysa®) als weitere neue, sehr wirksame Substanz bei der Behandlung des HER2-positiven Mammakarzinoms präsentiert. In der HER2CLIMB-Studie waren Patientinnen mit weit fortgeschrittener Erkrankung eingeschlossen.5 48% aller Patientinnen wiesen Hirnmetastasen auf. Wie gut der genannte TKI im Zentralnervensystem wirkt, konnte durch die klare Verlängerung von PFS und, erstmals durch einen TKI, auch von OS bei zerebral erkrankten Patientinnen demonstriert werden. Die PFS-Rate nach einem Jahr lag bei 33,1% mit der Tucatinib-Kombination und bei 12,3% mit der Placebo-Kombination (HR für Krankheitsprogression oder Tod: 0,54; 95% CI: 0,42–0,71; p<0,001). Das OS nach 2 Jahren betrug 44,9% mit der Tucatinib-Kombination und 26,6% mit der Placebo-Kombination (HR für Tod: 0,66; 95% CI: 0,50–0,88; p=0,005), das mediane OS war 21,9 respektive 17,4 Monate. Patientinnen mit Hirnmetastasen zeigten nach einem Jahr eine PFS-Rate von 24,9% mit der Tucatinib-Kombination und 0% mit der Placebo-Kombination (HR: 0,48; 95% CI: 0,34–0,69; p<0,001).
Als Nebenwirkungen wurden sehr häufig Diarrhö (alle Grade 80%) sowie Hand-Fuss-Syndrome beobachtet, allerdings selten höhergradige. Nausea war ebenfalls häufig vorhanden, bei ca. 60% der Patientinnen. Wenn auch hier keine höhergradige Nausea beschrieben wird, so bedeutet dies auch bei Grad 1 oder 2 doch eine Einschränkung der Lebensqualität. In der Schweiz ist Tukysa® nach vorgängiger Kostengutsprache in Kombination mit Trastuzumab und Capecitabin in einer beliebigen Therapielinie nach Pertuzumab und T-DM1 erhältlich (Firma Seagen, Zug).
Literatur:
1 Hernando C et al.: Int J Mol Sci 2021; 22: 7812 2 Bardia A et al.: N Engl J Med 2021; 384: 1529-41 3 Rugo H et al.: Oncologist 2021; 26: 827-34 4 Modi S et al.: N Engl J Med 2020; 382: 610-21 5 Murthy RK et al.: N Engl J Med 2020; 382: 597-609 6 Modi S et al.: SABCS 2020; Poster PD3-06
Das könnte Sie auch interessieren:
Adjuvantes Osimertinib reduziert ZNS-Rezidive bei EGFR-mutierter Erkrankung
Etwa 30% der Patienten mit nicht kleinzelligem Lungenkarzinom (NSCLC) präsentieren sich mit resezierbarer Erkrankung und werden einer kurativen Operation unterzogen. Viele Patienten ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...