FITT – durch die Krebstherapie
Autoren:
Maximilian Köppl
Annelie Voland
Inaam El-Rajab
PD Dr. Joachim Wiskemann
AG Onkologische Sport- und Bewegungstherapie
Abteilung Medizinische Onkologie
Nationales Centrum für Tumorerkrankungen (NCT) Heidelberg
Universitätsklinikum Heidelberg
Korrespondenz:
Sport, Bewegungstherapie und angeleitetes Training können bei Patienten mit Krebs in verschiedenen Settings günstige Auswirkungen haben. Das American College of Sports Medicine (ACSM) hat hierfür spezifische Bewegungsempfehlungen publiziert.
Bewegung vor der Operation
Gerade bei soliden Tumoren ist die operative Entfernung des Tumors nicht wegzudenken. Mit der Schwere der Operation steigt allerdings auch das peri- und postoperative Komplikationsrisiko.1–3 Ein wichtiger Prädiktor der Komplikationswahrscheinlichkeit ist hierbei die körperliche Leistungsfähigkeit.4–6 Konsequenterweise ergibt sich hieraus die Hypothese, inwieweit sich diese Fitness nicht letztlich auf ein höheres körperliches Aktivitätsniveau zurückführen lässt, wonach ein strukturiertes körperliches Training vor einer Tumoroperation zu einer Komplikationsreduktion führen würde. Diese Frage wurde in mehreren randomisiert kontrollierten Studien überprüft und in systematischen Übersichtsarbeiten zusammenfassend beantwortet. Es zeigt sich ein konsistenter Effekt, wonach körperliche Trainings vor der Operation das operative Komplikationsrisiko reduzieren.7–9 Besonders effektiv scheint Training hierbei für das pulmonale Komplikationsrisiko zu sein.8,10 Auch im Hinblick auf die Hospitalisationsdauer zeigt sich durch körperliches Training eine Verkürzung des Krankenhausaufenthalts.8 Hierbei profitieren insbesondere jene Patienten, die ansonsten sehr lange Liegezeiten aufweisen.9
Bewegung als Supportivmaßnahme und in der Nachsorge
Um den mannigfaltigen Nebenwirkungen der Krebstherapie entgegenzuwirken und die Lebensqualität der Patienten zu erhalten, sollen Krebspatienten nach Empfehlung des ACSM pro Woche 150–300 Minuten mindestens moderate körperliche Aktivität, zweimal wöchentlich kräftigende Übungen mit mindestens zwei Sätzen, bei 8–15 Wiederholungen (60% eines Wiederholungsmaximums), sowie tägliche Dehnübungen durchführen.11 Basierend auf einer stetig wachsenden Datenlage hat das ACSM nun erstmals spezifische Bewegungsempfehlungen bei ausgewählten krebsbedingten bzw. Krebstherapie-assoziierten Nebenwirkungen publiziert und anhand der FITT-Kriterien („frequency, intensity, time, type“) operationalisiert.12 Diese sind in Tabelle 1 zusammengefasst. Symptombereiche, für die zwar Evidenz existiert, die allerdings nicht anhand der FITT-Kriterien systematisch präzisiert werden können, sind in Tabelle 2 aufgeführt.
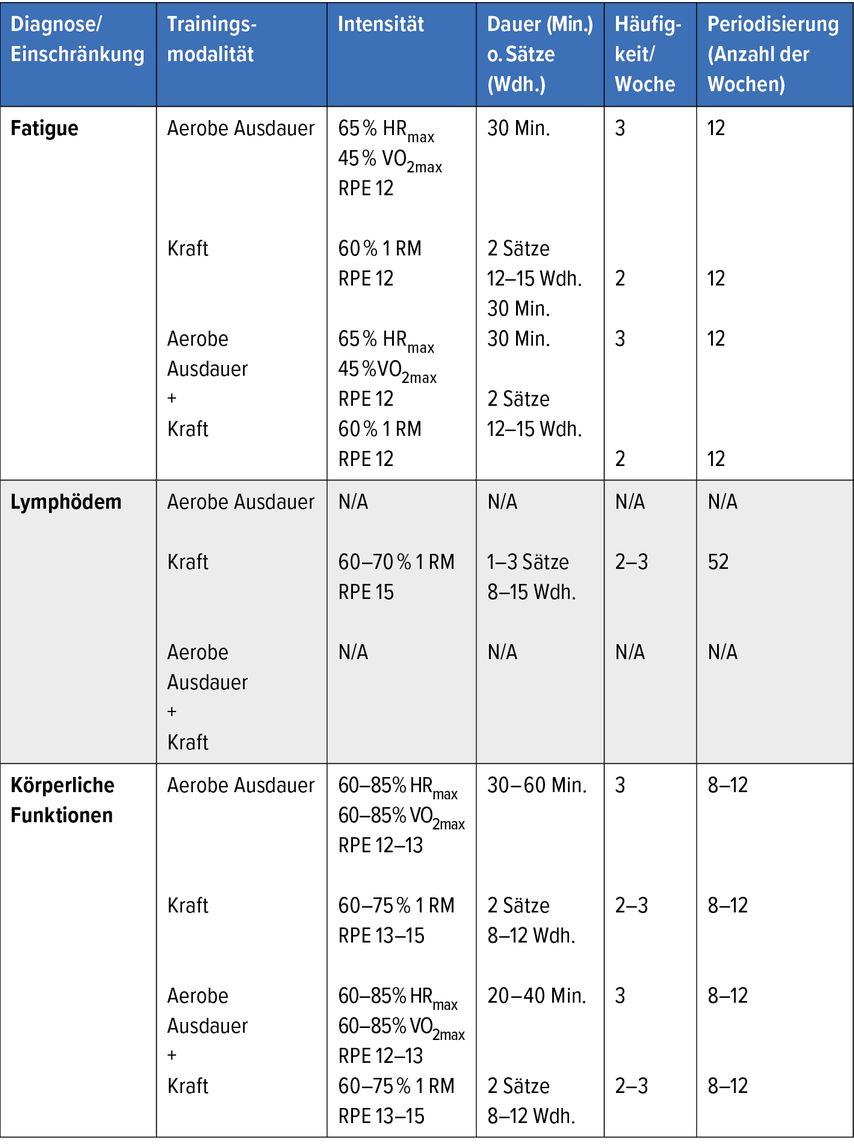
Tab. 1: Beispiele individueller FITT-Kriterien des ACSM bei krebsspezifischen Diagnosen und Einschränkungen (N/A = nicht verfügbar)
Bewegung bei krebsbezogener Fatigue
Mit einer Prävalenz von bis zu 90% besitzt die krebsbezogene Fatigue („cancer-related fatigue“; CRF) eine gewaltige epidemiologische Bedeutung.13 Zum Teil berichten Patienten noch Jahre nach Beendigung der Primärtherapie von starker Erschöpfung und Antriebslosigkeit.14,15 Mit über 200 Studien zeigt die Bewegungstherapie hier die größte Evidenz zur effektiven Behandlung der Fatigue,16 unabhängig von Krebsart, Erkrankungsstadium, Zeit oder Setting der Bewegungsintervention. Die Daten zeigen darüber hinaus, dass insbesondere jene Patienten von einem körperlichen Training profitieren, die initial unter besonders starken Symptomen leiden.17 Im Vergleich mit anderen Interventionsformen konnte sich Bewegung als besonders effektiv bewähren.18 Studien zeigen, dass sowohl Ausdauertraining als auch Krafttraining isoliert wie in Kombination die CRF-Symptomatik reduzieren.12 Die ACSM-Guidelines empfehlen zur Reduktion der Fatigue daher ein mindestens moderates Ausdauertraining über 30 Minuten an drei Tagen die Woche oder ein zweimal pro Woche durchgeführtes Krafttraining mit je zwei Sätzen bei 12–15 Wiederholungen. Hierbei kann das Training in einem betreuten Setting durch einen Trainer angeleitet oder aber selbstständig zu Hause durchgeführt werden.
Lymphödem
Durch operative Entfernung von axillärem Lymphgewebe bei Brustkrebs kann es an der betroffenen Region zu einem erschwerten Abtransport der Lymphflüssigkeit kommen.19,20 Entgegen früheren Empfehlungen konnte in mehreren randomisiert kontrollierten Studien gezeigt werden, dass ein spezifisches Krafttraining im Bereich der oberen Extremität nicht nur sicher, sondern sowohl präventiv als auch therapeutisch wirksam ist.21,22 Das Training sollte durch geschultes Personal supervidiert und mit leichten Gewichten gestartet, zwei- bis dreimal die Woche mit 1–3 Sätzen bei 8–12 Wiederholungen durchgeführt werden.12
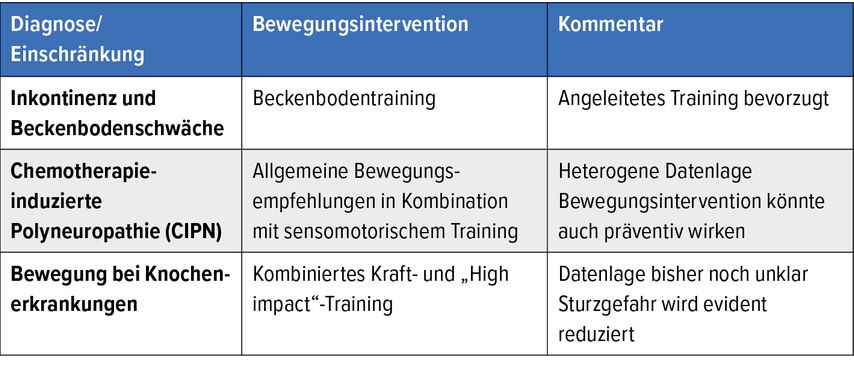
Inkontinenz und Beckenbodenschwäche
Inkontinenz und Beckenbodenschwäche sind gängige Folgen der Resektion urologischer und gynäkologischer Tumoren. Auch hier kann ein gezieltes Training der Beckenbodenmuskulatur Patienten helfen, schneller wieder kontinent zu werden.23 Die größten Effekte erzielen dabei jene Patienten, die bereits vor der Operation ein präventives Beckenbodentraining durchführten und dies auch noch nach der Operation beibehielten.24 Zudem zeigten sich angeleitete Interventionen selbstverantwortlich durchgeführten überlegen.23
Chemotherapie-induzierte Polyneuropathie (CIPN)
Aufgrund der heterogenen Datenlage können im Hinblick auf die CIPN lediglich die oben genannten allgemeinen Aktivitätsempfehlungen der ACSM ausgesprochen werden. Dennoch geben aktuelle Studien einen Hinweis darauf, dass insbesondere sensomotorisches Training die CIPN-Symptomatik reduzieren25–27 und ihr sogar vorbeugen kann.28,29
Bewegung bei funktionellen Einschränkungen
Haben Patienten ihre Erstbehandlung abgeschlossen, zeigen sich sehr häufig Einschränkungen des Bewegungsapparates, welche u.a. auf Narbengewebe und Verwachsungen durch Operationen und auch die Reduktion der körperlichen Aktivität über den Therapieverlauf hinweg und die damit verbundene Dekonditionierung zurückzuführen sind. Die körperliche Aktivität wird nach der Diagnosestellung substanziell reduziert,30,31 insbesondere anstrengende Bewegungsformen nehmen nur noch ein Minimum des alltäglichen Bewegungspensums ein. Es resultiert eine allgemeine Reduktion der Leistungsfähigkeit und Lebensqualität, oft gepaart mit Problemen, den eigenen Alltag zu meistern. Spätestens in der Rehabilitation, aber besser noch mit Beginn der Primärtherapie sollte ein funktionelles Training zum Erhalt der körperlichen Leistungsfähigkeit und zur Prävention therapiebedingter, struktureller Bewegungseinschränkungen erfolgen. So können Patienten nach Therapieabschluss zügig in den Alltag zurückgeführt werden und Anschluss an ihre vorige Belastbarkeit finden. Eine Kombination aus Ausdauer- und Krafttraining, zur Verbesserung der kardiovaskulären Fitness und Muskelkraft ist hier indiziert.12,32
Bewegung bei Knochenerkrankungen
Viele Patienten mit hormonsensiblen Tumoren leben über viele Jahre nach der Primärtherapie mit einer Antihormontherapie. Obwohl die Antihormontherapie vergleichsweise weniger Nebenwirkungen mit sich bringt als andere Krebstherapieformen, muss mit distalen Gesundheitsproblemen wie einem erhöhten Osteoporoserisiko gerechnet werden. Einzelne Studien berichten von einer signifikanten Steigerung der Knochendichte durch ein kombiniertes Kraft- und „High Impact“-Training,33 insgesamt scheint die Datenlage aufgrund der starken Heterogenität von Klientel und Studiendesigns allerdings noch unklar.34 Sicher ist, dass durch körperliches Training die Sturzgefahr und das damit verbundene Frakturrisiko reduziert werden.35
Palliation
Auch im palliativen Setting können Patienten von Bewegung profitieren, selbst Patienten mit Knochenmetastasen können trotz erhöhter Frakturgefahr bewegungstherapeutisch betreut werden. So liegen inzwischen sowohl für Patienten mit stabilen36,37 als auch instabilen Knochenmetastasen38 Daten vor, welche die Sicherheit eines qualifiziert überwachten Krafttrainings unterstreichen. Darüber hinaus konnte statisches Krafttraining parallel zur palliativen Bestrahlung von Wirbelsäulenmetastasen den schmerzlindernden Effekt der Radiotherapie sowohl verstärken als auch substanziell verlängern.39
Versorgungsstrukturen in der Rehabilitation
Die Sport- und Bewegungstherapie ist im Bereich der stationären, medizinischen Rehabilitation und Anschlussheilbehandlung bereits implementiert. Trotz dieser positiven Entwicklung stellt die medizinische Rehabilitation in vielen Fällen den ersten Kontakt der Patienten mit einem sport- und bewegungstherapeutischen Angebot in der Onkologie dar. Hinzu kommt, dass mit 150000 jährlich in Anspruch genommenen Rehabilitationsleistungen gerade einmal 30% der Neuerkankungsrate gedeckt werden. Es entsteht dahingehend eine Versorgungslücke.40 Neben der medizinischen Rehabilitation konnte sich in Deutschland durch die Aufnahme des Rehabilitationssports in das Sozialgesetzbuch IX (§42) und eine Rahmenvereinbarung zur kassenärztlichen Finanzierung ein weitreichendes Netz aus zertifizierten Rehasportangeboten etablieren. Diese Rehasportgruppen werden durch Übungsleiter betreut, die zwar eine Schulung hinsichtlich des Umgangs mit sich in der Nachsorge befindenden Menschen erhalten, letztlich aber keine grundständige bewegungswissenschaftliche oder -therapeutische Qualifikation besitzen.41,42 Gerade in Anbetracht der enormen Komplexität onkologischer Patienten ist eine adäquate Betreuungsqualität jedoch immanent wichtig und die einzige Möglichkeit, Fehl-, Unter- und Überversorgung entlang der gesamten Behandlungstrajektorie zu vermeiden.43
Um diese Versorgungslücke zu schließen, wurde 2012 das Netzwerk OnkoAktiv gegründet, welches es sich zur Aufgabe gemacht hat, akademisch ausgebildete Sporttherapeuten und -wissenschaftler sowie staatlich anerkannte Physiotherapeuten und klinikumsinterne Schlüsselstellen zur Bewegungstherapie oder Bewegungsberatung bundesweit zu vernetzen. Hierdurch soll eine qualitätsgesicherte Versorgungsstruktur etabliert werden, welche die adäquate Betreuung onkologischer Patienten gewährleistet.44,45 Weitere Informationen zum Netzwerk OnkoAktiv finden sich unter www.netzwerk-onkoaktiv.de .
Danksagung:
Das Projekt OnkoAktiv wird durch die BASF SE finanziell unterstützt.
Literatur:
1 Kim H et al.: Morbidity and mortality of laparoscopic gastrectomy versus open gastrectomy for gastric cancer: an interim report—a phase III multicenter, prospective, randomized trial (KLASS Trial). Ann Surg 2010; 251(3): 417-20 2 Kneuertz PJ et al.: Risk of morbidity and mortality following hepato-pancreato-biliary surgery. J Gastrointest Surg 2012; 16(9): 1727-35 3 Spanjersberg W et al.: Systematic review and meta-analysis for laparoscopic versus open colon surgery with or without an ERAS programme. Surg Endosc 2015; 29(12): 3443-53 4 Mendes J et al.: Handgrip strength at admission and time to discharge in medical and surgical inpatients. J Parenter Enteral Nutr 2014; 38(4): 481-8 5 Reisinger KW et al.: Loss of skeletal muscle mass during neoadjuvant chemoradiotherapy predicts postoperative mortality in esophageal cancer surgery. Ann Surg Oncol 2015; 22(13): 4445-52 6 Poirier P et al.: Cardiovascular evaluation and management of severely obese patients undergoing surgery: a science advisory from the American Heart Association. Circulation 2009; 120(1): 86-95 7 Daniels S et al.: Prehabilitation in elective abdominal cancer surgery in older patients: systematic review and meta-analysis. BJS Open 2020; 4(6): 1022 8 Waterland JL et al.: Efficacy of prehabilitation including exercise on postoperative outcomes following abdominal cancer surgery: a systematic review and meta-analysis. Front Surg 2021; 8: 55 9 Köppel M et al.: Körperliches Training vor Krebsoperationen am Gastrointestinaltrakt. Der Gastroenterologe 2019; 14(5): 375-81 10 Assouline B et al.: Preoperative exercise training to prevent postoperative pulmonary complications in adults undergoing major surgery. A systematic review and meta-analysis with trial sequential analysis. Ann Am Thorac Soc 2021; 18(4): 678-88 11 Schmitz KH et al.: American College of Sports Medicine roundtable on exercise guidelines for cancer survivors. Med Sci Sports Exerc 2010; 42(7): 1409-26 12 Campbell KL et al.: Exercise guidelines for cancer survivors: consensus statement from international multidisciplinary roundtable. Med Sci Sports Exerc 2019; 51(11): 2375-90 13 Weis J: Cancer-related fatigue: prevalence, assessment and treatment strategies. Expert Rev Pharmacoecon Outcomes Res 2011; 11(4): 441-6 14 Bower JE et al.: Fatigue in long-term breast carcinoma survivors: a longitudinal investigation. Cancer 2006; 106(4): 751-8 15 Fabi A et al.: The course of cancer related fatigue up to ten years in early breast cancer patients: what impact in clinical practice? Breast 2017; 34: 44-52 16 Kelley GA, Kelley KS: Exercise and cancer-related fatigue in adults: a systematic review of previous systematic reviews with meta-analyses. BMC Cancer 2017; 17(1): 1-17 17 Buffart LM et al.: Targeting exercise interventions to patients with cancer in need: an individual patient data meta-analysis. J Natl Cancer Inst 2018; 110(11): 1190-200 18 Mustian KM et al.: Comparison of pharmaceutical, psychological, and exercise treatments for cancer-related fatigue: a meta-analysis. JAMA Oncol 2017; 3(7): 961-8 19 Armer J, Stewart B: Post-breast cancer lymphedema: incidence increases from 12 to 30 to 60 months. Lymphology 2010; 43(3): 118 20 Hayes SC et al.: Lymphedema after breast cancer: incidence, risk factors, and effect on upper body function. J Clin Oncol 2008; 26(21): 3536-42 21 Schmitz KH et al.: Weight lifting in women with breast-cancer-related lymphedema. N Engl J Med 2009; 361(7): 664-73 22 Schmitz KH et al.: Weight lifting for women at risk for breast cancer-related lymphedema: a randomized trial. JAMA 2010; 304(24): 2699-705 23 Strączyńska A et al.: The impact of pelvic floor muscle training on urinary incontinence in men after radical prostatectomy (RP)–a systematic review. Clin Interv Aging 2019; 14: 1997 24 Overgård M et al.: Does physiotherapist-guided pelvic floor muscle training reduce urinary incontinence after radical prostatectomy?: a randomised controlled trial. Eur Urol 2008; 54(2): 438-48 25 Zimmer P et al.: Eight-week, multimodal exercise counteracts a progress of chemotherapy-induced peripheral neuropathy and improves balance and strength in metastasized colorectal cancer patients: a randomized controlled trial. Support Care Cancer 2018; 26(2): 615-24 26 Streckmann F et al.: Exercise program improves therapy-related side-effects and quality of life in lymphoma patients undergoing therapy. Ann Oncol 2014; 25(2): 493-9 27 Schwenk M et al.: Interactive sensor-based balance training in older cancer patients with chemotherapy-induced peripheral neuropathy: a randomized controlled trial. Gerontology 2016; 62(5): 553-63 28 Streckmann F et al.: The preventive effect of sensorimotor- and vibration exercises on the onset of oxaliplatin-or vinca-alkaloid induced peripheral neuropathies - STOP. BMC Cancer 2018; 18(1): 1-10 29 Müller J et al.: Preventive effect of sensorimotor exercise and resistance training on chemotherapy-induced peripheral neuropathy: arandomised-controlled trial. Br J Cancer 2021; 1: 1-11 30 Lin K-Y et al.: The impact of gynaecological cancer treatment on physical activity levels: a systematic review of observational studies. Braz J Phys Ther 2019; 23(2): 79-92 31 Blanchard CM et al.: Cancer survivors’ adherence to lifestyle behavior recommendations and associations with health-related quality of life: results from the American Cancer Society’s SCS-II. J Clin Oncol 2008; 26(13): 2198-204 32 Buffart LM et al.: Effects and moderators of exercise on quality of life and physical function in patients with cancer: an individual patient data meta-analysis of 34 RCTs. Cancer Treat Rev 2017; 52: 91-104 33 Winters-Stone K et al.: Impact + resistance training improves bone health and body composition in prematurely menopausal breast cancer survivors: a randomized controlled trial. Osteoporos Int 2013; 24(5): 1637-46 34 Fornusek CP, Kilbreath SL: Exercise for improving bone health in women treated for stages I–III breast cancer: a systematic review and meta-analyses. J Cancer Surviv 2017; 11(5): 525-41 35 Sherrington C et al.: Exercise to prevent falls in older adults: an updated systematic review and meta-analysis. Br J Sports Med 2017; 51(24): 1750-8 36 Cormie P et al.: Safety and efficacy of resistance exercise in prostate cancer patients with bone metastases. Prostate Cancer Prostatic Dis 2013; 16(4): 328-35 37 Galvao DA et al.: Exercise preserves physical function in prostate cancer patients with bone metastases. Med Sci Sports Exerc 2018; 50(3): 393 38 Rosenberger F et al.: Spinal stabilization exercises for cancer patients with spinal metastases of high fracture risk: feasibility of the DISPO-II training program. Cancers 2021; 13(2): 201 39 Rief H et al.: Pain response of resistance training of the paravertebral musculature under radiotherapy in patients with spinal bone metastases–a randomized trial. BMC Cancer 2014; 14(1): 1-8 40 DRV: Rentenversicherung in Zeitreihen. 25 ed. Berlin: Deutsche Rentenversicherung Bund 2019 41 Rehabilitationssport für Krebspatienten: Angebot und Zugang am Beispiel von Berlin. Springer, Forum 2019 42 Huber G: Zur Professionalisierung der Bewegungsförderung. B&G Bewegungstherapie und Gesundheitssport 2016; 32(04): 128-32 43Wirtz P et al.: Von der onkologischen Reha-Klinik an den Wohnort–Schnittstellenanalyse unter Berücksichtigung der Bewegungsangebote. Die Rehabilitation 2020; 59(04): 214-22 44 Wiskemann J et al.: Sport und Bewegung nach Krebstherapie–OnkoAktiv als ein Beispiel. Der Gastroenterologe 2019; 14(5): 368-74 45 Wiskemann J et al.: Implementation von Sport- und Bewegungstherapie in die onkologische Routineversorgung. TumorDiagnostik & Therapie 2020; 41(05): 306-10
Das könnte Sie auch interessieren:
Adjuvantes Osimertinib reduziert ZNS-Rezidive bei EGFR-mutierter Erkrankung
Etwa 30% der Patienten mit nicht kleinzelligem Lungenkarzinom (NSCLC) präsentieren sich mit resezierbarer Erkrankung und werden einer kurativen Operation unterzogen. Viele Patienten ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...