Erweiterung der Optionen in allen Therapielinien
Bericht:
Dr. Judith Moser
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Eine Vielfalt an zukunftsweisenden Studiendaten wurde bei der World Conference on Lung Cancer (WCLC) diskutiert, die vom 6. bis 9. September 2025 in Barcelona stattfand und über 7700 Teilnehmer:innen anzog. Unter anderem standen der Einsatz etablierter und neuer Substanzen in verschiedenen Linien sowie die Verbesserung der Therapieplanung mittels Ermittlung der „minimal residual disease“ (MRD) im Fokus.
Adjuvante Chemoimmuntherapie
Selbst nach einer kompletten Resektion und adjuvanten Therapie sind die Rezidivraten im Frühstadium des nichtkleinzelligen Lungenkarzinoms (NSCLC) hoch. Am WCLC 2025 präsentierten Provencio et al. Interimsdaten der Studie NADIM-ADJUVANT, die als erste Phase-III-Studie den Effekt einer Chemoimmuntherapie nach der Resektion von Tumoren im Stadium IB–IIIA demonstrierte.1
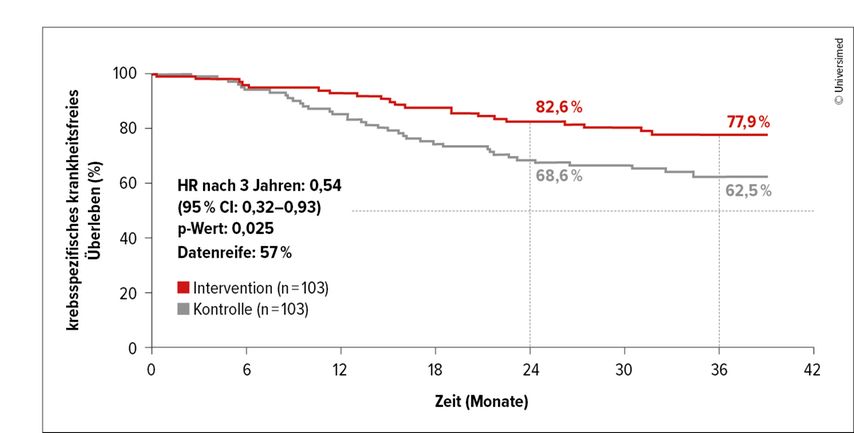
Im Prüfarm (n=103) gelangte Nivolumab alle drei Wochen plus Chemotherapie über vier Zyklen, gefolgt von sechs Zyklen einer Nivolumab-Erhaltung, zur Anwendung, im Kontrollarm (n=103) die Chemotherapie alleine. Hinsichtlich des als primärer Endpunkt definierten krankheitsfreien Überlebens (DFS) war der Median in beiden Armen noch nicht erreicht, jedoch wurde bereits eine relevante Abnahme der Rezidivneigung im Prüfarm mit DFS-Raten von 73,3% vs. 59,9% nach 36 Monaten evident (HR: 0,65; p=0,085). Laut einer krebsspezifischen Sensitivitätsanalyse betrugen die DFS-Raten nach 36 Monaten 77,9% vs. 62,5% (HR: 0,54; p=0,025; Abb.1). Eine Analyse ab dem Tag 90 nach Tumorresektion ergab einen signifikanten Vorteil der Chemoimmuntherapie mit 36-Monats-Raten von 74,7% vs. 60,1% (HR: 0,60; p=0,048).
Abb. 1: Sensitivitätsanalyse zum krebsspezifischen krankheitsfreien Überleben in NADIM-ADJUVANT (modifiziert nach Provencio M et al.)1
Im Prüfarm traten Lokalrezidive ebenso wie Fernrezidive seltener auf als im Kontrollarm. Eine Inanspruchnahme aller adjuvanten Therapiezyklen ging mit einem eindeutigen Benefit einher (HR: 0,55), während aus einer vorzeitigen Beendigung kein Vorteil resultierte (HR: 2,03).
MRD-Negativität laut Guardant-RevealTM-Assay zu Studienbeginn (ca. 90% in beiden Armen) korrelierte mit höheren DFS-Raten als MRD-Positivität. In der MRD-negativen Gruppe bedingte die Kombination einen signifikanten DFS-Benefit (HR: 0,31; p=0,043). Innerhalb des Prüfarms war das mediane DFS in der MRD-negativen Gruppe noch nicht erreicht worden und betrug im MRD-positiven Kollektiv 18,9 Monate (HR: 5,7; p=0,045).
Behandlungsbezogene Nebenwirkungen (TRAE) der Grade 3/4 traten während der adjuvanten Phase häufiger im Prüfarm auf als im Kontrollarm (26,2% vs. 14,5%). Eine Therapiebeendigung aufgrund von TRAE erfolgte in 7,7% vs. 3,8%. Insgesamt entsprach das AE-Profil den bekannten Daten zu Chemoimmuntherapien. Falls sich die Outcome-Verbesserung langfristig bestätigen lässt, könnte mit Nivolumab plus Chemotherapie ein neuer adjuvanter Standard beim frühen NSCLC geschaffen werden.
NAUTIKA1: neoadjuvante Gabe von Alectinib
Zielgerichtete neoadjuvante Strategien werden im Rahmen der Phase-II-Umbrella-Studie NAUTIKA1 bei Patient:innen mit NSCLC geprüft.
Lee et al. stellten Ergebnisse einer Kohorte mit ALK-positiven Tumoren im Stadium IB–IIIB vor, die präoperatives Alectinib über acht Wochen erhielt.2 Postoperativ gelangten bis zu vier Zyklen einer platinbasierten Chemotherapie gefolgt von Alectinib über maximal zwei Jahre zum Einsatz. 30 Patient:innen starteten die neoadjuvante Therapie, 27 wurden operiert und 21 adjuvant behandelt.
Die histologische Analyse der OP-Präparate ergab eine robuste pathologische Regression als Reaktion auf die neoadjuvante Einnahme von Alectinib. Es fand sich eine MPR(„major pathologic response“)-Rate von 60,7% mit pathologischen Komplettremissionen bei 25,0%. Laut radiologischer Befundung sprachen 63,3% der Patient:innen auf die neoadjuvante Therapie an und weitere 30,0% erzielten eine Krankheitsstabilisierung. Bei 43,3% trat ein radiologisches Downstaging ein und bei 33,3% ein pathologisches Downstaging im Bereich der Lymphknoten. Mit 92,6% war die R0-Resektionsrate hoch.
Neoadjuvantes Alectinib erwies sich als gut verträglich. Es wurden keine neuen Sicherheitssignale oder intraoperativen Komplikationen verzeichnet. Zusätzlich zur etablierten Indikation in der Adjuvanz könnte Alectinib künftig auch neoadjuvant Verwendung finden, sodass Patient:innen mit resektablem, ALK-positivem NSCLC im Stadium IB–IIIB von einer perioperativen zielgerichteten Strategie profitieren.
MRD & Outcomes in NeoADAURA
Neoadjuvantes Osimertinib mit oder ohne zusätzliche Chemotherapie hat in der NeoADAURA-Studie beim resektablen EGFR-mutierten NSCLC im Vergleich zur alleinigen neoadjuvanten Chemotherapie eine signifikante MPR-Verbesserung gezeigt.3
Die am WCLC 2025 vorgestellte Analyse der Studiendaten untersuchte die Korrelation zwischen MRD und MPR sowie ereignisfreiem Überleben (EFS).4 Basierend auf „whole genome sequencing“ von Tumor- und Keimbahn-DNA wurden für alle Patient:innen individualisierte MRD-Panels erstellt; anhand dieser erfolgte das MRD-Monitoring mittels NeXT-Personal®-Assay aus dem Plasma. In jedem der drei Arme wurden knapp über 60 Personen analysiert.
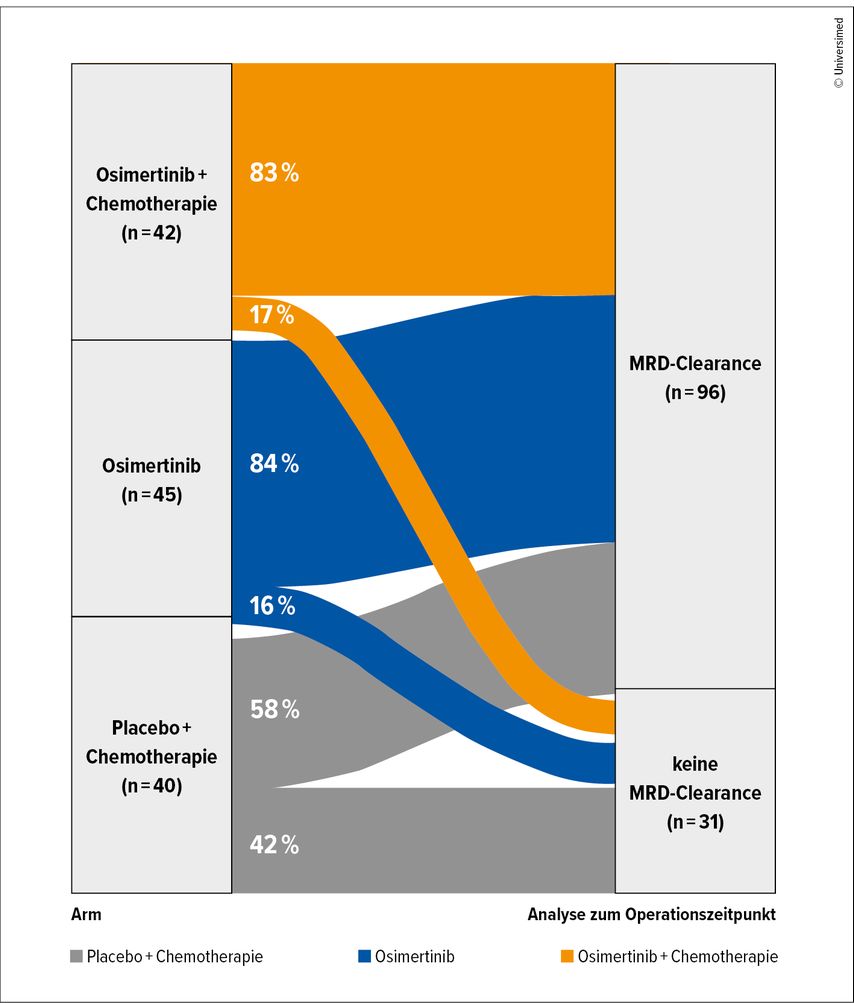
Patient:innen, die zu Studienbeginn MRD-negativ waren, blieben länger ereignisfrei: Nach 18 Monaten betrug die EFS-Rate in dieser Population 96% vs. 82% in der ursprünglich MRD-positiven Gruppe. Als MRD-Clearance war eine ctDNA-Reduktion um den Faktor 10 bzw. MRD-Negativität vor der Operation nach initialer MRD-Positivität definiert. Eine MRD-Clearance trat hauptsächlich unter den Osimertinib-basierten Therapien ein (Abb. 2) und ging im Gesamtkollektiv mit einer signifikant höheren MPR-Rate einher als eine fehlende Clearance (24% vs. 6%; p=0,0378).
Abb. 2: MRD-Clearance unter neoadjuvanter Osimertinib-haltiger Therapie vs. Chemotherapie (modifiziert nach Blakely CM et al.)4
Für die präoperativ festgestellte MRD-Negativität fanden sich ähnliche Ergebnisse mit höheren Raten in den Osimertinib-Armen und einer Assoziation mit der MPR (20% vs. 9% bei MRD-Positivität; p=0,0546). Wie die Autor:innen hervorheben, unterstreichen diese Ergebnisse den potenziellen Nutzen der MRD-Testung zusätzlich zur MPR im Kontext neoadjuvanter Osimertinib-haltiger Therapieschemata.
FLAURA2: finale OS-Analyse
Im Rahmen der Phase-III-Studie FLAURA2 konnte bereits gezeigt werden, dass die Zugabe einer platinbasierten Chemotherapie zur Erstliniengabe von Osimertinib beim fortgeschrittenen, EGFR-mutierten NSCLC gegenüber Osimertinib alleine das progressionsfreie Überleben (PFS) signifikant verlängert.5
Nun bestätigte die finale Analyse des Gesamtüberlebens (OS) die Überlegenheit der Kombination mit einem medianen Unterschied von zehn Monaten (47,5 vs. 37,6 Monate; HR: 0,77; p=0,02).6 Nach vier Jahren lebten 49% vs. 41% der Patient:innen. Der OS-Benefit erwies sich über die Subgruppen hinweg als konsistent, unter anderem war er vom EGFR-Mutationstyp (Exon-19-Deletion vs. L858R-Mutation) und vom Vorhandensein von ZNS-Metastasen unabhängig.
Wie die Analyse weiters vor Augen führte, genoss der mit der Kombination behandelte Arm eine lange chemotherapiefreie Phase. Osimertinib wurde hier im Median 30,5 Monate verabreicht (vs. 21,2 Monate im Monotherapiearm), das Platin 2,8 Monate und Pemetrexed 8,3 Monate. Als erste Folgetherapie erhielten beide Arme am häufigsten eine platinbasierte Chemotherapie; obwohl diese im Kontrollarm bei 72% auf die Osimertinib-Monotherapie folgte, war die Kombinationsstrategie im Prüfarm hinsichtlich des OS überlegen.
Im Verlauf eines zusätzlichen Follow-ups von mehr als zwei Jahren seit der Primäranalyse manifestierten sich keine neuen Sicherheitssignale und im Prüfarm starb niemand aufgrund therapieassoziierter AE (vs. ein Fall im Kontrollarm). Die AE-bedingten Osimertinib-Abbruchraten blieben auf einem niedrigen Niveau. Insgesamt bekräftigt die finale OS-Analyse der FLAURA2-Studie die Bedeutung von Osimertinib plus Chemotherapie als Erstlinientherapiestandard beim fortgeschrittenen EGFR-positiven NSCLC.
Ivonescimab plus Chemotherapie
Die Phase-III-Studie HARMONi wurde initiiert, um den gegen PD-1 und VEGF-A gerichteten bispezifischen Antikörper Ivonescimab beim fortgeschrittenen EGFR-positiven NSCLC nach Progression unter einem Drittgenerations-EGFR-Tyrosinkinasehemmer zu evaluieren.7 Jeweils 219 Patient:innen erhielten Ivonescimab plus Chemotherapie bzw. Placebo plus Chemotherapie. Rund 70% der Patient:innen waren asiatischen Ursprungs; bei ca. 25% lagen Hirnmetastasen vor. Als koprimäre Endpunkte galten OS und PFS laut unabhängigem radiologischem Review.
In Bezug auf das PFS bedingte die Zugabe von Ivonescimab nach einem medianen Follow-up von 22,3 Monaten einen statistisch signifikanten und klinisch relevanten Vorteil mit einer Risikoreduktion um 48% (6,8 vs. 4,4 Monate; HR: 0,52; p<0,0001). Alle Patient:innen profitierten von der Kombination. In der Gruppe mit Hirnmetastasen zu Studienbeginn belief sich die Reduktion des Progressionsrisikos auf 66% (HR: 0,34). Ein größerer Anteil aller im Prüfarm behandelten Patient:innen sprach auf die Therapie an (45% vs. 34%), und die Responsedauer war deutlich länger als im Kontrollarm (7,6 vs. 4,2 Monate).
Hinsichtlich des OS erbrachte die Auswertung einen Trend zugunsten der Kombination (16,8 vs. 14,0 Monate; HR: 0,79; p=0,057). Eine Post-hoc-Analyse der nordamerikanischen und europäischen Patient:innen nach einem längeren Follow-up zeigte konsistente Ergebnisse mit einer numerischen OS-Verlängerung um drei Monate (17,0 vs. 14,0 Monate). Auch in der westlichen Population profitierten alle Subgruppen von der Zugabe von Ivonescimab.
Die Kombination war gut verträglich; TRAE führten in beiden Armen in vergleichbarem Ausmaß zu Therapieabbrüchen (7,3% vs. 5,0%) und zum Tod (1,8% vs. 2,3%). Immunassoziierte sowie für die VEGF-Hemmung typische AE wurden hauptsächlich als niedriggradig eingestuft.
ADC Iza-Bren: präliminäre Daten
Das Antikörper-Wirkstoff-Konjugat (ADC) Iza-Bren (BL-B01D1) setzt sich aus einem gegen EGFR und HER3 gerichteten bispezifischen Antikörper sowie einem neuartigen Topo-I-Inhibitor zusammen.
Zhou et al. präsentierten im Rahmen des WCLC 2025 Phase-II-Daten zu Iza-Bren in verschiedenen Dosierungen zusätzlich zur oralen Einnahme von Osimertinib als Erstlinientherapie des fortgeschrittenen, EGFR-mutierten NSCLC.8 Insgesamt erhielten 154 Patient:innen Iza-Bren in den Dosierungen 2,2mg/kg, 2,5mg/kg oder 2,75mg/kg an den Tagen 1 und 8 eines dreiwöchigen Zyklus bzw. 4,0mg/kg oder 4,5mg/kg alle drei Wochen.
Die Kombination aus Osimertinib und Iza-Bren 2,2–2,75mg/kg wies ein tolerables und beherrschbares Sicherheitsprofil auf. Als häufigste TRAE wurden Zytopenien, Übelkeit und Stomatitis dokumentiert. Höhergradige AE gingen hauptsächlich auf Neutropenien zurück, die mit entsprechenden Maßnahmen gemanagt werden konnten. Dosisreduktionen aufgrund von Neutropenien erfolgten bei 11,4%, Therapiebeendigungen bei 0,8%.
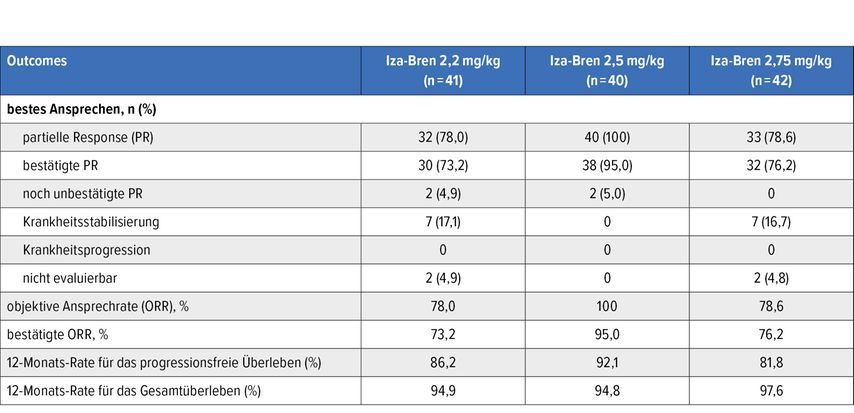
Die Effektivitätsdaten weisen auf eine vielversprechende präliminäre Antitumoraktivität hin. Unter der 2,5-mg/kg-Dosis betrug die ORR 100%; nach zwölf Monaten lebten 94,8% der Patient:innen, und 92,1% waren progressionsfrei (Tab. 1). 85,4% der mit den Dosen 2,2–2,75mg/kg Behandelten erfuhren ein objektives Ansprechen. Die mediane Ansprechdauer war zum Analysezeitpunkt noch nicht erreicht worden. In China prüft derzeit eine Phase-III-Studie Iza-Bren in der Dosis 2,5mg/kg an den Tagen 1 und 8 eines dreiwöchigen Zyklus plus Osimertinib als Erstlinientherapie des EGFR-mutierten NSCLC.
Tab. 1: Wirksamkeitsdaten für Iza-Bren 2,2–2,75 mg/kg in Kombination mit Osimertinib (modifiziert nach Zhou F et al.)8
Beeindruckendes OS unter CAN-2409/Valaciclovir
Beim fortgeschrittenen NSCLC mit unzureichendem Ansprechen auf Immuncheckpoint-Inhibitoren (ICI) evaluierte eine Phase-IIa-Studie das intratumoral verabreichte, replikationsdefiziente Adenovirus CAN-2409.9 Patient:innen, die auf eine ICI-Gabe über >18 Wochen entweder mit Krankheitsstabilisierung (n=5) oder Progression (n=41) reagiert hatten, erhielten zwei intratumorale CAN-2409-Injektionen im Abstand von sechs Wochen, gefolgt von oralem Valaciclovir über zwei Wochen zusätzlich zur kontinuierlichen ICI-Therapie.
Die Analyse ergab ein günstiges Sicherheits- und Verträglichkeitsprofil. TRAE wurden überwiegend als Grad 1 oder 2 bewertet, und weniger als 5% der Patient:innen entwickelten Grad-3-TRAE. Es traten keine dosislimitierenden Toxizitäten und TRAE der Grade 4 oder 5 auf. Als häufigste AE fanden sich Müdigkeit, Übelkeit und Pyrexie. Gleichzeitig konnte ein medianes OS von 21,5 Monaten in der Kohorte mit progredienter Erkrankung verzeichnet werden. Patient:innen mit nichtsquamöser Histologie innerhalb dieser Gruppe erzielten ein medianes OS von 25,4 Monaten.
Abskopale Effekte, d.h. Schrumpfungen nicht behandelter Herde, manifestierten sich bei zwei Dritteln der Patient:innen. Dies weist auf die Entstehung einer systemischen und anhaltenden Antitumorimmunität hin. 37% der Studienteilnehmer:innen waren mehr als zwei Jahre nach der Therapie am Leben. Angesichts dieser Daten erscheint eine randomisierte Phase-III-Studie bei nichtsquamösen Tumoren gerechtfertigt, wie die Wissenschaftler:innen abschließend festhielten.
Quelle:
IASLC 2025 World Conference on Lung Cancer (WCLC) 2025, 6.–9. September 2025, Barcelona, Spanien
Literatur:
1 Provencio M et al.: Adjuvant chemotherapy (CT) vs CT-immunotherapy for R0 stage IB-IIIA NSCLC patients (NADIM ADJUVANT): a randomized, phase 3 trial. WCLC 2025; Abstr. #PL03.10 2 Lee JM et al.: Nautika1: clinical outcomes and pathologic regression with neoadjuvant alectinib in resectable stage IB-IIIB ALK + NSCLC. WCLC 2025; Abstr. #MA04.02 3 He J et al.: Neoadjuvant osimertinib for resectable EGFR-mutated non-small cell lung cancer. JClin Oncol 2025; 43(26): 2875-87 4 Blakely CM et al.: Molecular residual disease (MRD) analysis from NeoADAURA: neoadjuvant osimertinib ± chemotherapy in resectable EGFRm NSCLC. WCLC 2025; Abstr. #OA02.02 5 Planchard D et al.: Osimertinib with or without chemotherapy in EGFR-mutated advanced NSCLC. N Engl J Med 2023; 389(21): 1935-48 6 Planchard D et al.: First-line osimertinib + chemotherapy versus osimertinib monotherapy in EGFRm advanced NSCLC: FLAURA2 final overall survival. WCLC 2025; Abstr. #PL02.06 7 Goldman JW et al.: Ivonescimab vs placebo plus chemo, phase 3 in patients with EGFR+ NSCLC progressed with 3rd gen EGFR-TKI treatment: HARMONi. WCLC 2025; Abstr. #PL02.12 8 Zhou F et al.: Phase II study of iza-bren (BL-B01D1) combo with osimertinib in EGFR mutated locally advanced or metastatic NSCLC patients. WCLC 2025; Abstr. #OA10.04 9 Aggarwal C et al.: CAN-2409 with continued immune checkpoint inhibitor (ICI) in patients with stage III/IV NSCLC with inadequate response to ICI. WCLC 2025; Abstr. #MA10.02
Das könnte Sie auch interessieren:
Adjuvantes Osimertinib reduziert ZNS-Rezidive bei EGFR-mutierter Erkrankung
Etwa 30% der Patienten mit nicht kleinzelligem Lungenkarzinom (NSCLC) präsentieren sich mit resezierbarer Erkrankung und werden einer kurativen Operation unterzogen. Viele Patienten ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...