Einsatz von Plerixafor bei gesunden Stammzellspendern
Autorin:
Univ.-Prof. Dr. Nina Worel
Universitätsklinik für Blutgruppenserologie und Transfusionsmedizin, Wien
E-Mail: nina.worel@meduniwien.ac.at
Plerixafor ist ein Chemokinrezeptor-4(CXCR4)-Antagonist, der in verschiedenen Erkrankungssituationen zur Stammzellmobilisierung zugelassen ist. Im Ermessen der freien Arztentscheidung kann unter bestimmten Voraussetzungen auch eine Anwendung bei gesunden Stammzellspendern erfolgen, um die Mobilisierungseffizienz zu verbessern.
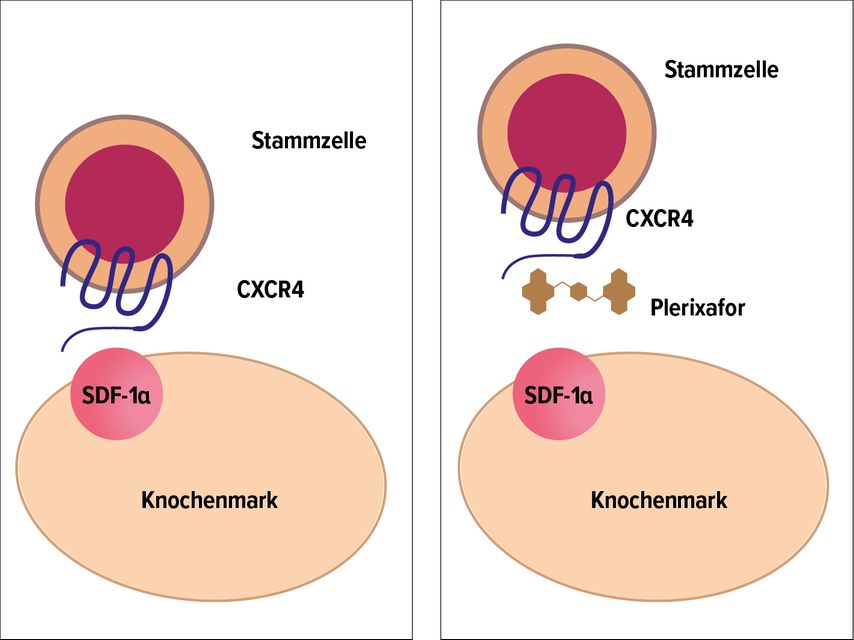
Plerixafor, ein Chemokinrezeptor-4(CXCR4)-Antagonist (Abb. 1), wurde 2008 von der FDA zur Stammzellmobilisierung in Kombination mit G-CSF bei erwachsenen Patienten mit multiplem Myelom (MM) und malignen Lymphomen zugelassen. Die Zulassung durch die EMA erfolgte 2009, mit der Einschränkung auf Patienten, deren Stammzellen nicht ausreichend mobilisierbar sind. Kürzlich erfolgte eine Erweiterung der Zulassung für pädiatrische Patienten mit Lymphom oder soliden malignen Tumoren.
Abb. 1: Wirkmechanismus von Plerixafor. Plerixafor hemmt die Bindung zwischen dem Chemokinrezeptor 4 (CXCR4) der Stammzelle und dem „Stromal derived“-Faktor-1α (modifiziert nach Fricker)11
Plerixafor wird entsprechend der Zulassung bei Erwachsenen in einer Dosierung von 20mg für Patienten bis 83kg oder 240µg/kg Körpergewicht bei Erwachsenen >83kg und bei pädiatrischen Patienten in einer Dosierung von 240µg/kg subkutan 6–11 Stunden vor Start der Stammzellsammlung nach einer 4-tägigen Vorbehandlung mit G-CSF verabreicht. Bei eingeschränkter Nierenfunktion ist die Dosis auf 160µg/kg zu reduzieren. Neben den zwei randomisierten Zulassungsstudien, in denen die Überlegenheit von Plerixafor im Vergleich zu Placebo bei „Up-front“-Mobilisierung gezeigt wurde,1,2 konnte im „Compassionate use“-Programm bei Mobilisierungsversagen in durchschnittlich 66% der Fälle mit Plerixafor3,4 ein Erfolg erreicht werden. Ein „Just in time“-Einsatz von Plerixafor führte zu deutlich höheren Erfolgsraten von >90%.5 Zusätzlich finden sich auch Studien zur Anwendung von Plerixafor außerhalb der Indikation, wie zum Beispiel bei gesunden Spendern.
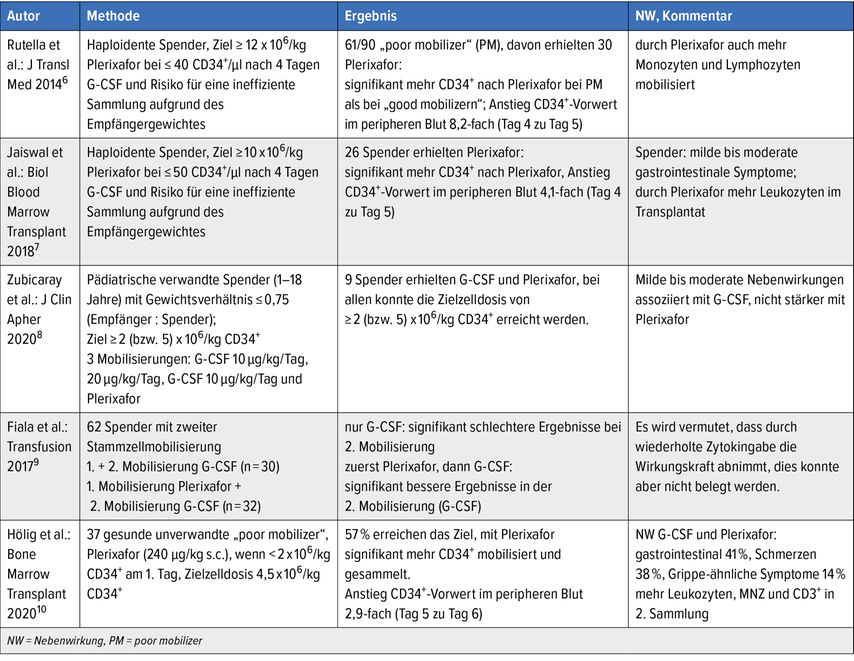
Tab. 1: Stammzellmobilisierung bei gesunden Spendern: Anwendung von Plerixafor außerhalb der Zulassung
Plerixafor zur Sammlung von haploidenten Transplantaten
Haploidente Transplantation mit T-Zell-Depletion
Gerade wenn eine TCR-αβ/CD19-Depletion geplant ist, sind hohe Dosen an Stammzellen für ein erfolgreiches Engraftment zu empfehlen. Rutella untersuchte, ob Plerixafor die Sammlung von „Megadosen“ (>12×106/kg CD34+) an CD34+ erleichtert.6 Es wurden 90 Stammzellspender in die Studie eingeschlossen, alle Probanden erhielten 4 Tage 10µg/kg G-CSF, die Stammzellsammlung wurde an Tag 5 durchgeführt. An Tag 4 erfolgte eine CD34+-Kontrolle. Spender, bei denen ≤40 CD34+/µl gemessen wurden (=schlechte Mobilisierer; PM), erhielten an Tag 4 zusätzlich Plerixafor, wenn aufgrund des Körpergewichts des Empfängers das angestrebte Sammelziel von >12×106/kg CD34+-Zellen nicht erreicht werden konnte. Spender mit >40 CD34+/µl (=gute Mobilisierer; GM) erhielten keine Zusatztherapie.
Insgesamt wurden 29 Spender (32%) als GM klassifiziert, 61 als PM. Davon war allerdings nur bei 30 Spendern das Risiko für eine ineffiziente Zellsammlung (≥12×106/kg CD34+-Zellen) gegeben. Diese PM erhielten Plerixafor. Die CD34+-Zellen waren bei PM am Tag 4 sowohl absolut (16 vs. 36,5 CD34+/µl) als auch relativ signifikant niedriger als bei GM. Nach der Gabe von Plerixafor jedoch waren die CD34+-Zellen bei PM absolut signifikant höher als bei GM (135 vs. 99 CD34+/µl). Die Transplantate nach Plerixafor-Gabe enthielten mehr Monozyten sowie myeloide und plasmazytische dendritische Zellen.
Haploidente Transplantationohne T-Zell-Depletion
Jaiswal untersuchte den Einfluss von Plerixafor auf den Gehalt an T- und natürlichen Killerzellen (NK) im Transplantat.7 In diese Studie wurden allogene Spender ab einem Alter von 10 Jahren eingeschlossen. Plerixafor wurde verabreicht, wenn an Tag 4 von G-CSF <50 CD34+-Zellen/µl gemessen wurden und aufgrund des Empfängergewichts das angestrebte Ziel von >10x106/kg CD34+-Zellen nicht erreicht werden konnte.
In diese Studie wurden 51 Spender eingeschlossen, 26 Spender erhielten Plerixafor. Trotz signifikant niedrigerer medianer CD34+-Werte an Tag 4 in der Plerixafor-Gruppe (33 [6–47] Zellen/µl vs. 81 [50–168] Zellen/µl in der G-CSF-Gruppe; p=0,0001) waren die CD34+-Werte an Tag 5 (Median 136 vs. 139 Zellen/µl) sowie im Transplantat nach Plerixafor (2,7 versus 2,3×106/ml, p=0,1) zwischen den zwei Gruppen vergleichbar. Die Gesamtzahl der Leukozyten war in der Plerixafor-Gruppe etwas niedriger (3,1 vs. 3,4×108/ml, p=0,05), in Bezug auf CD3+-, CD4+-, CD8+-, NK-Zellen und regulatorische T-Zellen gab es keinen Unterschied.
Plerixafor zur Sammlung von allogenen Transplantaten bei pädiatrischen Spendern
Eine spanische Forschergruppe untersuchte den Einsatz von Plerixafor bei pädiatrischen Stammzellspendern mit einem ungünstigen Verhältnis zwischen Spender- und Empfängergewicht (Empfänger/Spender-Ratio von 0,75).8
In einem retrospektiven Ansatz wurden die CD34+-Mobilisierungs- und Sammelergebnisse bei 46 pädiatrischen Spendern mit ungünstigem Gewichtsverhältnis (0,24–0,75) ausgewertet. Als Mobilisierung erhielten 28 (60,9%) Spender Standard(S)G-CSF (10µg/kg/Tag), 9 Spender (19,6%) hoch dosiertes (HD) G-CSF (10µg/kg/12 Stunden) und weitere 9 Spender (19,6%) S-G-CSF (10µg/kg/Tag) und Plerixafor. Das Sammelziel war mindestens 2×106/kg CD34+-Zellen, optimal 5×106/kg CD34+-Zellen. Die Effizienz der Mobilisierung war mit Plerixafor am höchsten (208 CD34+/µl vs. 93 CD34+/µl bei HD-G-CSF und 54 CD34+/µl bei S-G-CSF; p<0,0001). Das minimale Sammelziel konnte bei allen Spendern mit Plerixafor erreicht werden, aber nur bei 79% bzw. 78% nach Mobilisierung mit S-G-CSF und HD-G-CSF. Noch deutlicher waren die Unterschiede bei ≥5×106/kg CD34+-Zellen: Dies wurde bei allen Spendern in der Plerixafor-Gruppe, aber nur von 44% und 29% der HD-G-CSF- und S-G-CSF-Gruppe erreicht. Die Nebenwirkung der Mobilisierung waren zumeist G-CSF-assoziiert (Kopf- und Knochenschmerzen, subfebrile Temperaturen, Myalgien und abdominelle Beschwerden). Durch Plerixafor traten keine zusätzlichen Nebenwirkungen auf.
Plerixafor in der Remobilisierung bei gesunden Spendern
Fiala et al. untersuchten retrospektiv 62 Spender, die ein zweites Mal mobilisiert werden mussten.9 Dreißig Spender wurden sowohl beim ersten Mal als auch in der Remobilisierung mit G-CSF stimuliert, 32 Spender erhielten zur ersten Mobilisierung Plerixafor und für die zweite Mobilisierung G-CSF. Es wurde jeweils nur der 1. Apheresetag jeder Mobilisierung verglichen. Der Grund für eine zweite Mobilisierung war in der G-CSF-Gruppe ein Transplantatversagen oder Rezidiv, in der Plerixafor-Gruppe in 18 Fällen (56%) ein Mobilisierungsversagen. Interessanterweise zeigten Spender, die nur mit G-CSF mobilisiert wurden, signifikant schlechtere Mobilisierungs- und Sammelergebnisse bei der zweiten Mobilisierung (69 vs. 37 CD34+/µl und 5,6x106/kg CD34+vs. 3,3×106/kg CD34+), wohingegen Spender, die zuerst mit Plerixafor und dann mit G-CSF mobilisiert wurden, signifikant bessere Ergebnisse in der zweiten Mobilisierung aufwiesen (15 vs. 68 CD34+/µl und 2,5×106/kg CD34+vs. 7,1x106/kg CD34+). Die Autoren sehen die Ursache in einer möglicherweise verminderten Effizienz von Zytokinen nach wiederholter Anwendung, konnten ihre Annahme aber nicht schlüssig erklären.
„Just in time“-Verabreichung von Plerixafor zur Verhinderung eines Mobilisierungsversagens
Ganz aktuell untersuchte eine deutsche Studiengruppe um Kristina Hölig den Einsatz von Plerixafor bei drohendem Mobilisierungsversagen bei gesunden unverwandten Spendern.10 Plerixafor (240µg/kg s.c. um 22:00 Uhr) wurde dann verabreicht, wenn am ersten Tag <2,0×106/kg CD34+-Zellen gesammelt wurden.
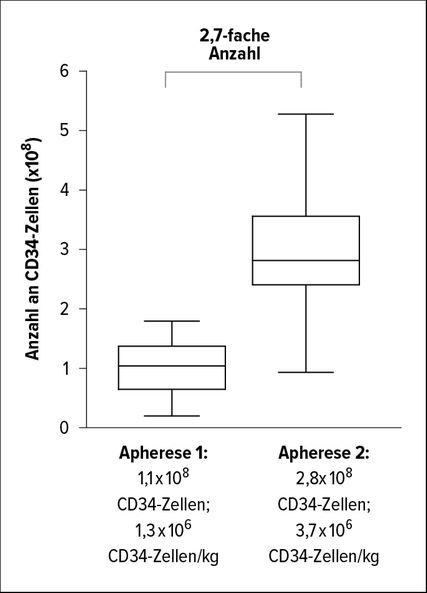
Abb. 2: „Just in time“-Verabreichung von Plerixafor bei drohendem Mobilisierungsversagen (adaptiert nach Hölig et al.)10
Im Vorfeld konnten folgende Risikofaktoren für ein Mobilisierungsversagen definiert werden: weiblicher Spender >40 Jahre, Spendergewicht von <70kg, Thrombozyten <200G/l, Verhältnis Körpergewicht des Empfängers zu Körpergewicht des Spenders von 130%. Die Spender wurden bereits bei der Voruntersuchung auf das Risiko für ein Mobilisierungsversagen hingewiesen. Ziel war es, mit Plerixafor >4,5×106/kg CD34+ zu sammeln.
In diese prospektive Phase-II-Studie (MOBIL1) wurden 37 Spender eingeschlossen. Durch den Einsatz von Plerixafor konnte bei 21/37 (57%) der Spender die Zielzelldosis an CD34+-Zellen gesammelt werden. Die Spender wiesen signifikant höhere CD34+-Werte im peripheren Blut vor der zweiten Apherese verglichen mit dem Vortag (15 vs. 44 CD34+/µl) auf. Es konnten mit Plerixafor signifikant mehr CD34+-Zellen (1,3×106/kg CD34+ vs. 3,7×106/kg CD34+), aber auch mehr Leukozyten, mononukleäre Zellen und CD3+-Zellen als in der ersten Apherese gesammelt werden (Abb. 2).
Fazit
Die Anwendung von Plerixafor außerhalb der Zulassung bei gesunden Spendern in Kombination mit G-CSF scheint sicher und effizient zu sein.
Die Zusammensetzung der mit Plerixafor gesammelten Transplantate unterscheidet sich zu G-CSF in der Anzahl an Leukozyten und CD3+-Zellen. Derzeit vorliegende Daten zur akuten und chronischen GVHD (Graft-versus-Host-Erkrankung) bei Patienten nach Transplantation von mit Plerixafor stimulierten Präparaten sind vergleichbar mit jenen von mit G-CSF stimulierten Transplantaten.
Der Einsatz von Plerixafor bei gesunden Spendern sollte wohlüberlegt erfolgen, wenn die Mobilisierungseffizienz gering bzw. das Gewichtsverhältnis Spender zu Empfänger ungünstig ist.
Literatur:
1 DiPersio JF et al.: Phase III prospective randomized double-blind placebo-controlled trial of plerixafor plus granulocyte colony-stimulating factor compared with placebo plus granulocyte colony-stimulating factor for autologous stem-cell mobilization and transplantation for patients with non-Hodgkin’s lymphoma. J Clin Oncol 2009; 27(28): 4767-73 2 DiPersio JF et al.: Plerixafor and G-CSF versus placebo and G-CSF to mobilize hematopoietic stem cells for autologous stem cell transplantation in patients with multiple myeloma. Blood 2009; 113(23): 5720-6 3 Calandra G et al.: AMD3100 plus G-CSF can successfully mobilize CD34+ cells from non-Hodgkin’s lymphoma, Hodgkin’s disease and multiple myeloma patients previously failing mobilization with chemotherapy and/or cytokine treatment: compassionate use data. Bone Marrow Transplant 2008; 41(4): 331-8 4 Worel N et al.: Plerixafor and granulocyte-colony-stimulating factor (G-CSF) in patients with lymphoma and multiple myeloma previously failing mobilization with G-CSF with or without chemotherapy for autologous hematopoietic stem cell mobilization: the Austrian experience on a named patient program. Transfusion 2011; 51(5): 968-75 5 Worel N et al.: Plerixafor as preemptive strategy results in high success rates in autologous stem cell mobilization failure. J Clin Apher 2017; 32(4): 224-34 6 Rutella S et al.: Mobilization of healthy donors with plerixafor affects the cellular composition of T-cell receptor (TCR)-αβ/CD19-depleted haploidentical stem cell grafts. J Transl Med 2014; 12: 240-54 7 Jaiswal SR et al.: Impact of single-dose plerixafor as an adjunct to granulocyte colony-stimulating factor-based peripheral blood stem cell mobilization on the graft composition and outcome for t cell-replete haploidentical peripheral blood stem cell transplantation with post-transplantation cyclophosphamide: a comparative study. Biol Blood Marrow Transplant 2018; 24(3): 542-8 8 Zubicaray J et al.: Plerixafor-based mobilization in pediatric healthy donors with unfavorable donor/recipient body weight ratio resulted in a better CD34 + collection yield: aretrospective analysis. J Clin Apher 2021; 36(1): 78-86 9 Fiala MA et al.: Remobilization of hematopoietic stem cells in healthy donors for allogeneic transplantation. Transfusion 2016; 56(9): 2331-5 10 Hölig K et al.: Salvage treatment with plerixafor in poor mobilizing allogeneic stem cell donors: results of a prospective phase II-trial. Bone Marrow Transplant 2021; 56(3): 635-45 11 Fricker SP: Physiology and pharmacology of plerixafor. Transfus Med Hemother 2013; 40: 237-45
Das könnte Sie auch interessieren:
Adjuvantes Osimertinib reduziert ZNS-Rezidive bei EGFR-mutierter Erkrankung
Etwa 30% der Patienten mit nicht kleinzelligem Lungenkarzinom (NSCLC) präsentieren sich mit resezierbarer Erkrankung und werden einer kurativen Operation unterzogen. Viele Patienten ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...