Einblicke ins Heute und Ausblicke ins Morgen
Bericht:
Dr. Kassandra Settele
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Mit mehr als 5000 Teilnehmer*innen aus über 100 Ländern fand die World Conference on Lung Cancer (WCLC) Anfang August in Wien statt. Epidemiologie, Diagnostik, Therapie und Palliation – das Meeting bot die Möglichkeit zum interdisziplinären Austausch und zurweltweiten Vernetzung.
Keypoints
-
Die OS-Interimsanalyse von IMpower010 zeigt einen Trend zu einer Verlängerung des Gesamtüberlebens unter Atezolizumab.
-
Patient*innen mit Oligometastasierung können unter bestimmten Voraussetzungen von Lokaltherapien profitieren.
-
Bei der Ausweitung von Screeningprogrammen müssen verschiedene Faktoren beachtet werden. Rauchstopp und Tabakkontrolle bleiben die wichtigsten Faktoren in der Lungenkrebsbekämpfung und können durch Screeningprogramme nicht ersetzt werden.
-
Technologien wie Artificial Intelligence und Big Data werden zukünftig die Möglichkeiten in Diagnostik und Therapie bereichern.
Schwerpunkte der diesjährigen World Conference on Lung Cancer (WCLC) waren zum einen die Immuntherapien, insbesondere im adjuvanten Setting. Zum anderen lagen Behandlungsperspektiven bei oligometastatischer Erkrankung im Fokus sowie die Frage, ob und wie Lungenkrebs-Screeningprogramme umgesetzt werden sollen und auf welche Arten die Thoraxonkologie von Artificial Intelligence profitieren kann.
IMpower010
Im Bereich der Immuntherapien war besonders die Studie IMpower010 interessant. Die randomisierte, multizentrische, offene Phase-III-Studie verglich bei Patient*innen mit komplett reseziertem nichtkleinzelligem Lungenkarzinom (NSCLC) im Stadium IB–IIIA nach adjuvanter Chemotherapie die Atezolizumab-Gabe mit „best supportive care“. Hierbei wurde bereits ein Benefit bzgl. des krankheitsfreien Überlebens (DFS) für die Stadien II–IIIA gezeigt mit einer HR von 0,70 (95% CI: 0,64–0,96; p=0,020). Besonders gut profitierten Patient*innen im Stadium II–IIIA mit einem PD-L1 TC ≥1% – in dieser Population betrug die HR 0,66 (95% CI: 0,50–0,88; p=0,0039).1
Erste OS-Analyse
Nach einem medianen Follow-up von 45,3 Monaten erfolgte nun die erste Interimsanalyse bzgl. des Gesamtüberlebens (OS), wobei die Daten zwar noch nicht reif sind, aber klinisch interessant. Hier zeigte sich ein Trend für verlängertes OS unter Atezolizumab in der PD-L1-positiven Population im Stadium II–IIIA mit einer HR von 0,71 (95% CI: 0,49–1,03). Die geschätzte OS-Rate nach 36 Monaten betrug 82,1% vs. 78,9%; nach 60 Monaten lag sie bei 76,8% vs. 67,5%.
In der Intent-to-treat-Population (alle randomisierten Patient*innen im Stadium IB–IIIA) und in der Population der Patient*innen im Stadium II–IIIA fand sich allerdings kein Unterschied im Gesamtüberleben zwischen den beiden Studienarmen. Demgegenüber wurde jedoch in der Population der Patient*innen mit PD-L1 ≥50% ein klinisch bedeutsamer Trend zu einem Überlebensvorteil gezeigt mit einer HR von 0,43 (95% CI: 0,24–0,78). Es traten keine neuen Sicherheitssignale auf.2
Hot Topic Oligometastasierung
Das Management von Patient*innen mit einer oligometastasierten Erkrankung war Gegenstand der zweiten Plenary Session. Ein heißes Thema – denn Patient*innen mit Tumorerkrankungen, die nur eine beschränkte Metastasierungskapazität aufweisen, könnten durch die Anwendung (radikaler) lokaler Therapien geheilt werden. Welche Patient*innen genau profitieren, ist zum aktuellen Zeitpunkt allerdings noch unklar.3
Definition Oligometastasierung
Anne-Marie Dingemans, Erasmus MC University Medical Center, betonte zunächst die Wichtigkeit einer allgemeinen Definition der Oligometastasierung. Verschiedene randomisierte klinische Studien hatten einen Vorteil einer lokalen Therapie in diesem Setting gezeigt – jedoch war recht unterschiedlich definiert, welche Fälle als oligometastatisch galten.4
Ein Konsensus-Statement der European Organization for Research and Treatment of Cancer (EORTC) Lung Cancer Group (LCG) stellt einen ersten Schritt in Richtung einer allgemeinen Definition dar: Die Gruppe schlägt aufgrund eines systematischen Reviews als Surrogatparameter für die geringe Metastasierungskapazität eine Höchstzahl von fünf Metastasen in drei Organen vor – allerdings muss in jedem Fall die Machbarkeit und klinische Bedeutung einer radikalen Therapie evaluiert werden.6
Matthias Guckenberger, Universitätsspital Zürich, stellte jedoch fest, dass Oligometastasierung in der Praxis ein häufiges Vorkommen ist. Das führe zu einer großen Heterogenität der Fälle.7 Die European Society for Radiotherapy and Oncology und die European Organisation for Research and Treatment of Cancer schlagen deshalb einen Entscheidungsbaum zur genaueren Klassifikation der Oligometastasierung vor, der zwischen 9 Subtypen unterscheidet.8
Der nächster Sprecher, John Heymach vom MD Anderson Cancer Center, schlug in eine ähnliche Kerbe, indem er betonte, dass die Anzahl der Metastasen nicht alleine ausschlaggebend ist, um einen Benefit durch eine lokale Therapie wahrscheinlich zu machen. Eine multidimensionale Betrachtungsweise würde Faktoren wie die Tumorgröße, die tatsächliche Metastasierungsneigung, das Therapieansprechen etc. miteinbeziehen und könnte ggf. auch polymetastasierte Fälle identifizieren, die profitieren könnten (z.B. bei Erreichen eines induzierten oligometastatischen Status durch Ansprechen auf eine systemische Therapie).3 Eric Lim, Royal Brompton Hospital, wies darauf hin, dass die Metastasenanzahl und die Restriktion auf eine De-novo-Oligometastasierung arbiträr festgelegte Parameter sind und weitere Studien dringend notwendig sind, um valide Kriterien festlegen zu können. In der Behandlung müssten alle verfügbaren Möglichkeiten ausgeschöpft werden, ohne jedoch Sicherheit, Lebensqualität und Behandlungskosten außer Acht zu lassen.8
Therapiesequenz und Kombination
Was Timing und Kombination von systemischer und lokaler Therapie angeht, gab Delphine Antoni, Icans Institut De Cancérologie Strasborge Europe, einen Einblick: Zwar könnte die Gabe der systemischen Therapie „upfront“, also vor lokaler Therapie, es ermöglichen, die tatsächlich oligometastatischen Fälle zu identifizieren und eine Überbehandlung zu vermeiden. Auf der anderen Seite könnte die lokale Therapie, wenn sie zuerst durchgeführt wird, das Ansprechen auf die systemische Behandlung verbessern, indem ein großer Teil der Tumormasse entfernt wird. Welches Vorgehen optimal ist, ist noch unklar.
Daher untersucht eine Reihe klinischer Studien derzeit verschiedene Kombinationen lokal-ablativer, lokal-konsolidierender und systemischer Therapien. Antoni hielt jedoch fest: Lokaltherapeutische Maßnahmen spielen bereits jetzt eine wichtige Rolle im Management oligometastatischer Tumorerkrankungen und ihr zunehmender Einsatz ist effektiv und sicher.9
Früherkennung
Ein weiteres wichtiges Thema war die Umsetzung und Verbesserung von Lungenkrebs-Früherkennungsprogrammen. Annette McWilliams, University of Western Australia, erläuterte pointiert: „Lung cancer screening is a process, not a test.“
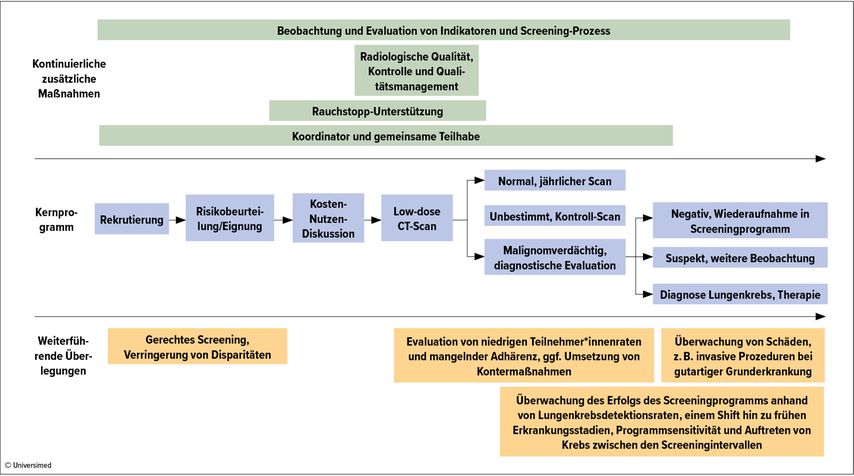
Zwar habe man in den letzten zwanzig Jahren eine solide Kernstruktur herausgearbeitet, diese müsse aber stetig anhand der neuesten Forschungergebnisse verfeinert werden. Darüber hinaus müssten zusätzliche Maßnahmen (z.B. Rauchstoppunterstützung) umgesetzt und verschiedene weiterführende Überlegungen angestellt werden (z.B. bzgl. der Auswahl der Screeningpopulation sowie der Verbesserung von Teilnehmer*innenzahlen und Adhärenz) – dies gilt insbesondere bei Ausweitung der Screeningprogramme vom Studiensetting auf größere Screeningpopulationen. Der Screeningprozess solle dabei durchgehend evaluiert und Schritt für Schritt verbessert bzw. ausgeweitet werden (Abb.1).10
Auswahl der Screeningteilnehmer*innen
Die Auswahl der Screeningpopulation findet derzeit in verschiedenen Ländern anhand unterschiedlicher Merkmale statt, wie Hilary Robbins, International Agency for Research on Cancer, ausführte. Dabei werden häufig das Alter und die Anzahl der „pack years“ und „quit years“ herangezogen. Diese stellten zwar leicht anwendbare Kriterien dar, hätten aber nur eine geringe Vorhersagegenauigkeit.
Andere Optionen wären genauere Risikomodelle, die derzeit jedoch v.a. ältere und kränkere Populationen für das Screening priorisieren, sowie Modelle für den Gewinn an Lebensjahren, die sich jedoch noch in Entwicklung befinden und erst validiert werden müssen. Des Weiteren könnten Biomarker in Zukunft eine Möglichkeit zur verfeinerten Auswahl der Teilnehmer*innen darstellen.
Robbins stellte darüber hinaus fest, dass sowohl hinsichtlich der Screeningteilnahme als auch der Adhärenz für Follow-up-Termine weitere Studien zur Verbesserung der Screeningprogramme notwendig sind. Um die Teilnahme am Lungenkrebsscreening zu fördern, könnten Strategien etablierter Screeningprogramme übernommen werden, wie z.B. Vorab-Einladungsschreiben und fixe Terminvergaben. Was die Adhärenz für das Follow-up angeht, hat sich in US-amerikanischen Studien der Einsatz eine*r zentralen Koordinator*in bewährt, der*die Screeningeinladungen, Berichte der Resultate und Terminerinnerungen zentralisiert handhabt.11
Unterstützung beim Rauchstopp
Screeningprogramme sollen durch Angebote zur Rauchentwöhnung ergänzt werden. Denn wie Rachel Murray, University of Nottingham, ansprach, stellt der Kontakt beim Lungenkrebsscreening eine fantastische Möglichkeit dar, um die Behandlung einer Tabakabhängigkeit zu beginnen.
In der „Yorkshire Stop Smoking Study“ (YESS), die sie in der „Top-Rated Abstracts Session“ präsentierte, wurde ein spezielles Programm zur Rauchstoppunterstützung im Rahmen des Lungenkrebsscreenings überprüft: Die Interventionsgruppe erhielt – zusätzlich zu verhaltensbezogener Unterstützung und pharmakotherapeutischen Maßnahmen, die auch die Kontrollgruppe erhielt – 4 Wochen nach dem Screening Bilder ihres eigenen Herzens und der eigenen Lunge, die bereits entstandene Schäden dokumentierten sowie als positive Motivation noch gesunde oder wenig geschädigte Lungenareale zeigten.
Die Ergebnisse zeigten in beiden Gruppen ungewöhnlich hohe Abstinenzraten nach drei Monaten: Sie lagen bei 33,6% in der Interventionsgruppe und 30,0% in der Kontrollgruppe. In den meisten Fällen war die Tabakabstinenz lang anhaltend, denn nach 12 Monaten waren 29,2% bzw. 28,6% weiterhin abstinent. Es gab damit keinen bedeutenden Unterschied durch die zusätzliche Intervention.
Laut Murray könnte der Grund dafür sein, dass die Kontrollgruppe bereits eine bessere Versorgung erhielt als üblich. Das Feedback der Teilnehmer*innen war in beiden Gruppen sehr positiv und hob die Vorwurfs-freie Haltung der Rauchstopp-Unterstützer*innen deutlich hervor. Außerdem scheint ein kontinuierliches Unterstützungsangebot sich auch auf jene Screening-Teilnehmer*innen positiv auszuwirken, die beim Erstkontakt noch nicht zu einem Rauchstopp bereit sind.12
Jacek Jassem, Universität Danzig, betonte in der Diskussion: Die effektivste Lungenkrebsprävention ist der Rauchstopp – Lungenkrebsscreening ist kein Ersatz dafür.13 Während Screeningprogramme die Lungenkrebsmortalität um 20% senken können, kann eine Kombination mit einer Tabakstopp-Intervention die Mortalität um bis zu 40% senken.14 Jassem bezeichnete Screeningprogramme ohne Rauchstoppinterventionen sogar als unethisch: Denn das Screening könnte von Teilnehmer*innen als Alternative zum Rauchstopp aufgefasst werden.
Bisher ist allerdings unklar, wie sich eine Rauchstopp-Intervention optimal gestaltet. Jassem hob jedoch hervor, dass Raucher*innen keine Vorwürfe gemacht werden sollten. Dies war in der YESS-Studie besonders gut gelungen, wie man am Feedback der Teilnehmer*innen sah. 13
Ein Teilnehmer fasste seine Erfahrung mit den Rauchstopp-Unterstützer*innen so zusammen: „They don’t criticise. They don’t start lecturing. They just appreciate what it’s like to try and stop. And know full well the best way to help somebody is just to be sympathetic towards it and them and just try and help as much as possible …“12 Behandler*innen sollten, wie in der YESS-Studie geschehen, Raucherinnen einfühlsam und hilfreich begegnen, schloss Jassem.
Artificial Intelligence und Big Data
Die Einsatzmöglichkeiten von Artificial Intelligence (AI) in der Medizin sind vielfältig. In der Plenary Session 4 wurde ihre Anwendung in verschiedenen Bereichen beleuchtet und in die Zukunft geblickt.
Digitale Pathologie
Zunächst gab Douglas Hartman, University of Pittsburgh Medical Center, einen Einblick in die digitale Pathologie. Das Interesse an digitalen Lösungen seitens der Patholog*innen sei zwar hoch, da damit Arbeitsabläufe verbessert werden können und sich neue Möglichkeiten, wie z.B. die Befundung im Homeoffice und ein einfacherer Austausch mit Kolleg*innen, eröffnen. Ein Nachteil seien allerdings die Kosten der Infrastruktur für die digitale Pathologie, die derzeit nicht erstattet würden.
AI könnte Patholog*innen in Zukunft auf verschiedene Arten bei der Befundung unterstützen. Beispielsweise stellte Hartman ein Tool vor, das mittels eines Algorithmus auf den digitalen Schnitten auffällige Regionen markiert und so die Befundungsdauer verkürzen kann. Außerdem könnten mittels AI auch detaillierte Berichte ermöglicht und/oder akkuratere Prognosen erstellt werden als bisher.
Wichtig ist der Unterschied zwischen Algorithmen, die einem fixen Muster folgen, und solchen, die beim Einsatz weiter dazulernen. Hier stellt sich die Frage, wie die Leistung Letzterer beim Betrieb evaluiert werden kann und wie eventuelle Risiken gehandhabt werden, die durch das kontinuierliche Lernen entstehen könnten. Derzeit ist in den USA ein Algorithmus dieser Art zugelassen, der beim Prostatakarzinom eine Einteilung gemäß Gleason-Score vornimmt.15
Radiologie
Anschließend sprach Fergus Gleeson, Oxford University, über Applikationen von AI in der Radiologie. Derzeit liege der Fokus auf Tools, die die Detektion von Herden und ihre Vermessung beherrschen. Diese stellen die Basis dar, auf der AI in Zukunft erlernen kann, konkrete Diagnosen zu stellen.
Gleeson hob hervor, dass Algorithmen jedoch nicht unabhängig von den verwendeten Geräten betrachtet werden dürfen. Wenn ein neuer Computertomograf angeschafft wird, kann es sein, dass der Algorithmus genauere Ergebnisse liefert, da er auf bessere Daten zugreifen kann. Dennoch muss sichergestellt werden, dass der Algorithmus für das technische Gerät, das die Daten generiert, validiert ist. Weitere Limitationen von AI-Technologien bestehen in einer mangelnden Anwendbarkeit bei schlechter Bildqualität und dem Vorliegen anderer beeinträchtigender Faktoren wie z.B. Komorbiditäten, die ggf. nicht in das Training der AI miteingeflossen sind. Gleeson stellte darüber hinaus fest: Menschen können radiologische Bilder in einen gewissen Kontext setzen (z.B. würde man bei einer 17-jährigen Patientin mit auffälliger CT-Bildgebung nicht als Erstes an ein Lungenkarzinom denken; bei einem auffälligen Bild aus einem Screeningprogramm jedoch schon) – AI ist dazu derzeit nicht in der Lage.
Für die Anwender*innen dieser Technologien stelle sich des Weiteren auch die Frage, wie sehr sie sich auf ihre eigenen Fähigkeiten verlassen können, wenn es darum geht, ein Ergebnis des Algorithmus als falsch-positiv auszuweisen.
Gleesons Vision für die Zukunft sind Tools, die die Fähigkeiten von Menschen überschreiten: Kann AI beispielsweise lernen, im Rahmen von Screeningprogrammen Risikopatient*innen zu identifizieren, deren Risiko Menschen niemals erkennen könnten?16
Radiotherapie
Wie Jean-Emmanuel Bibault, Hôpital européen Georges-Pompidou Paris, berichtete, finden auch im Bereich der Strahlentherapie verschiedene Entwicklungen statt. Derzeit liege der Fokus vor allem darauf, Techniken zu entwickeln, die verschiedene Arbeitsschritte erleichtern, beschleunigen oder verbessern können. Dies betrifft z.B. die Behandlungsplanung: Mittels automatisierter Tumorsegmentation könnte sowohl Zeit gespart als auch die Genauigkeit verbessert werden. Darüber hinaus wird es innerhalb der nächsten 5 bis 10 Jahre, so schätzte Bibault, so weit fortgeschrittene Techniken zur automatisierten Dosimetrie geben, dass die Segmentation nicht mehr notwendig sein wird und die optimale Strahlendosis direkt anhand einer CT berechnet werden kann. Dies könne die Planungszeit für die Strahlentherapie von Wochen auf Stunden verkürzen.
Bibault blickte jedoch noch weiter in die Zukunft: AI könnte auf dem Gebiet der Radiotherapie schließlich einmal Dinge schaffen, die für Menschen unmöglich sind. Er führte hier als Beispiele Vorhersagemodelle mit einer hohen Zahl von Variablen an, die von Menschen nicht verarbeitet werden können. Diese Modelle könnten hochakkurat das Therapieansprechen vorhersagen und die Therapien noch weiter personalisieren.17
Big Data
Abschließend berichtete Georg Langs, Medizinische Universität Wien, über relevante Einsatzfelder von Big Data. Durch sie werde zum einen die Möglichkeit geschaffen, bedeutsame Faktoren zu identifizieren, die einen Vergleich von Patient*innen erlauben. Z.B. könnte AI durch „Clustering“ großer Datenmengen Patient*innengruppen identifizieren, die neue Hypothesen über die biologisch zugrunde liegenden Mechanismen von Erkrankung, Progression, Therapieansprechen etc. erlauben. Dies wird auch in der Entwicklung neuer Therapien nützlich sein.
Zum anderen könnte die AI-gestützte Analyse großer Datenmengen dazu beitragen, die Ergebnisse verschiedener Untersuchungsmodalitäten wie Bildgebung und genetische Analysen miteinander zu verknüpfen. Dies wird es u.a. ermöglichen, genauere Vorhersagen bzgl. des künftigen Erkrankungsverlaufs konkreter Patient*innen und somit eine bessere Risikoabschätzung zu treffen und die Behandlung zu optimieren.18
Videointerview mit Honorary Chair Univ.-Prof. Dr. Robert Pirker
Im Videointerview teilt Prof. Pirker seine Highlights der diesjährigen World Conference on Lung Cancer und wagt einen Ausblick in die Zukunft. Klicken Sie rein unter: bit.ly/3Tl8gJF
Quelle:
World Conference on Lung Cancer, 6.–9. August, Wien
Literatur:
1 Felip E et al.: Lancet 2021; 398(10308): 1344-57 2 Felip E et al.: WCLC 2022; Abstr. #PL03.09 3 Heymach J: WCLC 2022; Abstr. #PL02.05 4 Dingemans A: WCLC 2022; Abstr. #PL02.03 5 Dingemans A et al.: J Thorac Oncol 2018; 13: S446 6 Guckenberger M: WCLC 2022; Abstr. #PL02.04 7 Guckenberger M et al.: Lancet Oncol 2020; 21(1): e18-e28 8 Lim R: WCLC 2022; Abstr. #PL02.10 9 Antoni D: WCLC 2022; Abstr. #PL02.06 10 McWilliams A: WCLC 2022; Abstr. #ES01.03 11 Robbins H: WCLC 2022; Abstr. #ES01.04 12 Murray R et al.: WCLC 2022; Abstr. #PL03.03 13 Jassem J: WCLC 2022; Abstr. #PL03.04 14 Tanner et al: Am J Respir Crit Care Med 2016; 193: 534-41 15 Hartman D: WCLC 2022; Abstr. #PL04.03 16 Gleeson F: WCLC 2022; Abstr. #PL04.04 17 Bibault, J: WCLC 2022; Abstr. #PL04.05 18 Langs G: WCLC 2022; Abstr. #PL04.06
Das könnte Sie auch interessieren:
Adjuvantes Osimertinib reduziert ZNS-Rezidive bei EGFR-mutierter Erkrankung
Etwa 30% der Patienten mit nicht kleinzelligem Lungenkarzinom (NSCLC) präsentieren sich mit resezierbarer Erkrankung und werden einer kurativen Operation unterzogen. Viele Patienten ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...