.jpg)
Die Therapie des nicht kleinzelligen Lungenkarzinoms
Autoren:
Dr. Martin Kimmich, MScIH1
Dr. David Müller2
Robert-Bosch-Krankenhaus
Klinik Schillerhöhe, Stuttgart
1 Leitender Oberarzt
Facharzt für Innere Medizin, Pneumologie,
Hämatologie/internistische Onkologie und Palliativmedizin
Master of Science in International Health
2 Assistenzarzt für Innere Medizin
Abteilung Molekulare und Pneumologische Onkologie
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Immuntherapie, molekulare Onkologie, neue OP- und Bestrahlungstechniken – die große Dynamik in der Behandlung des Lungenkarzinoms hielt auch im Jahr 2020 an. Imnachfolgenden Artikel finden Sie eine Zusammenfassung der wichtigsten Aspekte.
Prophylaxe und frühe Stadien
Wegen der erfolgreichen Einführung neuer Medikamente bei der Behandlung des Lungenkarzinoms gerät leider die Tatsache etwas aus dem Blick, dass die Bekämpfung des Rauchens die wirksamste und sinnvollste Methode ist, dieser Erkrankung – zumindest in ihrer Erscheinungsform als epidemischer, onkologischer Massenerkrankung – beizukommen. Die Rauchprävalenz in Deutschland und Österreich, verglichen europa- und weltweit, ist weiterhin eher ungünstig und liegt etwa doppelt so hoch wie z.B. in Norwegen oder den USA.1
Die Wirksamkeit eines Low-Dose-Computertomografie(CT)-Screenings von Hochrisikogruppen wurde durch die Veröffentlichung der NELSON-Studie2 weiter untermauert, in der eine Reduktion von Lungenkrebstodesfällen um 24% (Männer) bzw. 33% (Frauen) gezeigt wurde. Die Implementierung entsprechender bevölkerungsbasierter Früherkennungs-Programme ist in mehreren europäischen Ländern in Vorbereitung. So auch in Österreich, wo 2020 eine entsprechende Task Force gegründet wurde.
Die Lobektomie mit systematischer Lymphadenektomie ist weiterhin unangefochtener Goldstandard für resezierbare Frühstadien beim nicht kleinzelligen Lungenkarzinom (NSCLC), wobei die video-assistierte thorakoskopische Resektion (VAT; Uni- bzw. Multiport oder Roboter-unterstützt) in spezialisierten Zentren zum Standardeingriff geworden ist. Im Vergleich zur Thorakotomie zeigen endoskopische Eingriffe vergleichbare Ergebnisse bei tendenziell schnellerer postoperativer Erholung der Patienten.3
Die stereotaktische Radiotherapie ist einer anatomischen Resektion nicht als gleichwertig anzusehen. Sie bietet inoperablen bzw. hochbetagten Patienten mit Erkrankungsfrühstadien jedoch eine gute Alternative zum chirurgischen Eingriff.4
Die adjuvante Chemotherapie mit (Cis-)platinhaltiger Komponente bleibt weiter fester Bestandteil des kurativen Therapiekonzepts im Stadium (IB)-II-III. Mehrere große Studien testen aktuell den adjuvanten Einsatz von Checkpoint-Inhibitoren. Ihre Ergebnisse werden mit Spannung erwartet, zumal frühe Daten auch für diese Indikation einen Wirksamkeitsnachweis erhoffen lassen.
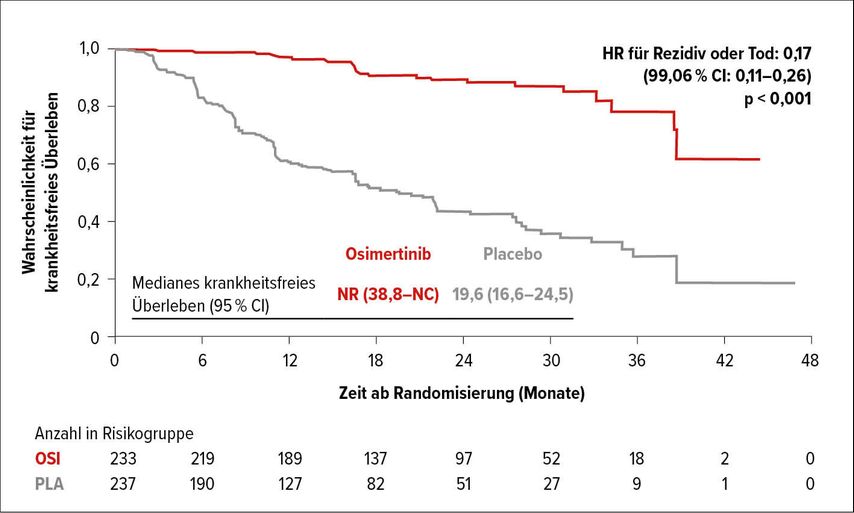
Wie ein Paukenschlag wurde aber die Veröffentlichung der ADAURA-Studie am virtuellen Meeting der American Society of Clinical Oncology (ASCO) 2020 wahrgenommen: Die dreijährige Osimertinib-Nachbehandlung EGFR(„Epidermal growth factor receptor“)-mutierter Lungenkarzinome im Stadium IB–III (nach R0-Resektion und ggf. adjuvanter Chemotherapie) senkte nach 2 Jahren die Wahrscheinlichkeit für Erkrankungsrückfall oder Tod um 80% (Abb. 1).5 Gesamtüberlebensdaten werden allerdings wohl erst ab 2022 zu erwarten sein, sodass im Moment unklar bleibt, ob auf Basis dieser bisherigen Wirksamkeitsdaten eine Zulassung erwirkt werden kann.
Abb. 1: Hazard-Ratio (HR) 0,17 für Erkrankungsrezidiv in der Osimertinib-Gruppe bei Patienten mit Stadium-II-IIIA-EGFR-mutiertem Lungenkarzinom. Modifiziert nach 9
Stadium III, kuratives Therapieziel
Die Frage, ob nach R0-Resektion bei mediastinaler Lymphknotenmetastasierung nur eine adjuvante Chemotherapie oder auch eine mediastinale Strahlentherapie erfolgen sollte, erhielt endlich durch die prospektive, randomisierte LungART-Studie eine gewichtige Antwort:6 Zwar wurden durch Radiotherapie mediastinale Rezidive verhindert (25% vs. 46%). Sie verursachte aber zugleich einen Anstieg der, vor allem kardiopulmonalen, Mortalität (5,3 auf 14,6%), sodass insgesamt kein Prognosevorteil erzielt wurde. Eine postoperative Radiatio nach pN2-R0-Resektion erscheint seither allenfalls noch mit spezieller individueller Begründung gerechtfertigt, aber nicht mehr als Standardverfahren.
Nach jahrelangen, frustranen Versuchen, die optimale Therapiekombination und -sequenz im Stadium III zu finden, hat die PACIFIC-Studie (12 Monate Durvalumab nach simultaner Radiochemotherapie: Verbesserung der Gesamtüberlebensrate nach 4 Jahren von 36,3% auf 49,6%)7 nicht nur den neuen Therapiestandard definiert, sondern auch eine Vielzahl von Studien inspiriert, die sich nun an PACIFIC messen.
Die Rolle der Immuntherapie wird in laufenden Studien zusammen mit Chemotherapie bzw. Chemoradiotherapie auch im neoadjuvanten Setting, vor geplanter Resektion, erprobt – erste Studienergebnisse sind vielversprechend.8 Vorerst bleibt es aber bei der Empfehlung, dass im Stadium III des NSCLC mindestens zwei Behandlungsmethoden (Chemo[immun]therapie plus Radiotherapie und/oder Resektion) konsequent und vollständig kombiniert werden sollen und die Therapie an einem spezialisierten Zentrum geplant und durchgeführt werden sollte.
Inkurable Stadien ohne Treibermutation
Die kombinierte Chemoimmuntherapie ist beim inkurablen NSCLC (Plattenepithel- und Nichtplattenepithel-/Adenokarzinom) ohne Treibermutation zum Therapiestandard geworden – unabhängig vom „Programmed cell death 1 ligand 1“(PD-L1)-Status. Für Patienten mit hohem PD-L1-Expressionsstatus (>50%) stellt die Monoimmuntherapie allerdings die weniger toxische und leitliniengerechte Therapiealternative dar. Die zusätzliche Chemotherapie bietet für diese Patienten eine höhere Ansprechrate, aber keine bessere Langzeitperspektive. Bei hochsymptomatischer Erkrankung bzw. zerebraler Metastasierung erscheint die Kombinationstherapie jedoch auch bei PD-L1 >50% empfehlenswert. Die zugelassenen Chemoimmuntherapien (ggf. mit Antiangiogenesehemmer) sind nach bisheriger Datenlage in etwa äquipotent, sodass die Auswahl nach individueller Indikation/Präferenz und unter Beachtung des Zulassungstextes getroffen werden kann.
Checkpoint-Inhibitoren sind bislang in Europa nur bei hoher Expression von PD-L1 als Monotherapie in der Erstlinienbehandlung zugelassen (anders als in den USA) bzw. nur zusammen mit Kombinationschemotherapie. Somit klafft eine bedauernswerte Lücke bei der Erstlinientherapie von Patienten in fragilem Allgemeinzustand und geringer/mittelhoher PD-L1-Expression, für die der frühe Einsatz einer Immuntherapie wünschenswert erschiene. In der Praxis wird der Einsatz eines Checkpoint-Inhibitors in der Erstlinie bei Kontraindikation gegen eine Chemotherapie bzw. in Kombination mit Monochemotherapie „off label“, aber durchaus angewandt – mit allen damit verbundenen Unsicherheiten. Es bleibt zu hoffen, dass diesem Zustand durch entsprechende Studiendaten für diese große Patientengruppe bald Abhilfe geschaffen wird.
Zur Zweit- bzw. Mehrlinientherapie gab es im vergangenen Jahr keine grundsätzlichen Neuerungen. Wichtig erscheint die richtige Balance zwischen aktiver Therapie und palliativer Symptomlinderung. Dies erfordert Erfahrung und Zeit für die Kommunikation mit Patienten und Angehörigen. Standardisiertes Assessment kann helfen, Therapieentscheidungen zu objektivieren und überhöhte therapeutische Ambitionen zu korrigieren.9
Patienten mit wenigen Fernmetastasen (≤5 Fernmetastasen)10 haben sich als prognostisch günstigere Gruppe erwiesen, bei der – Therapiewunsch und -fähigkeit vorausgesetzt – eine Lokaltherapie von Primarius und Metastasen (Radiatio, Resektion) in Erwägung gezogen werden sollte.11
Der therapeutische Fortschritt beim großzelligen neuroendokrinen Lungenkarzinom (LCNEC) krankt nicht nur an der Aggressivität, sondern auch an der relativen Seltenheit dieser Entität. Es fehlen umfangreichere Studiendaten, speziell zum Einsatz von Checkpoint-Inhibitoren. Bei der medikamentösen Behandlung fortgeschrittener Stadien orientiert man sich an den Standards des kleinzelligen Lungenkarzinoms.12
Zielgerichtete Therapie beiinkurabler Erkrankung
Der explosive Erkenntniszuwachs und die Therapiemöglichkeiten im Bereich der molekularen Onkologie machen die molekulargenetische Diagnostik beim Lungenkarzinom zum erforderlichen Standard: möglichst mittels NGS(„Next generation sequencing“)-basierter Multiplextestung im zertifizierten Labor und, sofern finanzierbar, automatisch bei Diagnosestellung eines Nichtplattenepithelkarzinoms bzw. eines Nichtraucher-Lungenkarzinoms (dann Histologie-unabhängig).
EGFR-Mutation
Mit Veröffentlichung eines Überlebensvorteils durch Osimertinib gegenüber Erlotinib/Gefitinib in der Erstlinientherapie ist Osimertinib zum derzeit präferierten Erstlinienstandard geworden bei Exon 19del und Exon 21 L858R.13 Der Erstlinieneinsatz von Afatinib oder Dacomitinib mit der Möglichkeit eines späteren sequenziellen Einsatzes von Osimertinib bleibt aber gerechtfertigt. Eine Abwägung der verschiedenen Ansätze würde den Rahmen dieses Artikels jedoch sprengen.
Mutation der anaplastischen Lymphomkinase (ALK)
Die Substanzen der zweiten Generation, Alectinib und Brigatinib, haben sich wegen ihrer besseren intrazerebralen Wirksamkeit und der längeren Remissionszeit im Vergleich zu Crizotinib im primären Einsatz etabliert.14,15 Für die Folgetherapie wurde das Behandlungsarsenal durch die Zulassung von Lorlatinib bereichert.16
KRAS-Mutation
Große Erwartungen werden in die erste, aktuell in einer Phase-III-Studie geprüfte, Substanz zur Therapie bei KRAS-G12C-Mutation gesetzt (Sotorasib) – handelt es sich bei KRAS doch um die häufigste Mutation beim NSCLC, die gleichwohl bislang einer zielgerichteten Therapie unzugänglich war.17
Andere Mutationen
Für die selteneren, jedoch behandelbaren Mutationen steht eine Vielzahl von teils in anderen Indikation bereits etablierten, teils vor der Erstzulassung stehenden Substanzen zur Verfügung:
-
BRAF V600E (Dabrafenib/Trametinib),
-
ROS1 (Ceritinib, Entrectinib),
-
RET (Selpercatinib [Abb. 2], Pralsetinib),
-
neurotrophe Tyrosin-Rezeptor-Kinase (NTRK; Entrectinib, Larotrectinib),
-
MET (Capmatinib, Crizotinib, Tepotinib, Savolitinib, bispezifische Antikörper),
-
„human epidermal growth factor receptor 2“ (HER2) und
EGFR Exon 20 Insertion (Poziotinib, Mobocertinib, Trastuzumab-Wirkstoff-Konjugate) – die Aufzählung ist ohne jeden Anspruch auf Vollständigkeit.
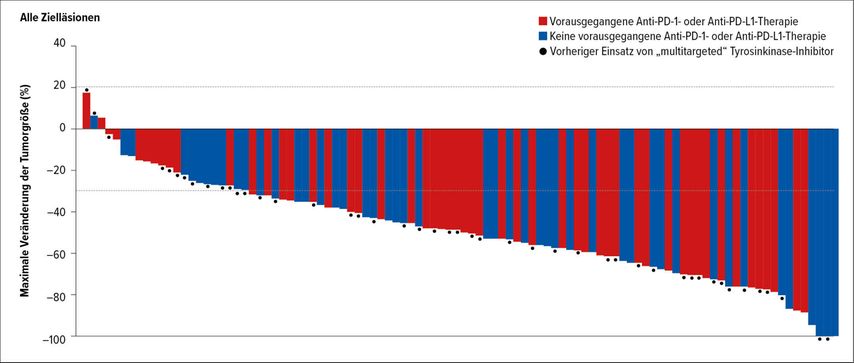
Abb. 2: Neue Substanzen bei seltenen Treibermutationen: Tumoransprechen auf Selpercatinib bei RET-Mutation. Objektives Ansprechen: 68%, mediane Dauer des Ansprechens: 17,5 Monate. Modifiziert nach 19
Da es sich nur um sehr geringe Patientenzahlen handelt und die Substanzen ein sehr vielfältiges Nebenwirkungsspektrum besitzen bzw. substanzspezifische Sicherheitsaspekte berücksichtigt werden sollten, ist es ratsam, solche Behandlungen nur innerhalb eines Therapienetzwerkes bzw. in Zusammenarbeit mit einem größeren Lungenkrebszentrum durchzuführen.
Weitgehend unabhängig vom Mutationstyp sollte bei Progression unter einem Tyrosinkinase-Inhibitor eine molekulare Rediagnostik angestrebt werden. Das weitere Vorgehen wird vom Progressionsmuster (langsam/schnell, symptomatisch/asymptomatisch, lokal/multifokal) bzw. von Histologie und Resistenzmechanismus abhängig gemacht – ein molekulares Tumorboard sollte zur Entscheidungsfindung zur Verfügung stehen.18
Literatur:
1 Neuberger M: memo 2019; 12(2): 156-61 2 de Koning HJ et al.: N Engl J Med 2020; 382(6): 503-13 3 Ng CSH et al.: Innovations (Phila) 2019; 14(2): 90-116 4 Hamaji M et al.: JThorac Dis 2019; 11(Suppl 13): S1646-52 5 Wu YL et al.: NEngl J Med 2020; 383 (18): 1711-23 6 Le Pechoux C et al.: Ann Oncol 2020; 31(Suppl_4): S1142-215 7 Faivre-Finn C et al.: Ann Oncol 2020; 31(Suppl_4): S1142-215 8 Provencio M et al.: Lancet Oncol 2020; 21(11): 1413-22 9 Schulkes KJG et al.: Clin Lung Cancer 2016; 17(5): 341-9.e3 10 Dingemans AMC et al.: J Thorac Oncol 2019; 14(12): 2109-19 11 Gomez DR et al.: J Clin Oncol 2019; 37(18): 1558-65 12 Glisson BS: UpToDate 2020. Online unter: https://www.uptodate.com/contents/88587/print . Zuletzt aktualisiert Dezember2020, zuletzt geprüft am 3.1.2021 13 Ramalingam SS: N Engl J Med 2020; 382(1): 41-50 14 Camidge DR et al.: N Engl J Med 2018; 379(21): 2027-39 15 Peters S et al.: N Engl J Med 2017; 377(9): 829-38 16 Baldacci S et al.: In: Ann Oncol 2020; 31(Suppl_4): S754-840 17 Hong DS et al.: N Engl J Med 2020; 383(13): 1207-17 18 Piper-Vallillo AJ et al.: J Clin Oncol 2020; JCO1903123 19 Drilon A et al.: N Engl J Med 2020; 383(9): 813-24
Das könnte Sie auch interessieren:
Adjuvantes Osimertinib reduziert ZNS-Rezidive bei EGFR-mutierter Erkrankung
Etwa 30% der Patienten mit nicht kleinzelligem Lungenkarzinom (NSCLC) präsentieren sich mit resezierbarer Erkrankung und werden einer kurativen Operation unterzogen. Viele Patienten ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...