Mammakarzinom: Die Kunst der Therapieselektion
Bericht: Dr. Ine Schmale
Das Mammakarzinom kann durch molekulare Gruppierungen und personalisierte Therapien hocheffektiv behandelt werden. Viele verfügbare Therapieoptionen machen die Behandlung aber auch sehr komplex. Beim San Antonio Breast Cancer Symposium (SABCS) wurden Hinweise auf eine weitere Optimierung der Brustkrebstherapie mithilfe von explorativen und Subgruppen-Analysen gegeben.
Adjuvante Erhaltungstherapie mit PARP-Inhibitor
Um das therapiefreie Intervall nach (neo)adjuvanter Therapie zu verlängern, erhielten in der randomisierten, doppelblinden, placebokontrollierten Phase-III-Studie OlympiA 1836 Patientinnen mit einer BRCA1/2-Keimbahnmutation den PARP-Inhibitor Olaparib für die Dauer von einem Jahr. In einer Zwischenanalyse mit einer Nachbeobachtungszeit von median 2,5 Jahren wurde ein signifikanter Vorteil bezüglich des Überlebens frei von invasiver Erkrankung (iDFS) mit der zusätzlichen Erhaltungstherapie beobachtet. Beim SABCS wurden nun Ergebnisse zur Lebensqualität präsentiert, die u.a. untersuchten, ob unter Olaparib häufiger Fatigue zu beobachten war.1
Die Patientinnen waren im Median 43/44 Jahre alt, wiesen in 84% tripelnegativen Brustkrebs (TNBC) auf und waren jeweils zur Hälfte neoadjuvant bzw. adjuvant behandelt worden. Bei einem Drittel der Patientinnen wurde eine brusterhaltende Operation und bei zwei Dritteln eine Mastektomie durchgeführt. 28% der Patientinnen hatte eine platinhaltige Therapie erhalten, etwa 95% Anthrazykline und Taxane und 70% eine Radiatio.
Der Score auf der „Functional Assessment of Chronic Illness Therapy – Fatigue Scale“ (FACIT-Fatigue) lag bei Therapiebeginn bei etwa 40. Damit handelte es sich um einen schlechteren Ausgangswert als im Durchschnitt bei gesunden Frauen, wo er bei 43 liegt. Unter Behandlung mit Olaparib über 6 bzw. 12 Monate wurde eine signifikante Differenz von –1,3 bis –1,5 Punkten gegenüber Placebo beobachtet. Ein klinisch relevanter Wert von 3 Punkten Differenz wurde nicht erreicht. Nach 18 und 24 Monaten wurde kein Unterschied zwischen den Studienarmen im FACIT-Fatigue-Score gesehen.
Insgesamt wurden Beeinflussungen der Lebensqualität durch Olaparib entsprechend dem Nebenwirkungsprofil nach 6 und 12 Monaten gesehen, aber kein Unterschied zum Kontrollarm nach 18 und 24 Monaten. Die Studienautoren schlussfolgerten, dass ein Jahr Olaparib-Gabe die Erholung von einer (neo)adjuvanten Standardtherapie nicht relevant beeinflusst.
Adjuvante Therapie mit CDK4/6-Inhibitor
Die Behandlung von hormonrezep-torpositivem (HR+), HER2-negativem (HER2–) Brustkrebs mit einer Kombination aus CDK4/6-Inhibitor und endokriner Therapie hat sich für die metastasierte Situation etabliert. Verschiedene Studien untersuchen CDK4/6-Inhibitoren nun auch beim frühen Brustkrebs, so etwa die Phase-III-Studie PALLAS.2 In der offenen Studie erhielten 5761 Patientinnen mit Brustkrebs im Stadium II–III eine endokrine Therapie mit einem Aromataseinhibitor oder Tamoxifen (mit oder ohne LHRH-Agonist) für mindestens 5 Jahre sowie im experimentellen Studienarm Palbociclib für die Dauer von 2 Jahren. Der primäre Studienendpunkt war das iDFS, entsprechend den STEEP-Kriterien. Beim SABCS wurden die geplanten finalen Ergebnisse präsentiert, die Nachbeobachtung wird für weitere translationale Forschung fortgeführt.
Die Patientinnen waren im Median 52 Jahre alt und hatten in 59% der Fälle klinisch ein hohes Risiko für einen Krankheitsprogress. Die Palbociclib-Therapie brachen 44,9% der Patientinnen innerhalb von 2 Jahren frühzeitig ab: 17,9% innerhalb der ersten 6 Monate, 30,2% innerhalb von 12 Monaten und 38,3% innerhalb von 18 Monaten.
Mit der finalen Analyse wurde bestätigt, dass eine längere Palbociclib-Gabe oder eine Dosisintensität >70% das iDFS nicht relevant beeinflusste.
Mit einer medianen Nachbeobachtungszeit von 31 Monaten wurde kein Unterschied bezüglich des iDFS zwischen den Studienarmen beobachtet. Das 4-Jahres-iDFS betrug 84,2% mit und 84,5% ohne Palbociclib (HR: 0,96; 95% CI: 0,81–1,14; p=0,65). Subgruppenanalysen identifizierten keine Subgruppe, die von der zusätzlichen Palbociclib-Gabe profitieren könnte. Auch für sekundäre Endpunkte lag kein Unterschied vor.
Ribociclib plus Letrozol beim fortgeschrittenen Mammakarzinom
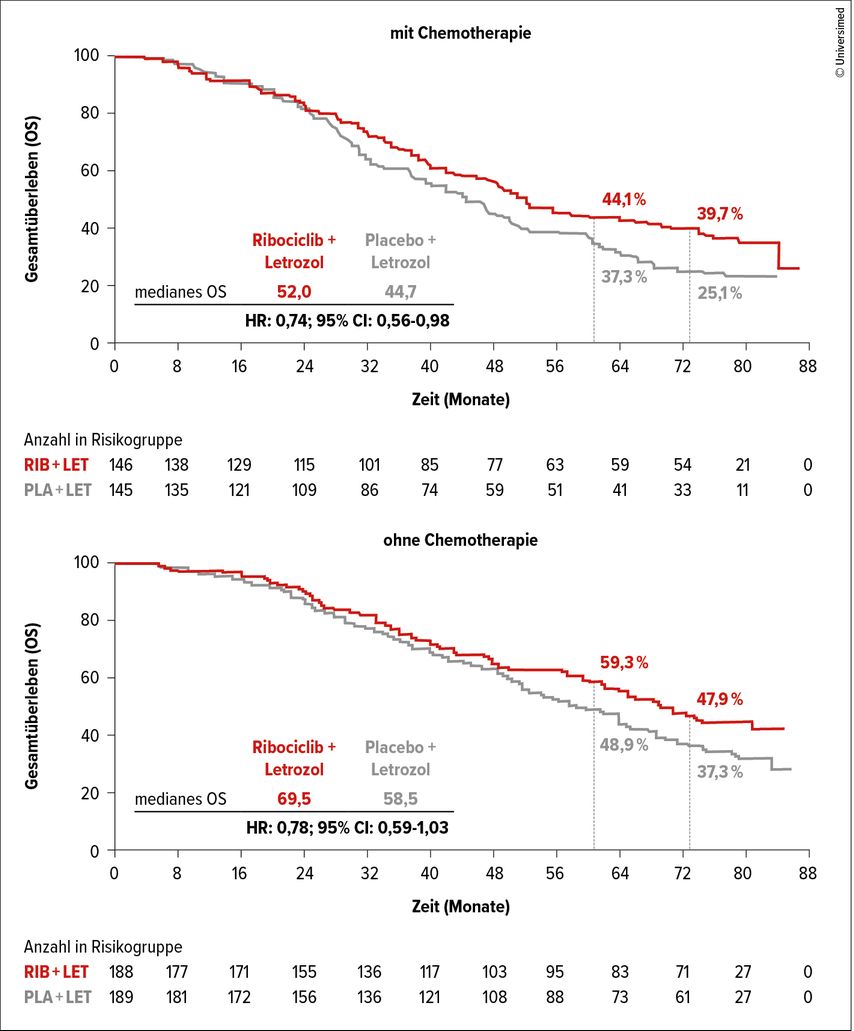
Die Kombination von Ribociclib plus Letrozol als Erstlinienoption zeigte für postmenopausale Patientinnen mit fortgeschrittenem HR+/HER2– Brustkrebs in der Phase-III-Studie MONALEESA-2 einen Überlebensvorteil gegenüber Placebo plus Letrozol (HR: 0,76; 95% CI: 0,63–0,93; p=0,004). Beim SABCS wurden Subgruppenanalysen in Bezug auf die Metastasenlokalisation, die Anzahl an Metastasenlokalisationen und die vorangegangene Therapie präsentiert.3
In der ITT-Population betrug die Gesamtüberlebens(OS)-Rate 52,3% vs. 43,9% nach 5 Jahren sowie 44,2% vs. 32,0% nach 6 Jahren. Im Median lebten die Patientinnen 63,9 vs. 51,4 Monate.
Konsistent mit diesen Ergebnissen betrug das mediane OS für Patientinnen mit alleiniger Knochenmetastasierung 72,6 vs. 56,4 Monate. Nach 5 und 6 Jahren lebten 58,6% vs. 47,1% bzw. 50,2% vs. 33,8% der Patientinnen. Bei Lebermetastasierung war die Prognose der Patientinnen insgesamt schlechter (medianes OS 37,7 vs. 38,1 Monate), aber die 5- und 6-Jahres-OS-Raten mit 37,2% vs. 28,4% bzw. 31,0% vs. 18,9% waren vorteilhafter unter Ribociclib-haltiger Therapie. Die Anzahl der Metastasenlokalisationen (<3 oder ≥3), eine vorangegangene (neo)adjuvante Chemotherapie (Abb. 1) oder eine vorangegangene endokrine Therapie beeinflussten den OS-Vorteil durch Ribociclib ebenfalls nicht und waren konsistent mit den Ergebnissen der ITT-Population.
Abb. 1: Gesamtüberleben unter Ribociclib plus Letrozol versus Placebo plus Letrozol bei Patientinnen mit oder ohne vorangegangene Chemotherapie3
HDAC-Inhibitor bei fortgeschrittenem HR+ Brustkrebs
Entinostat ist ein selektiver Histon-Deacetylase-Inhibitor (HDACi), mit dem eine Resensibilisierung von Tumorzellen gegenüber einer endokrinen Therapie bewirkt werden soll. In einer chinesischen Studie wurde Entinostat in Kombination mit Exemestan 2:1 randomisiert gegen Placebo plus Exemestan geprüft.4 Eingeschlossen waren insgesamt 354 Patientinnen mit fortgeschrittenem HR+, HER2– Brustkrebs, die unter einer vorangegangenen endokrinen Therapie progredient waren. Primärer Studienendpunkt war das progressionsfreie Überleben (PFS).
Der primäre Endpunkt wurde erreicht: Die Patientinnen lebten median 6,32 vs. 7,72 Monate ohne Progress (HR: 0,74; 95% CI: 0,58–0,96; p=0,021). Innerhalb der Per-Protokoll-Population betrug das mediane PFS 7,34 vs. 3,72 Monate (HR: 0,70; 95% CI: 0,53–0,91; p=0,009).
Bezüglich des OS war der Median in beiden Studienarmen noch nicht erreicht und es wurde kein signifikanter Unterschied festgestellt (HR: 0,75; 95% CI 0,49–1,15). Es sprachen 15,7% vs. 10,1% der Patientinnen auf die Therapie an (p=0,192), die Rate an klinischem Benefit (komplettes Ansprechen [CR], partielles Ansprechen [PR], stabile Erkrankung [SD] ≥6 Monate) betrug 37,4% vs. 32,8% (p=0,413) und die Krankheitskontrollrate (CR, PR, SD) 70,2% vs. 55,5%.
Es traten häufiger Nebenwirkungen (99,1% vs. 88,2%) und therapieassoziierte Nebenwirkungen (95,7% vs. 69,7%) im Entinostat-Arm auf. Am häufigsten traten hämatologische Nebenwirkungen auf, mit Grad-3–4-Toxitäten in Form von Neutropenien bei 43,8% vs. 0,8% der Patienten, Leukopenien bei 70,2% vs. 0%, Thrombozytopenien bei 8,5% vs. 0,8% und Anämien bei 3,4% vs. 1,7% der Patientinnen.
Optimaler Cut-off für Pembrolizumab bei TNBC
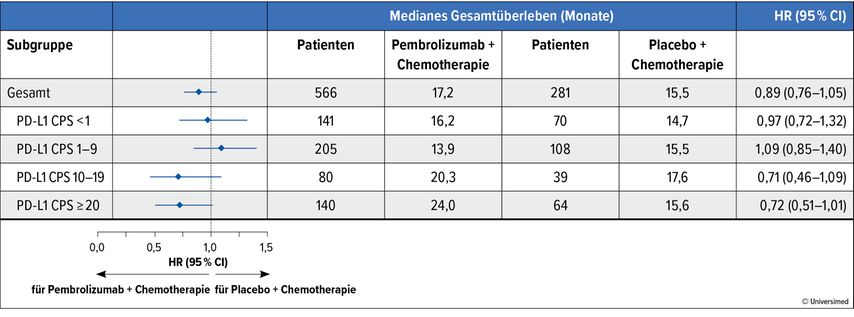
Die zusätzliche Gabe von Pembrolizumab zu einer Erstlinien-Chemotherapie führte in der Phase-III-Studie KEYNOTE-355 zu einer signifikanten und klinisch relevanten Verlängerung des PFS und des OS bei Patientinnen mit metastasiertem tripelnegativem Brustkrebs (TNBC) und einer PD-L1-Expression CPS („combined positive score“) ≥10. Eine beim SABCS präsentierte Auswertung analysierte weitere Subgruppen mit anderen CPS-Cut-offs.5
Die KEYNOTE-355-Studie randomisierte insgesamt 847 Patientinnen mit gutem oder sehr gutem Allgemeinzustand (ECOG PS 0–1) im Verhältnis 2:1 zu einer Therapie mit Pembrolizumab plus Chemotherapie vs. Placebo plus Chemotherapie. Etwa 25% der Patientinnen wiesen einen CPS <1 auf, etwa 37% einen CPS 1–9, 14% einen CPS 10–19 und etwa 24% einen CPS ≥20. Weitere Patientencharakteristika bei Therapiebeginn waren ein medianes Alter von 53 Jahren, ein guter Allgemeinzustand (ECOG PS 1) bei etwa 40% der Patientinnen und eine de novo metastasierte Erkrankung bei 30%.
Das krankheitsfreie Intervall bei Patientinnen mit adjuvanter Therapie betrug <12 Monate bei etwa 21% der Fälle und ≥12 Monate bei etwa der Hälfte der Patientinnen. Als Chemotherapie im Rahmen der Studie erhielten 45% der Patientinnen ein Taxan und 55% Gemcitabin plus Carboplatin. Die finale OS-Analyse zeigte ein signifikant verbessertes Ergebnis bei einem PD-L1 CPS ≥10, nicht aber bei PD-L1 CPS ≥1 oder der ITT-Population.
Mit der Subgruppenanalyse wurde für Patienten mit PD-L1 CPS <1 und PD-L1 CPS 1–9 kein signifikantes Ergebnis (HR: 0,89 und 0,97), wohl aber ein relevanter numerischer Vorteil bei PD-L1 CPS 10–19 (HR: 0,71; 95% CI: 0,46–1,09) und PD-L1 CPS ≥20 (HR: 0,72; 95% CI 0,51–1,01) beobachtet (Abb. 2).
Abb. 2: Subgruppenanalyse für das Gesamtüberleben (OS) unter Chemotherapie sowie Pembrolizumab versus Placebo in Abhängigkeit von der PD-L1-Expression5
Bezüglich des PFS konnte in der finalen Analyse für die drei untersuchten Populationen, CPS ≥10, CPS ≥1 und ITT, ein signifikanter Nutzen von Pembrolizumab identifiziert werden. Ein signifikantes Ergebnis erreichten in den detaillierter aufgeteilten Subgruppen nur Patientinnen mit einem PD-L1 CPS ≥20 (HR: 0,62; 95% CI: 0,44–0,88). Patientinnen mit CPS 10–19 zeigten einen relevanten numerischen Vorteil (HR: 0,70; 95% CI 0,44–1,09) und Patientinnen mit CPS <1 oder 1–9 keinen relevanten Nutzen von Pembrolizumab (HR: 0,85 und 1,09).
Diese Subgruppenergebnisse bestätigen CPS ≥10 als sinnvollen Cut-off, um Patientinnen mit metastasiertem TNBC zu identifizieren, die wahrscheinlich von einer Erstlinientherapie mit Pembrolizumab plus Chemotherapie profitieren. Pembrolizumab plus Chemotherapie sollte für diese Patientinnen der Therapiestandard sein.
Neratinib-Kombinationen bei metastasiertem Brustkrebs
Der irreversible pan-HER-Tyrosinkinase-Inhibitor Neratinib wurde in der Basket-Studie SUMMIT u.a. beim HER2-mutierten, metastasierten Mammakarzinom untersucht.6 Ein Studienarm schloss die Kohorte der HR+/HER2– Patientinnen mit vorhergegangener CDK4/6-Inhibitor-Therapie ein, die nicht randomisiert Neratinib plus Fulvestrant plus Trastuzumab N+F+T erhielten (n=26).
Ein zweiter Studienarm derselben Patientinnenkohorte erhielt 1:1:1 randomisiert N+F+T (n=7) oder Fulvestrant plus Trastuzumab (F+T; n=7) oder Fulvestrant (F; n=7). Bei Tumorprogress wurden die Patientinnen der Neratinib-freien Studienarme ebenfalls mit N+F+T weiterbehandelt. In dem Studienarm zu Neratinib bei tripelnegativen Tumoren (HER2-mutiert) erhielten Patientinnen Neratinib plus Trastuzumab (N+T).
Insgesamt handelte es sich bei den Patientinnen der HR+/HER2–-Kohorte um intensiv vorbehandelte Patientinnen mit median 5 (N+F+T) bzw. 3 (F+T, F) vorangegangenen Therapielinien im lokal fortgeschrittenen oder metastasierten Stadium. Alle Patientinnen hatten bereits eine endokrine Therapie erhalten sowie 81,8%, 57,1% bzw. 71,4% eine Chemotherapie. Es sprachen 46,2% der Patientinnen im nicht randomisierten Arm auf die Therapie an. Die mediane Dauer des Ansprechens betrug 14,4 Monate, das mediane PFS 8,2 Monate.
Im randomisierten Studienarm bestätigte sich der effektive Einfluss von Neratinib: Während 2 der Patientinnen (28,6%) auf N+F+T ansprachen, wurde in den Neratinib-freien Studienarmen kein Ansprechen beobachtet. Das mediane PFS betrug 6,2 Monate (N+F+T), 3,9 Monate (F+T) und 4,1 Monate (F). In den kombinierten Armen lag das Ansprechen bei 42,4% für Patienten in den Neratinib-haltigen vs. 28,6% in den Neratinib-freien Studienarmen und das mediane PFS 7,0 vs. 2,9 Monate. Im Median dauerte die Therapie 6,5 vs. 3,7 Monate an. Die häufigste Nebenwirkung unter N+F+T war Diarrhö (alle Grade: 90,9%; Grad 3–4: 45,5%).
Patientinnen mit tripelnegativen Tumoren hatten im Median 3,5 Therapielinien erhalten. 6 der 18 Patientinnen (33,3%) sprachen auf N+T an. Das mediane PFS betrug für diese Patientinnen 6,2 Monate, die mediane Dauer der Therapie 4,4 Monate. In dieser Kohorte wurde Diarrhö aller Grade bei 88,9% und von Grad 3–4 bei 16,7% der Patientinnen berichtet.
Subgruppenanalysen der Phase-III-Studie DESTINY-Breast03
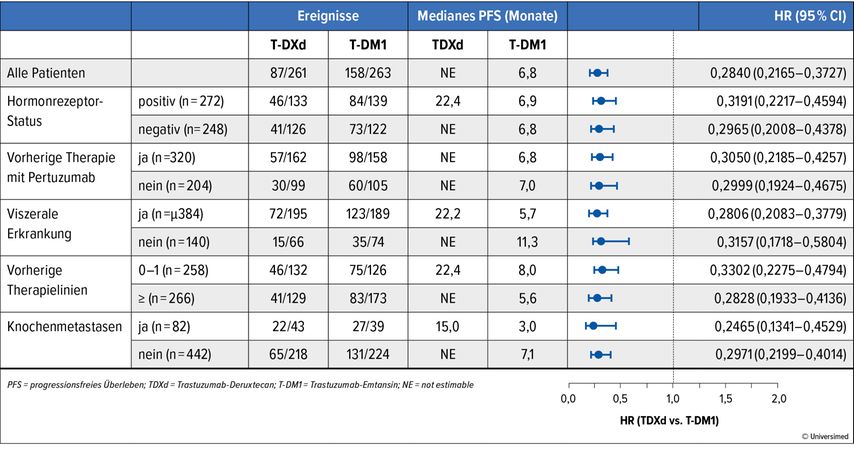
In der DESTINY-Breast03-Studie wurden die HER2-gerichteten Antikörper-Wirkstoffkonjugate Trastuzumab-Deruxtecan (T-DXd; 5,4mg/kg, q3w) und Trastuzumab-Emtansin (T-DM1; 3,6mg/kg, q3w) miteinander verglichen. Eingeschlossen waren 524 Patientinnen mit nicht resektablem oder metastasiertem HER2-positivem Brustkrebs, die bereits mit Trastuzumab und einem Taxan behandelt worden waren. Die Patientinnen durften laut Einschlusskriterien klinisch stabile, behandelte Hirnmetastasen aufweisen, wenn mindestens 2 Wochen zwischen dem Abschluss der Ganzhirnbestrahlung und dem Studieneinschluss lagen. Beim SABCS 2021 wurden Subgruppenanalysen der DESTINY-Breast03-Studie präsentiert, wobei ein besonderer Fokus auf die Hirnmetastasierung gelegt wurde.7
Von den Patientinnen im T-DXd-Arm lagen Hirnmetastasen bei 16,5% zu Studienbeginn vor und bei 23,8% waren im Verlauf der Erkrankung Hirnmetastasen aufgetreten. Im T-DM1-Arm traf dies auf 14,8% und 19,8% der Patientinnen zu. In der Analyse des primären Endpunkts wurde mit einer medianen Nachbeobachtungszeit von 15,9 Monaten eine Reduktion des Risikos für Krankheitsprogress oder Tod von 72% gesehen (HR: 0,28; 95% CI: 0,22–0,37; <0,0001). Die 12-Monats-PFS-Rate betrug 75,8% vs. 34,1%. Der Median war im T-DXd-Arm noch nicht erreicht und betrug 6,8 Monate unter T-DM1. Der hochsignifikante Unterschied zeigte sich für alle untersuchten Subgruppen (Abb. 3).
Patientinnen mit Hirnmetastasen erreichten ein medianes PFS von 15,0 Monaten unter T-DXd vs. 3,0 Monate unter T-DM1 (HR: 0,25; 95% CI 0,31–0,45). Nach 12 Monaten lebten 72% vs. 20,9% der Patientinnen mit Hirnmetastasen ohne Progress. Ein Ansprechen zeigten 67,4% der Patientinnen unter T-DXd vs. 20,5% unter T-DM1. Ein komplettes Ansprechen erreichten 4,7% vs. 0% der Patientinnen. Die Krankheitskontrollrate (CR+PR+SD) betrug 93,0% vs. 76,9%. Das Ansprechen dauerte im Median 12,9 vs. 7,2 Monate an. Eine intrakranielle CR erreichten 27,8% der Patientinnen unter T-DXd vs. 2,8% unter T-DM1, ein intrakranielles PR 36,1% vs. 30,6%.
Eine der unterschiedlichen Therapiedauer von median 14,3 vs. 6,9 Monate angepasste Sicherheitsanalyse zeigte, dass bei insgesamt vergleichbarer Rate an therapieassoziierten Nebenwirkungen die Expositions-angepasste Inzidenz pro Patientenjahr unter T-DXd geringer war als unter T-DM1 (alle Grade: 0,87 vs. 1,43; Grad ≥3: 0,46 vs. 0,72; klinisch relevant: 0,17 vs. 0,27). Therapieabbrüche und Dosisreduktionen aufgrund von therapieassoziierten Nebenwirkungen wurden insgesamt häufiger im T-DXd-Arm berichtet, waren aber bei Anpassung an die Expositionsdauer in beiden Studienarmen vergleichbar (0,12 vs. 0,11 bzw. 0,19 vs. 0,19).
Quelle:
San Antonio Breast Cancer Symposium, 7.–10. Dezember 2021, San Antonio
Literatur:
1 Ganz P et al.: Quality of life results from OlympiA: Aphase III, multicenter, randomized, placebo-controlled trial of adjuvant olaparib after (neo)-adjuvant chemotherapy in patients with germline BRCA1/2 mutations and high-risk HER2- early breast cancer. SABCS 2021, Abstr. #GS4-09 2 Gnant M et al.: Adjuvant palbociclib in HR+/HER2- early breast cancer: Final results from 5,760 patients in the randomized phase III PALLAS trial. SABCS 2021, Abstr. #GS1-07 3 O´Shaughnessy et al. Overall survival subgroup analysis by metastatic site from the phase 3 MONALEESA-2 study of first-line ribociclib + letrozole in postmenopausal patients with advanced HR+/HER2- breast cancer. SABCS 2021, Abstr. #GS1-02 4 Xu B et al.: Arandomized control phase III trial of entinostat, a once weekly, class I selective histone deacetylase inhibitor, in combination with exemestane in patients with hormone receptor positive advanced breast cancer. SABCS 2021, Abstr. #GS1-06 5 Cortés J et al.: Efficacy of pembrolizumab + chemotherapy vs placebo + chemotherapy by PD-L1 combined positive score 1-9, 10-19, and ≥20 for previously untreated locally recurrent inoperable or metastatic triple-negative breast cancer: KEYNOTE-355 subgroup analysis. SABCS 2021, Abstr. #GS1-03 6 Jhaveri K et al.: Neratinib + fulvestrant + trastuzumab for HR+, HER2-mutant metastatic breast cancer and neratinib + trastuzumab for triple-negative disease: Latest updates from the SUMMIT trial. SABCS 2021, Abstr. #GS4-10 7 Hurvitz S et al.: Trastuzumab deruxtecan (T-DXd; DS-8201a) vs. trastuzumab emtansine (T-DM1) in patients with HER2+ metastatic breast cancer: subgroup analyses from the randomized phase 3 study DESTINY-Breast03. SABCS 2021, Abstr. #GS3-01
Das könnte Sie auch interessieren:
Adjuvantes Osimertinib reduziert ZNS-Rezidive bei EGFR-mutierter Erkrankung
Etwa 30% der Patienten mit nicht kleinzelligem Lungenkarzinom (NSCLC) präsentieren sich mit resezierbarer Erkrankung und werden einer kurativen Operation unterzogen. Viele Patienten ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...