.jpg)
Die Chirurgie des lymphknotenpositiven Prostatakarzinoms
Autoren:
Dr. Jonas Ekrutt1
Prof. Dr. Markus Graefen1
Prof. Dr. Tobias Maurer1, 2
1 Martini-Klinik Prostate Cancer Center
Universitätsklinikum Hamburg-Eppendorf
2 Klinik für Urologie,
Universitätsklinikum Hamburg-Eppendorf
Korrespondenz:
E-Mail: j.ekrutt@uke.de
Auf Basis moderner, molekularer bildgebender Verfahren (PSMA-PET/CT) ist eine zunehmend zielgerichtetere chirurgische Therapie des lymphknotenpositiven Prostatakarzinoms möglich. Hierdurch könnte inZukunft eine neue Form der Präzisionschirurgie etabliert werden.
Keypoints
-
Analog zur Strahlentherapie scheint die radikale Prostatektomie in Kombination mit einer antihormonellen Therapie bei oligometastasierten Patienten und insbesondere bei Vorliegen einer rein pelvinen lymphogenen Metastasierung einen positiven Effekt auf das Gesamtüberleben zu haben.
-
PSMA-PET weist im Vergleich zur CT eine erhöhte Spezifität und eine signifikant erhöhte Sensitivität für die Detektion von Lymphknotenmetastasen auf. Daher kann die PSMA-PET leitliniengerecht in der Rezidivdiagnostik eingesetzt werden. Eine Anpassung der Leitlinien hinsichtlich des Einsatzes in der Primärdiagnostik ist zu erwarten.
-
Im Rahmen der PSMA-PET-basierten Salvage-Lymphadenektomie können betroffene Lymphknoten präoperativ radioaktiv markiert und intraoperativ mithilfe einer Gammasonde genau identifiziert werden („PSMA-radioguided surgery“).
Neben der Strahlentherapie stellt die Chirurgie eine weitere Therapieoption zur Behandlung des lokal fortgeschrittenen Prostatakarzinoms dar.1,2 Hierzu zählt neben einer Ausbreitung des Tumors in die Samenblasen (cT3b) oder die Prostatakapsel (cT3a) auch eine Streuung in die lokoregionären Lymphknoten (cN+).
Leitlinienempfehlung ist in diesen Fällen, dass im Rahmen einer Operation eine ausgedehnte Lymphadenektomie angeboten1 beziehungsweise durchgeführt werden sollte.2
Dass insbesondere Patienten mit klinischem Verdacht auf eine Lymphknotenbeteiligung bei Diagnosestellung von einer lokalen Therapie (Strahlentherapie oder Prostatektomie) in Kombination mit einer antihormonellen Therapie (ADT) profitieren könnten, konnten Seisen et al. in einer retrospektiven Analyse der amerikanischen National Cancer Database (2003–2011) zeigen.3 In ihrer Studie konnte ein längeres gesamtmortalitätsfreies Überleben bei Durchführung einer lokalen Therapie in Kombination mit einer ADT im Vergleich zur alleinigen ADT bei Patienten mit klinischem Verdacht auf Lymphknotenmetastasen im kleinen Becken beobachtet werden. Diese Beobachtung wird durch ein systematisches Review von Ventimiglia et al. gestützt.4 In dieser Arbeit zeigte sich ein Vorteil sowohl im Gesamt- als auch im krebsspezifischen Überleben für eine lokale Therapie (Strahlentherapie oder radikale Prostatektomie) in Kombination mit einer ADT im Vergleich zur alleinigen ADT.
Im Falle einer ossären Metastasierung ist die Effektivität einer lokalen Strahlentherapie der Prostata abhängig von der Metastasenlast. Anhand einer Subgruppenanalyse der STAMPEDE-Studie konnte gezeigt werden, dass die Strahlentherapie in Kombination mit einer Hormontherapie bei Patienten mit niedriger Metastasenlast (nur lokale Lymphkotenmetastasen, keine viszeralen Metastasen und maximal drei Knochenmetastasen) einen positiven Effekt auf das Gesamtüberleben hat.
Bei steigender Anzahl an Metastasen nahm dieser Effekt kontinuierlich ab.5 Gleiches scheint für die radikale Prostatektomie bei oligometastasierten Patienten (<4 Knochenmetastasen) zu gelten, sodass neben der Strahlentherapie auch eine operative Lokaltherapie in Kombination mit einer antihormonellen Therapie in Erwägung gezogen werden kann.6 Dies gilt umso mehr, wenn es sich nur um eine pelvine lymphogene Metastasierung handelt.
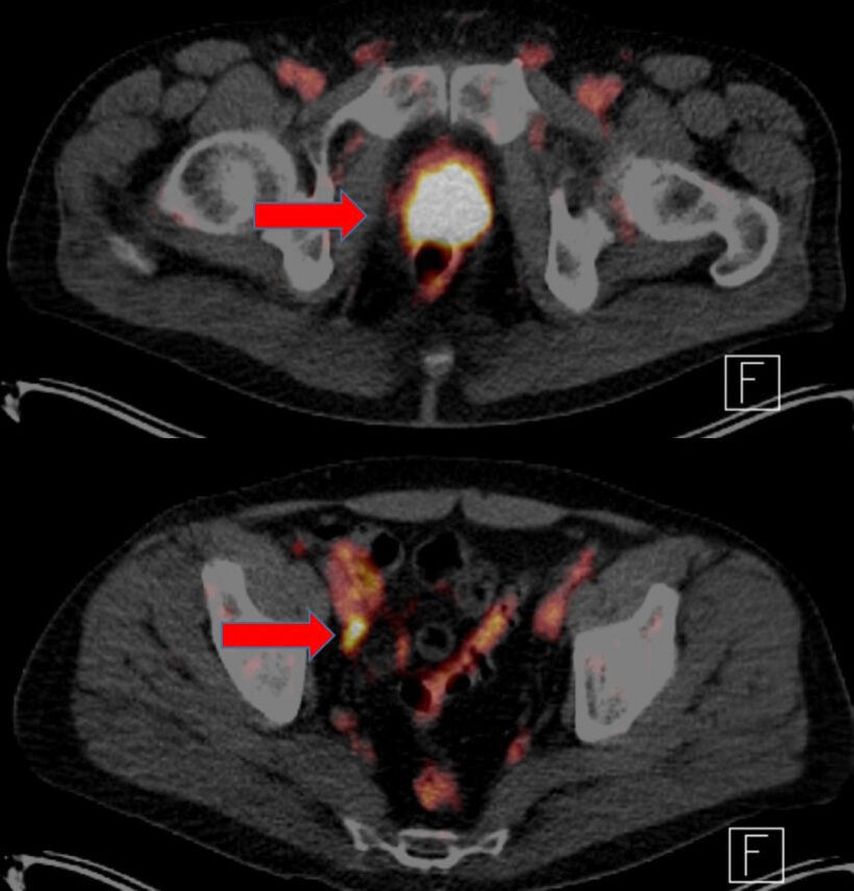
Abb. 1: Beispiel eines 49-jährigen Patienten mit Hochrisikokonstellation: Die PSMA-PET/CT zeigt einen ausgeprägten Lokalbefund sowie eine beginnende pelvine Metastasierung rechts. Die postoperative Histologie ergab ein Prostatakarzinom pT3b pN1 (7/29) cM0 R1, Gleason Score 3+4, Tertiärgrad 5 (PSA initial 120ng/ml), sodass eine adjuvante Strahlentherapie der Prostataloge sowie des Lymphabflusses mit begleitendem Androgenentzug im Sinne eines multimodalen Therapiekonzeptes erfolgt
Der Frage, ob die Effektivität einer systemischen Hormonchemotherapie durch eine lokale Therapie (Bestrahlung oder Operation) gesteigert werden kann, wird derzeit in prospektiv randomisierten Studien nachgegangen.
Des Weiteren wird im Fall eines Lymphknotenrezidivs nach Primärtherapie bereits seit einigen Jahren die Durchführung einer Salvage-Lymphadenektomie als therapeutische Option untersucht. Dabei ist anzumerken, dass es sich hierbei immer noch um ein experimentelles Vorgehen handelt. Vor Einführung der PET-Diagnostik mit gegen das prostataspezifische Membranantigen (PSMA) gerichteten Tracern in die moderne molekulare Diagnostik erfolgte dies meist auf Basis einer Cholin-PET. Nach anfänglich vielversprechenden Resultaten wurde jedoch eine zu geringe Sensitivität für den Nachweis von lymphogenen Prostatakarzinommetastasen für die Cholin-PET gezeigt.7
Bedeutung der bildgebenden Diagnostik
In der Diskussion der chirurgischen Therapie eines Prostatakarzinoms mit lymphogener Metastasierung ist entscheidend, ob für die Diagnostik die klassischen konventionellen bildgebenden Verfahren (CT, MRT, Knochenszintigrafie) oder eine moderne molekulare Bildgebung, allen voran die PSMA-PET, eingesetzt wurden. Im Primärstaging konnten die bereits retrospektiv erhobenen Daten für die PSMA-PET aktuell von der prospektiven proPSMA-Studie8 bestätigt werden.
Hier zeigten sich für das PSMA-PET im Vergleich zur konventionellen Bildgebung (CT) eine erhöhte Spezifität (98% versus 91%) und vor allem eine signifikant erhöhte Sensitivität (85% versus 38%) für die Detektion von Lymphknotenmetastasen.
Dieser Evidenz trägt die S3-Leitlinie, nach der die Anwendung der PSMA-PET in der Primärdiagnostik nur im Rahmen von klinischen Studien erfolgen soll, aktuell (noch) nicht Rechnung.1
Jedoch fließt die aktuelle Studienlage in die derzeit in Überarbeitung befindlichen S3-Leitlinien (Konsultationsfassung 2021) ein, sodass zu erwarten ist, dass in Zukunft die PSMA-PET beim Hochrisiko-Prostatakarzinom (Gleason Score 8–10 oder T-Kategorie cT3/cT4 oder PSA ≥20ng/ml) auch primär zur Ausbreitungsdiagnostik eingesetzt werden kann.
Ebenso konnte für den Einsatz der PSMA-PET in der Rezidivdiagnostik in zahlreichen retrospektiven und auch einigen prospektiven Studien eine deutlich verbesserte Detektion von Lymphknotenmetastasen gezeigt werden. Erwähnenswert ist hier u.a. die Studie von Jilg et al., welche die Größe von Lymphknotenmetastasen bestimmten, die für eine Detektion mittels PSMA-PET notwendig war (2,3mm bzw. 4,5mm im Kurzachsendurchmesser für eine 50%- bzw. 90%-Detektion).9 In der konventionellen Bildgebung hingegen werden Lymphknoten üblicherweise erst ab einer Größe von 8–10mm als auffällig beschrieben. Mittlerweile kann das PSMA-PET in der Rezidivdiagnostik bereits leitliniengerecht eingesetzt werden, falls sich daraus eine therapeutische Konsequenz ergibt.1
Einfluss der molekularen Bildgebung auf die Primärtherapie
Eine zunehmend genauere Bildgebung hat dabei nicht nur einen Einfluss auf das Ausmaß der Lymphknotenresektion bei der Primärtherapie. Die PSMA-PET kann dabei möglicherweise auch von prognostischer Bedeutung sein.
Dies haben Amiel et al. anhand von 230 Prostatakarzinompatienten untersucht (64 mit intermediärem und 166 mit Hochrisikoprofil).10 Alle Patienten erhielten ein PSMA-PET als Primärstaging vor einer radikalen Prostatektomie mit simultaner Lymphadenektomie. Evaluiert wurde der Einfluss eines Nachweises einer lymphogenen Metastasierung in der PSMA-PET auf das biochemische Rezidiv (BCR) und die Zeit bis zur Einleitung einer adjuvanten oder Salvagetherapie.
Es zeigte sich, dass Patienten mit positivem Lymphknotennachweis in der PSMA-PET vor radikaler Prostatektomie im Median nach 1,7 Monaten von einem biochemischen Rezidiv (BCR) und dementsprechend einem früheren Einleiten einer adjuvanten oder Salvagetherapie betroffen waren (im Median nach 2,6 Monaten). Fielen Lymphknotenmetastasen erst in der postoperativen histologischen Untersuchung auf, erhöhte sich das BCR- und Therapie-freie Überleben auf 7,5 und 8,9 Monate. Diejenigen Patienten, welche auch histologisch keinen Nachweis auf eine lymphogene Metastasierung hatten, zeigten sowohl ein BCR- und als auch Therapiefreies Überleben von über 36 Monaten. Bei Nachweis einer Lymphknotenbeteiligung im präoperativen PSMA-PET-Staging ist also in der Regel von einem multimodalen Therapiekonzept auszugehen. Demzufolge könnte zukünftig die präoperative Bildgebung mittels PSMA-PET einen direkten Einfluss auf die Beratung von Patienten hinsichtlich einer strengeren Nachbeobachtung bzw. die Planung einer (neo)adjuvanten Therapie und damit den weiteren Krankheitsverlauf haben.
Einfluss der molekularen Bildgebung auf die Salvagetherapie
Für die Behandlung eines lymphogenen Rezidivs nach radikaler Prostatektomie und ggf. lokaler Salvage-Strahlentherapie gibt es allerdings derzeit keinen allgemein gültigen Therapiestandard.1
Ziel einer Salvage-Lymphadenektomie ist es, den Krankheitsverlauf und systemische Folgetherapien zu verzögern oder ggf. sogar zu vermeiden. Studienergebnisse deuten darauf hin, dass eine metastasengerichtete Therapie (Salvage-Lymphadenektomie oder Salvage-Strahlentherapie) im Vergleich zur alleinigen Überwachung die Einleitung einer antihormonellen Therapie verzögern könnte.11,12
Da die Lokalisation eines Rezidivs (Lokalrezidiv, lymphogene, ossäre oder Organmetastasierung) die weitere Therapie (Salvage-Strahlentherapie, Salvage-Lymphadenektomie oder Systemtherapie) entscheidend beeinflusst, sollte diese vor Therapieplanung möglichst früh und genau erfolgen. Hierzu ist die PSMA-PET aufgrund ihrer im Vergleich zur konventionellen CT und der Cholin-PET auch bei niedrigen PSA-Werten deutlich erhöhten Spezifität und Sensitivität besonders im Hinblick auf die Detektion von Lymphknotenrezidiven geeignet.
Dieser Vorteil der PSMA-PET kann zur Verbesserung der Salvage-Lymphadenektomie genutzt werden, um die initial auf Basis einer konventionellen Bildgebung erzielten, im Langzeitverlauf zuletzt jedoch als ernüchternd beschriebenen Ergebnisse dieses Therapiekonzepts zu verbessern.7 Ursache hierfür könnte die Tatsache sein, dass kleine Lymphknotenmetastasen insbesondere bei vorbehandelten Patienten aufgrund der dadurch bedingten schwierigen intraoperativen Verhältnisse schlechter zu erkennen sind. Des Weiteren wurden in der Studie von Bravi et al.7 in der präoperativen Bildgebung meist die im Vergleich zur PSMA-PET deutlich weniger sensitive und spezifische Cholin-PET eingesetzt und Patienten mit bereits höheren PSA-Werten und bereits eingeleiteter antihormoneller Therapie (18%) eingeschlossen, was zu einer Unterschätzung der tatsächlichen Metastasenlast geführt haben könnte.
Ebenso bestand bei einem Teil der Patienten eine retroperitoneale Metastasierung (10%) und bei 21% der Patienten konnte kein histologisch positiver Lymphknoten entfernt werden. In Zusammenschau dieser Befunde kann davon ausgegangen werden, dass die Indikation zur Salvage-Lymphadenektomie bei einem Großteil der in die Studie eingeschlossenen Patienten heutzutage sehr zurückhaltend gestellt werden würde.
Um im Rahmen der PSMA-PET-basierten Salvage-Lymphadenektomie eine möglichst zielgerichtete und vollständige Entfernung von Lymphknotenmetastasen zu gewährleisten, ist es mittlerweile möglich, die betroffenen Lymphknoten präoperativ radioaktiv zu markieren (z.B. 99mTechnetium-PSMA-I&S [Imaging & Surgery]) und intraoperativ mithilfe einer Gammasonde genau zu identifizieren („radioguided surgery“ [RGS]). Knipper et al. haben in einem Vergleich zwischen der konventionellen Salvage-Lymphadenektomie und der RGS im kurzfristigen postoperativen PSA-Abfall (6 Wochen) einen deutlichen Vorteil für die RGS zeigen können (PSA-Abfall >50% bei allen mittels RGS operierten Patienten vs. 50% für Patienten mit konventioneller Salvage-Lymphadenektomie). Des Weiteren wurde bei allen mittels RGS operierten Patienten Tumorgewebe im histologischen Präparat nachgewiesen. Bei neun der mittels konventioneller Lymphadenektomie behandelten Patienten (31%) zeigte sich dagegen histologisch keine Malignität.13
Horn et al.14 konnten die Möglichkeit des gezielten Auffindens von Metastasen mittels RGS anhand einer größeren Kohorte (n=121) bestätigen. Bei 120 von 121 Patienten (99%) konnten Lymphknotenmetastasen entfernt werden. Ein komplettes biochemisches Ansprechen (postoperativer PSA-Abfall auf <0,2ng/ml) wurde bei 66% der Patienten festgestellt.
Die Wahrscheinlichkeit für ein komplettes biochemisches Ansprechen war am höchsten, wenn präoperativ sowohl ein niedriger PSA-Wert als auch nur eine singuläre Läsion in der PSMA-PET vorlagen (38 von 45 Patienten; 84%). Diese Patienten zeigten ohne weitere Therapie mit im Median 19,8 Monaten (Gesamtkohorte: Median 6,4 Monate) auch das längste biochemisch rezidivfreie Überleben.
Trotzdem stellt die PSMA-PET-basierte Salvage-Lymphadenektomie nach wie vor ein experimentelles Therapieverfahren dar, welches nur bei sorgfältig ausgewählten Patienten zum Einsatz kommen sollte.
Fazit
Die Chirurgie hat einen festen Platz im Therapiekonzept der Primärtherapie des lymphogen metastasierten Prostatakarzinoms, gilt aber aktuell im Salvagesetting noch als individuelles Vorgehen. Hierbei kann die Effektivität durch eine optimale Diagnostik mittels PSMA-PET gesteigert werden.
Literatur:
1 Leitlinienprogramm Onkologie: Interdisziplinäre Leitlinie der Qualität S3 zur Früherkennung, Diagnose und Therapie der verschiedenen Stadien des Prostatakarzinoms. Online unter: https://www.leitlinienprogramm-onkologie.de 2 European Association of Urology: Guidelines on prostate cancer 2020. Online unter: https://uroweb.org/guideline/prostate-cancer/#6_4 3 Seisen T et al.: Efficacy of local treatment in prostate cancer patients with clinically pelvic lymph node-positive disease at initial diagnosis. Eur Urol 2018; 73(3): 452-61 4 Ventimiglia E et al.: A systematic review of the role of definitive local treatment in patients with clinically lymph node-positive prostate cancer. Eur Urol Oncol 2019; 2(3): 294-301 5 Ali A et al.: Association of bone metastatic burden with survival benefit from prostate radiotherapy in patients with newly diagnosed metastatic prostate cancer: a secondary analysis of a randomized clinical trial. JAMA Oncol 2021; 7(4): 555-63 6 Knipper S et al.: Outcome of patients with newly diagnosed prostate cancer with low metastatic burden treated with radical prostatectomy: a comparison to STAMPEDE arm H. World J Urol 2020; 38(6): 1459-64 7 Bravi CA et al.: Long-term outcomes of salvage lymph node dissection for nodal recurrence of prostate cancer after radical prostatectomy: not as good as previously thought. Eur Urol 2020; 78(5): 661-9 8 Hofman MS et al.: Prostate-specific membrane antigen PET-CT in patients with high-risk prostate cancer before curative-intent surgery or radiotherapy (proPSMA): a prospective, randomised, multicentre study. Lancet 2020; 395(10231): 1208-16 9 Jilg C et al.: Diagnostic accuracy of Ga-68-HBED-CC-PSMA-Ligand-PET/CT before salvage lymph node dissection for recurrent prostate cancer. Theranostics 2017; 7(6): 1770-80 10 Amiel T et al.: Regional lymph node metastasis on prostate specific membrane antigen positron emission tomography correlates with decreased biochemical recurrence-free and therapy-free survival after radical prostatectomy: a retrospective single-center single-arm observational study. JUrol 2021; 101097ju0000000000001596 11 Tilki D et al.: Salvage lymph node dissection for nodal recurrence of prostate cancer after radical prostatectomy. J Urol 2015; 193(2): 484-90 12 Ost P et al.: Surveillance or metastasis-directed therapy for oligometastatic prostate cancer recurrence: a prospective, randomized, multicenter phase II trial. J Clin Oncol 2018; 36(5): 446-53 13 Knipper S et al.: Metastases-yield and Prostate-specific antigen kinetics following salvage lymph node dissection for prostate cancer: a comparison between conventional surgical approach and prostate-specific membrane antigen-radioguided surgery. Eur Urol Focus 2019; 5(1): 50-3 14 Horn T et al.: Single lesion on prostate-specific membrane antigen-ligand positron emission tomography and low prostate-specific antigen are prognostic factors for a favorable biochemical response to prostate-specific membrane antigen-targeted radioguided surgery in recurrent prostate cancer. Eur Urol 2019; 76(4): 517-23
Das könnte Sie auch interessieren:
Adjuvantes Osimertinib reduziert ZNS-Rezidive bei EGFR-mutierter Erkrankung
Etwa 30% der Patienten mit nicht kleinzelligem Lungenkarzinom (NSCLC) präsentieren sich mit resezierbarer Erkrankung und werden einer kurativen Operation unterzogen. Viele Patienten ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...