.jpg)
Die Bedeutung von TKI in der Erstlinientherapie des metastasierten RCC
Autorin:
Dr. Susanne Deininger
Fachärztin für Urologie, medikamentöse Tumortherapie
Uniklinikum Salzburg
Landeskrankenhaus
Universitätsklinik für Urologie der PMU
E-Mail: s.deininger@salk.at
Die Therapie des metastasierten Nierenzellkarzinoms (mRCC) hat in den letzten Jahren eine wahre Revolution erlebt. Nachdem jahrelang die Tyrosinkinaseinhibitoren (TKI) Sunitinib und Pazopanib in der ersten Therapielinie Standard waren, kommen nun vermehrt Kombinationstherapien von TKI mit Checkpointinhibitoren (CPI) zum Einsatz. Die Monotherapie mit TKI kommt nun eher bei Patienten mit Kontraindikationen für CPI und bei Varianten wie dem papillären Nierenzellkarzinom (pmRCC) in Betracht.
Keypoints
-
Die Bedeutung von TKI in der Erstlinientherapie des metastasierten Nierenzellkarzinoms hat sich verändert: weg von TKI in der Monotherapie, hin zu Kombinationstherapien mit CPI wie Nivolumab und Pembrolizumab.
-
Die Hauptindikationen für TKI als Monotherapie sind in den aktuellen Leitlinien der EAU und der ESMO die Unverträglichkeit von CPI oder deren fehlende Verfügbarkeit.
-
Auch für Subtypen wie das papilläre Nierenzellkarzinom stellen gerade Drittgenerations-TKI wie Cabozantinib mögliche zukünftige Therapien dar.
Rückblick
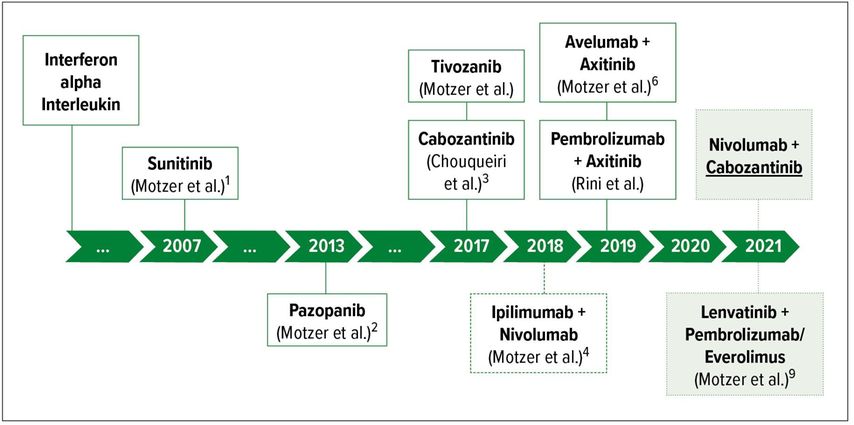
Den zeitlichen Verlauf der etablierten Erstlinientherapien beim mRCC finden Sie in Abbildung 1.
Abb. 1: Überblick über die Erstlinientherapien des metastasierten klarzelligen Nierenzellkarzinoms im zeitlichen Verlauf
Die Systemtherapie des mRCC war noch bis in die 2000er-Jahre hinein sehr problematisch. Therapieoptionen wie Interferon alpha und Interleukin waren weder besonders gut verträglich noch effektiv. Einer der ersten untersuchten TKI in der Therapie des metastasierten klarzelligen Nierenzellkarzinoms (mccRCC) war der Multikinaseinhibitor Sorafenib (Nexavar®). Dieser konnte sich jedoch nicht durchsetzen und wurde nie in erster Therapielinie zugelassen. Im Jahr 2007 veröffentlichten Motzer et al. die Daten ihrer Studie, in der der Erstgenerations-TKI Sunitinib (Sutent®) mit einer Interferon-alpha-Therapie in der ersten Therapielinie beim mRCC verglichen wurde. Nicht nur waren progressionsfreies Überleben (PFS) und Gesamtüberleben (OS) im Vergleich zur Interferontherapie signifikant länger, auch Lebensqualität und Ansprechraten waren überlegen.1
Im Jahr 2013 folgten die Daten aus der COMPARZ-Studie, welche den Zweitgenerations-TKI Pazopanib (Votrient®) mit Sunitinib verglich. OS und PFS waren innerhalb der Gruppen vergleichbar, jedoch traten bei Pazopanib im Vergleich zu Sunitinib weniger Fatigue und Hand-Fuß-Syndrom auf.2
Schnell hatten sich Pazopanib und Sunitinib in der Erstlinientherapie des mccRCC etabliert. Im Verlauf kamen auch zunehmend Drittgenerations-TKI wie Tivozanib (Fotivda®) und Cabozantinib (Cabometyx®) auf. Die Daten der CABOSAN-Studie veränderten erneut nachhaltig die Leitlinien zur Therapie des mccRCC.3 Hier hatten 157 Patienten mit mccRCC in der ersten Therapielinie 50mg Sunitinib (im 4:2-Wochenschema) oder 60mg Cabozantinib täglich erhalten. Erneut zeigte sich eine Verlängerung von Lebenszeit und stabiler Erkrankungsphase: Das PFS betrug 5 Monate (Sunitinib) vs. 8,6 Monate (Cabozantinib) (p=0,0008) und das OS war unter Cabozantinib um 5,4 Monate verlängert. Auch das Ansprechen war bei Cabozantinib mit 20% deutlich höher als bei Sunitinib (9%). Hervorzuheben war, dass auch bei Patienten in der intermediären und ungünstigen Risikoklasse nach IMDC (International metastatic RCC Database Consortium) bei Cabozantinib im Vergleich zu Sunitinib ein besseres Ansprechen und ein längeres PFS zu verzeichnen waren. Aufgrund dessen wurde Cabozantinib insbesondere in dieser speziellen Patientengruppe implementiert.
Aktuelles
Die nächste Revolution bahnte sich 2018 an: die Ära der Immuntherapie in der Therapie des mRCC. Die Kombinationstherapie bestehend aus dem „Programmed cell death protein 1“(PD-1)-Antikörpers Nivolumab (Opdivo®) und dem „Cytotoxic- T-lymphocyte-associated Protein-4“(CTLA-4)“-Antikörper Ipilimumab (YERVOY®) erbrachte erfreuliche Ergebnisse.4 Es kam nun zunehmend zu einem Paradigmenwechsel, von der reinen TKI-Therapie in der Erstlinie hin zur Kombinationstherapie CPI plus TKI. Insbesondere der Drittgenerations-TKI Axitinib (Inlyta®) etablierte sich schnell in Kombination mit CPI wie Avelumab (Bavencio®) und Pembrolizumab (Keytruda®), wenn er auch nie selbst als Monotherapie in der ersten Linie zugelassen wurde.
Im Rahmen der KEYNOTE-426-Studie erhielten 861 Patienten mit mccRCC in der ersten Therapielinie 5mg Axitinib zweimal täglich plus dreiwöchentlich 200mg Pembrolizumab i.v. versus 50mg Sunitinib (im 4:2 Wochenschema). Die Kombination CPI plus TKI führte zu einer signifikanten Verlängerung des PFS (15,1 Monate vs. 11,1 Monate bei Sunitinib) und einer höheren Ansprechrate (59,3% vs. 35,7%). Einzig in der Subgruppe der Patienten mit guter Risikoklasse nach IMDC ergab sich kein OS-Vorteil der Kombinationstherapie im Vergleich zu Sunitinib.5 Die Daten wurden bald darauf im Rahmen der Leitlinienerstellung der European Association of Urology (EAU) umgesetzt.
Ein ähnliches Studiendesign und ähnlich gute Ergebnisse zeigte die Kombination Avelumab plus Axitinib in der JAVELIN-Renal-101-Studie.6 886 Patienten mit mccRCC erhielten in der ersten Therapielinie 5mg Axitinib zweimal täglich plus zweiwöchentlich 10mg/kg Körpergewicht Avelumab i.v. oder 50mg Sunitinib (im 4:2-Wochenschema). Die Kombination führte zu einer signifikanten Verlängerung von PFS (13,8 Monate vs. 8,4 Monate bei Sunitinib) und zu einem erhöhten Ansprechen bei PD-L1 positiven Tumoren (55,2% vs. 25,5% bei Sunitinib).
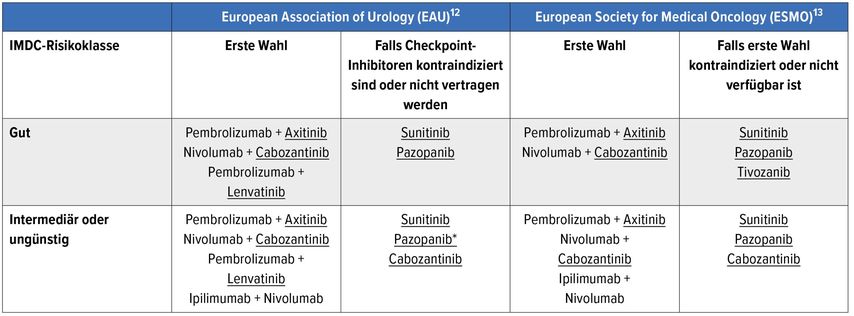
Die TKI in der Erstlinientherapie des (cc)mRCC finden in den aktuellen Leitlinienempfehlungen von EAU und European Society for Medical Oncology (ESMO) (Tab. 1) vor allem im Rahmen von Kombinationstherapien mit den CPI Nivolumab und Pembrolizumab Anwendung. Als Monotherapie kommen sie infrage, falls CPI nicht vertragen werden oder nicht verfügbar sind.
Tab. 1: Empfehlungen zur Erstlinientherapien des mccRCC. *Pazopanib nur bei intermediärer Risikoklasse. Unterstrichen = TKI.
Ausblick
Was erwartet uns bezüglich der Erstlinientherapie Neues?
Die Europäische Arzneimittelbehörde, EMA, hat im März 2021 die Zulassung der Kombination des CPI Nivolumab mit dem Drittgenerations-TKI Cabozantinib in der Erstlininentherapie des mRCC bekannt gegeben.7 Eine Zulassung der U.S. Food and Drug Administration (FDA) für diese Indikation liegt bereits seit Jänner 2021 vor.8
Die Zulassung geht auf die Daten der Checkmate-9ER-Studie zurück. Hier erhielten 651 Patienten mit mccRCC in der ersten Therapielinie 240mg Nivolumab i.v. zweiwöchentlich plus 40mg Cabozantinib täglich versus 50mg Sunitinib (im 4:2-Wochenschema). Es zeigten sich ein deutlich längeres PFS bei der Kombination (16,6 Monate vs. 8,3 Monate bei Sunitinib) und ein besseres Ansprechen (55,7% vs. 27,1%).
Ganz aktuell haben die Daten der Checkmate-9ER-Studie schon ihren Weg in die Leitlinienempfehlungen der EAU und ESMO gefunden (Tab. 1).
Die Ergebnisse der dreiarmigen CLEAR(Study 307)-Studie wurden im Februar 2021 veröffentlicht.9 Sie untersucht die Kombination 18mg Lenvatinib (Lenvima®) plus 5mg Everolimus im Vergleich zur Kombination 20mg Lenvatinib plus dreiwöchentlich 200mg Pembrolizumab i.v. und im Vergleich zum Standard 50mg Sunitinib (im 4:2-Wochenschema). Lenvatinib beim mRCC war bereits zuvor alleine und in der Kombinationstherapie mit Everolimus (Afinitor®) untersucht worden.10
Gerade die Kombination Lenvatinib plus Pembrolizumab zeigte mit 71% ein hohes Ansprechen, mit 16% komplettem Ansprechen (CR). Das PFS lag in der Kombination CPI plus TKI bei 23,9 Monaten vs. 14,7 Monate bei Lenvatinib plus Everolimus vs. 9,2 Monate bei Sunitinib. Das Gesamtüberleben war im Kombinationsarm CPI plus TKI 34% länger als bei Sunitinib (p=0,005). Das aktuellste Update der EAU-Leitlinien enthält bereits die Empfehlung zur Therapie mit Lenvatinib plus Pembrolizumab in der Erstlinie des mRCC (Tab. 1).
Nicht nur aufgrund des Designs vieler aktueller Studien wird zumeist lediglich über die Therapie des ccmRCC gesprochen. Dabei wird nicht beachtet, dass auch andere Subtypen des Nierenzellkarzinomes mit differenten genetischen Mustern existieren. Das papilläre Nierenzellkarzinom (pRCC) ist mit 10–15% die zweithäufigste Entität des RCC. Aufgrund der divergierenden Genetik kann bei Subtypen nicht von einem ähnlichen Ansprechen der beim ccmRCC etablierten Therapien ausgegangen werden.
Die ersten Daten der Phase-II-Studie SWOG 1500 wurden im Februar dieses Jahres auf dem Genitourinary Cancers Symposium der American Society of Clinical Oncology (ASCO GU) präsentiert.11 152 Patienten mit pmRCC erhielten in der Erst- oder Zweitlinie unter anderem Cabozantinib 60mg oder Sunitinib 50mg (im 4:2-Wochenschema). Im Vergleich Cabozantinib vs. Sunitinib zeigte sich ein signifikant längeres PFS (9 Monate vs. 5,6 Monate bei Sunitinib; p=0,019) und ein besseres Ansprechen (23% vs. 4% bei Sunitinib; p=0,01) unter Cabozantinib.
Literatur:
1 Motzer RJ et al.: Sunitinib versus interferon alfa in metastatic renal-cell carcinoma. N Engl J Med 2007; 356(2): 115-24 2 Motzer RJ et al.: Pazopanib versus sunitinib in metastatic renal-cell carcinoma. N Engl J Med 2013; 369(8): 722-31 3 Choueiri TK et al.: Cabozantinib versus sunitinib as initial targeted therapy for patients with metastatic renal cell carcinoma of poor or intermediate risk: the alliance A031203 CABOSUN trial. J Clin Oncol 2017; 35(6): 591-7 4 Motzer RJ et al.: Nivolumab plus ipilimumab versus sunitinib in advanced renal-cell carcinoma. N Engl J Med 2018; 378(14): 1277-90 5 Powles T et al.: Pembrolizumab plus axitinib versus sunitinib monotherapy as first-line treatment of advanced renal cell carcinoma (KEYNOTE-426): extended follow-up from a randomised, open-label, phase 3 trial. Lancet Oncol 2020; 21(12): 1563-73 6 Motzer RJ et al.: Avelumab plus axitinib versus sunitinib for advanced renal-cell carcinoma. N Engl J Med 2019; 380(12): 1103-15 7 Ipsen: European Commission approves Cabometyx® in combination with Opdivo® as a first-line treatment for patients living with advanced renal cell carcinoma. Online unter: https://www.ipsen.com/press-releases/european-commission-approves-cabometyx-in-combination-with-opdivo-as-a-first-line-treatment-for-patients-living-with-advanced-renal-cell-carcinoma/ (letzter Zugriff 05.04. 2021 8 FDA: FDA approves nivolumab plus cabozantinib for advanced renal cell carcinoma. Online unter: https://www.fda.gov/drugs/drug-approvals-and-databases/fda-approves-nivolumab-plus-cabozantinib-advanced-renal-cell-carcinoma (letzter Zugriff 9.4.2021 9 Motzer RJ et al.: Lenvatinib plus pembrolizumab or everolimus for advanced renal cell carcinoma. NEngl J Med 2021; 384(14):1289-300 10 Motzer RJ et al.: Lenvatinib, everolimus, and the combination in patients with metastatic renal cell carcinoma: a randomised, phase 2, open-label, multicentre trial. Lancet Oncol 2015; 16(15): 1473-82 11Williams L: SWOG 1500: Cabozantinib ‘new standard’ for metastatic papillary RCC. Online unter: https://oncology.medicinematters.com/asco-gu-2021/genitourinary-cancers/swog-1500-cabozantinib-metastatic-papillary-rcc/18859996 (letzter Zugriff 9.4.2021) 12 EAU Guidelines. EAU Annual Congress 2020 13 Escudier B et al.: Renal Cell Carcinoma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2019; 30(5): 706-720
Das könnte Sie auch interessieren:
Adjuvantes Osimertinib reduziert ZNS-Rezidive bei EGFR-mutierter Erkrankung
Etwa 30% der Patienten mit nicht kleinzelligem Lungenkarzinom (NSCLC) präsentieren sich mit resezierbarer Erkrankung und werden einer kurativen Operation unterzogen. Viele Patienten ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...