.jpg)
Das Urothelkarzinom des oberen Harntrakts – Grundlagen, Diagnostik und Therapie
Autoren:
Dr. med. Dr. sc. med. Florian A. Schmid
PD Dr. med. Cédric Poyet
PD Dr. med. Thomas Hermanns
Leitender Arzt
Universitätsspital Zürich, Klinik für Urologie, Universität Zürich
Korrespondenz:
E-Mail: thomas.hermanns@usz.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Beim Urothelkarzinom des oberen Harntrakts handelt es sich um eine seltene Erkrankung, für die dennoch relativ klare Behandlungsleitlinien existieren. Es wird zwischen Low- und High-Risk-Tumoren unterschieden, wobei Erstere wenn möglich meist organerhaltend therapiert werden können. Der folgende Artikel gibt einen Überblick über Ätiologie, Diagnostik, Klassifikation, Therapie, Nachsorge und Prognose dieser Erkrankung.
Keypoints
-
Die wichtigsten Risikofaktoren für die Entstehung eines UTUC sind das Rauchen, die Exposition gegenüber aromatischen Aminen und der Konsum von Aristolochiasäuren. Eine genetische Prädisposition für die Entwicklung eines UTUC besteht beim Lynch-Syndrom.
-
Die Diagnostik setzt sich aus der Ureterorenoskopie mit Biopsie und Spülzytologie sowie einer Schnittbildgebung des Abdomens zusammen.
-
Die Therapie des Low-Risk- UTUC sollte wenn möglich nierenerhaltend erfolgen. Beim High-Risk-UTUC ist die radikale Nephroureterektomie mit einer Template-Lymphadenektomie die Therapie der Wahl.
-
Die adjuvante, platinbasierte Chemotherapie führt bei Patienten mit lokal fortgeschrittenem Tumorleiden zu einem verlängerten tumorfreien Überleben nach RNU.
1 Grundlagen
1.1 Epidemiologie
Das Urothelkarzinom (UCa) des oberen Harntrakts (UTUC; «upper tract urothelial cell carcinoma») ist eine relativ seltene maligne Erkrankung, die vom Übergangsepithel des Nierenbeckens oder des Harnleiters ausgeht. Die Inzidenz von durchschnittlich 2 Fällen pro 100000 Einwohner pro Jahr ist niedrig, wobei Männer im Vergleich zu Frauen rund 2,5x häufiger betroffen sind.1 Aufgrund einer verbesserten Diagnostik und eines gesteigerten Überlebens nach Behandlung eines Harnblasenkarzinoms (BCa) hat die Inzidenz über die letzten Jahrzehnte stetig zugenommen.2,3 Das mittlere Alter der Patienten zum Zeitpunkt der Diagnose ist über die Zeit auf 73 Jahre angestiegen.2,3 Lediglich 5–10% aller UCa haben im oberen Harntrakt ihren Ursprung (2/3 im Nierenbecken, 1/3 im Harnleiter) und das UTUC des Nierenbeckens ist für nur 5–7% aller Nierentumoren verantwortlich.4,5 Insgesamt sind UCa jedoch die am vierthäufigsten diagnostizierten Krebserkrankungen der westlichen Welt.4 Multifokale Tumoren werden bei Erstdiagnose in 10–20% der Fälle entdeckt und bei ca. 7% der Patienten findet sich ein bereits metastasiertes Leiden zum Diagnosezeitpunkt.6,7 Nach Behandlung eines UTUC kommt es in 22–47% der Fälle zu einem Rezidiv in der Harnblase, wobei nur 2–4% der Patienten ein UTUC nach Therapie eines BCa entwickeln.1,8
1.2 Risikofaktoren
Das Lynch-Syndrom stellt eine genetische Prädisposition dar, die als Keimbahnmutation familiär vererbt wird und neben einer Reihe anderer Tumorerkrankungen (u.a. hereditäres nicht polypöses Kolonkarzinom; HNPCC) auch das Risiko für ein UTUC relevant steigert. Ursächlich ist eine Mutation der DNA-Mismatch-Reparaturgene (betroffen sind überwiegend MSH2 oder MHL1), die zu einer Mikrosatelliteninstabilität (MSI) führt. Die UCa repräsentieren jedoch nur die vierthäufigste Karzinomform ausserhalb des Kolons (nach Endometrium-, Ovarial- und Magenkarzinom). Im Vergleich zur generellen Bevölkerung steigt das relative Risiko für ein UTUC oder BCa bei Patienten mit Lynch-Syndrom um das 22-Fache.9 Deshalb sollte vor allem bei jüngeren Patienten mit UCa das Vorliegen eines Lynch-Syndroms untersucht werden und den Patienten eine genetische Beratung empfohlen werden.10
Zu den wichtigsten Umweltfaktoren, die die Entstehung eines UTUC fördern, gehören das Rauchen und die Exposition gegenüber bestimmten löslichen Chemikalien.11 Das Rauchen erhöht das relative Risiko, an einem UTUC zu erkranken, rund 2,5–7 Mal. Nach 10-jährigem Rauchstopp reduziert sich das relative Risiko jedoch wieder um 60–70%.12 Raucher neigen zudem bedeutend häufiger dazu, nach der Behandlung einen Rückfall oder sogar einen karzinomspezifischen Todesfall zu erleiden.13Der zweitwichtigste Risikofaktor stellt die Exposition gegenüber giftigen Dämpfen aus der Färbungs-, Textil-, Gummi-, Erdöl- und Chemieindustrie dar.11 Dabei handelt es sich um die Gruppe der aromatischen Amine, welche das relative Risiko für eine Erkrankung an einem UTUC, nach einer durchschnittlichen Exposition über 7 Jahre und Latenzzeiten von etwa 20 Jahren, um das 8,3-Fache steigert.14 Auch der Konsum von Aristolochiasäuren ist ebenfalls mit einem erhöhten UTUC-Risiko verbunden. Die Aristolochiasäuren sind als Extrakte in Pflanzenheilmitteln aus China (sog. «Chinese herbs») oder teilweise auch in Lebensmitteln durch Samenrückstände der Aristolochiapflanze (endemisch im Balkangebiet) nachzuweisen. Aristolochiasäuren verursachen eine Mutation auf dem Codon 139 des p53-Gens und führen zur sogenannten «Balkannephropathie» oder der «chinesischen Kräuternephropathie».11,15
Des Weiteren kann der Abusus von Schmerzmitteln wie Phenacetin oder Paracetamol mit einer 2- resp. 20-jährigen Latenz zur Entstehung eines UTUC führen.1 Zu guter Letzt begünstigt auch die Exposition von Arsen, z.B. durch verschmutztes Trinkwasser, die Entstehung eines UCa.16–18
1.3 UTUC vs. BCa: Gemeinsamkeiten und Unterschiede
Das UTUC ist mit dem BCa pathologisch und genetisch verwandt. Aufgrund der Seltenheit des UTUC und der Parallelen zum BCa wird die Behandlung des UTUC zu einem relevanten Teil vom BCa abgeleitet. Neben Gemeinsamkeiten der beiden Tumorentitäten gibt es jedoch auch Unterschiede zu beachten. Gemeinsam sind ihnen die Risikofaktoren des Rauchens und der Exposition gegenüber aromatischen Aminen. Der Phenacetinabusus und die Aristolochiasäure erhöhen vor allem das Risiko für ein UTUC. Die histologische Einteilung (T-Stage) der beiden Tumoren ist fast identisch, wobei beim UTUC keine weitere Unterteilung bei den Stadien T2–4 vorgenommen wird. Beim BCa liegt bei Erstdiagnose in 75% der Fälle kein muskelinvasives Wachstum vor und 60% der Tumoren sind als Low Grade zu charakterisieren.19 Demgegenüber findet sich beim UTUC in 60% der Diagnosen ein bereits invasives Wachstum und 75% der Tumoren sind initial als High Grade einzustufen.1 Die Prognose des BCa ist bei Frauen wegen der oft verzögerten Diagnostik im Vergleich zu den Männern schlechter.20 Dieser Geschlechterunterschied konnte beim UTUC nicht nachgewiesen werden. Patienten mit einem Lynch-Syndrom haben ein insgesamt höheres Risiko für die Entwicklung eines BCa als für die eines UTUC. Allerdings haben Patienten mit einem diagnostizierten UTUC eine höhere Wahrscheinlichkeit, an einem Lynch-Syndrom zu leiden, als Patienten mit einem BCa.21 Signifikante Unterschiede der beiden Tumorentitäten bestehen zudem in der Häufigkeit von spezifischen genetischen Veränderungen: Während beim BCa vor allem Genalterationen auf TP53, ERBB2 und RB1 nachgewiesen werden, sind beim UTUC Mutationen auf FGFR3 und HRAS vorrangig.22
1.4 Symptomatik
Das UTUC wird häufig entweder inzidentell oder als Folge einer Makrohämaturie diagnostiziert.23 Bei Patienten mit Mikrohämaturie liegt nur höchst selten ein UTUC vor.24 Viele Patienten sind bei Erstdiagnose komplett asymptomatisch – nur gerade 6% präsentieren sich mit systemischen Symptomen.25 Flankenschmerzen sind ebenfalls eher selten und gehen, wie auch B-Symptome, oftmals mit lokal bereits fortgeschrittenen Tumoren und einer schlechteren Prognose einher.26 Die Ursache der Flankenschmerzen ist in den meisten Fällen auf eine Ektasie des Nierenbeckenkelchsystems zurückzuführen. Im Vergleich zum BCa erfolgt die Diagnose eines UTUC tendenziell später und die Tumoren sind lokal oft bereits fortgeschritten.
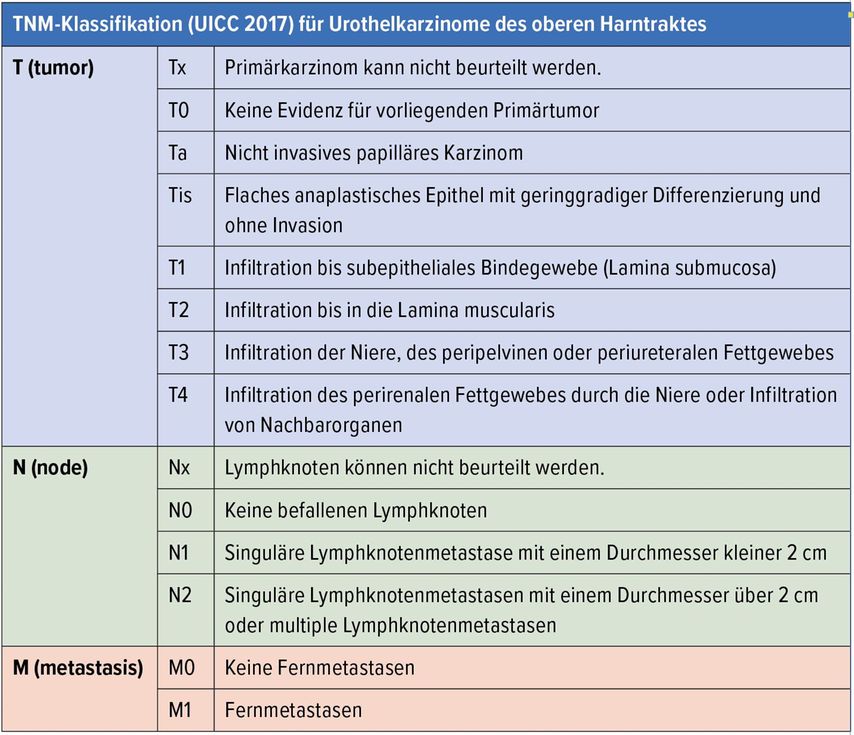
1.5 Klassifikation und Histologie
Die Einteilung der Tumorstadien richtet sich nach der TNM-Klassifikation (Tab. 1), wobei man histologisch (ähnlich dem BCa) folgende Unterscheidung (Grading) vornimmt:
Nicht invasive papilläre Tumoren: papilläre Neoplasien von niedrigmalignem Potenzial (PUNLMP), Low Grade (gut/mässig differenziert) oder High Grade (schlecht differenziert)Flache Läsionen im Sinne eines Carcinoma in situ (CIS)
Invasive Karzinome
Rund 90% aller UTUC sind UCa, während reine Plattenepithel-, Adeno- oder sarkomatoide Karzinome sehr selten vorkommen. Diese können jedoch in bis zu 25% der Fälle als Variante gleichzeitig zum UCa vorliegen.27–29 Vor allem das Plattenepithelkarzinom ist mit chronischen Entzündungen oder Infektsteinen vergesellschaftet.30 Eine vom klassischen UCa abweichende Histologie geht oft mit dem Vorliegen von High-Grade-Tumoren und einer deutlich schlechteren Prognose einher.29,31–33
2 Diagnostik
Die Diagnostik beim UTUC wird unterteilt in endourologische und bildgebende Verfahren. Der Goldstandard für die Diagnose eines UTUC ist die diagnostische Ureterorenoskopie (URS) in Kombination mit einer Urinzytologie und Tumorbiopsie. Liegen ein eindeutiger makroskopischer Befund und eine positive Spülzytologie vor, kann gemäss internationalen Guidelines auf eine Biopsie auch verzichtet werden.1 Zusätzlich werden bildgebende Verfahren zur genaueren Beurteilung der Ausdehnung des Tumors und der umliegenden Strukturen (Staging) eingesetzt. Dabei kommen vor allem der Ultraschall (US), die Computertomografie (CT) und die Magnetresonanztomografie (MRI) zum Einsatz.
2.1 Endoskopische Diagnostik inkl. Zytologie und Biopsie
Die Zystoskopie mit Spülzytologie der Harnblase ist ein wichtiger Teil der Diagnostik und dient dem Ausschluss eines gleichzeitig vorliegenden BCa.3 Eine unauffällige Zystoskopie mit auffälliger Zytologie kann suggestiv für das Vorliegen eines High-Grade-UTUC sein.1 Bei Verdacht auf das Vorliegen eines UTUC sollte eine Spontanurinzytologie einer Spülzytologie vorgezogen werden, da mit einer Spülzytologie hauptsächlich Zellen aus der Harnblase untersucht werden. Die retrograde Ureteropyelografie und die diagnostische URS können zur Beurteilung eines UTUC betreffend Lokalisation, Aspekt und Grösse verwendet werden. Durch die Entnahme einer Biopsie von auffälligem Gewebe kann zusätzlich das Grading des Tumors mit 90%iger Sicherheit bestimmt werden. Die Rate an falsch negativen Resultaten ist niedrig.34 Hingegen ist die Beurteilung des T-Stadiums bedeutend schwieriger, da die Biopsien oftmals klein sind und keine tiefer reichenden Gewebeschichten enthalten.1 Die Unterscheidung zwischen nicht invasiven, flachen Läsionen (CIS) und invasiven Karzinomen gelingt selten, obwohl dies zur Therapieplanung wichtig wäre. Die Histologie korreliert als Surrogat jedoch gut mit der späteren, definitiven Pathologie.35 Des Weiteren ist im Rahmen der retrograden Ureteropyelografie die Entnahme einer selektiven Spülzytologie möglich, welche im Vergleich zur Harnblasenspülzytologie beim BCa jedoch weniger sensitiv ist.36 Die selektive Spülzytologie während einer diagnostischen URS ist einfacher und steigert dabei auch die Zuverlässigkeit der Untersuchung.37
Die Manipulation im oberen Harntrakt während der Diagnostik kann zu einer Abschilferung von Tumorzellen führen und es wird angenommen, dass dies das Risiko für ein UCa in der Harnblase erhöht. Die Datenlage hierzu ist jedoch widersprüchlich. Nach diagnostischer URS vor radikaler Nephroureterektomie (RNU) konnte immerhin nachgewiesen werden, dass das Gesamtüberleben durch die diagnostische URS nicht negativ beeinflusst wird.38,39
2.2 Staging durch Bildgebung
Im US kann eine Ektasie des Nierenbeckenkelchsystems als Hinweis auf eine postrenale Abflussstörung zuverlässig diagnostiziert werden. Ansonsten sind die diagnostischen Möglichkeiten des US beschränkt. Die höchste Präzision zur Einschätzung von Lokalstatus, Lymphknoten- und Fernmetastasen bietet das Kontrastmittel-CT des Abdomens/Beckens.40 Die Aufzeichnung einer Ausscheidungs-Spätphase kann die Beurteilung des Hohlsystems und die Diagnose eines UTUC erleichtern.41 Bei kleineren, lokalisierten Tumoren wird die Genauigkeit des Stagings (T-Stadium) mit einer Sensitivität von 97% angegeben – diese Rate sinkt bei fortgeschrittenen T3/T4-Tumoren auf 67%.42 Vergrösserte Lymphknoten sind im CT stark suggestiv für das Vorliegen von Lymphknotenmetastasen.43 Als Alternative zum CT kann auch die MRI eingesetzt werden. Sie verfügt über eine Sensitivität von ca. 76% und eine Spezifität von ca. 98% für die Bestätigung resp. den Ausschluss eines UTUC im oberen Harntrakt.44
3 Primärtherapie
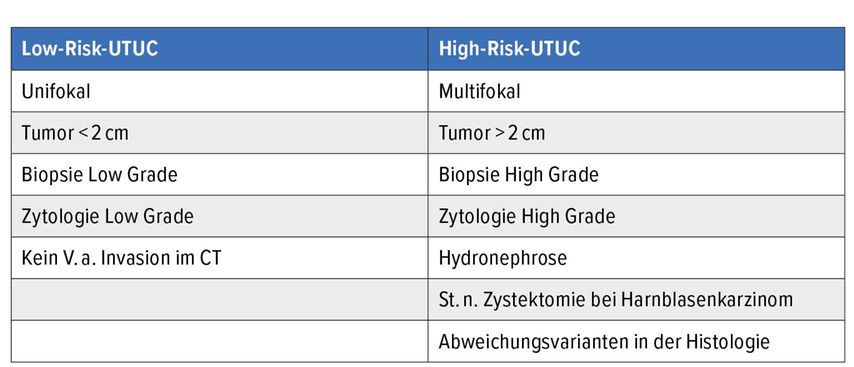
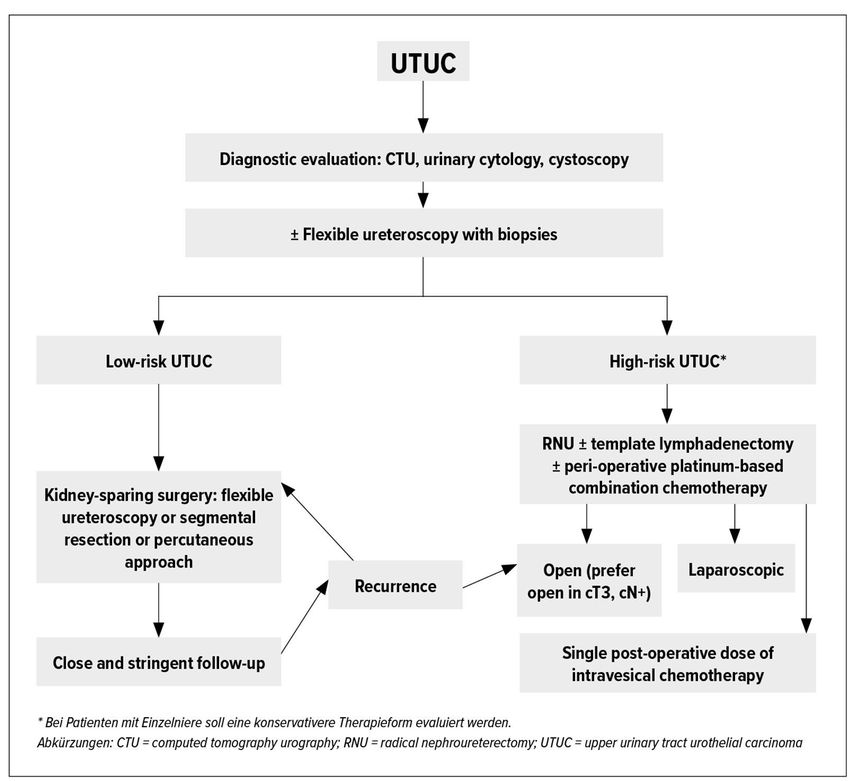
Die therapeutischen Massnahmen können in chirurgische (offene, minimal-invasive vs. endoskopische Eingriffe) und medikamentöse Behandlungen (Chemo- vs. Immuntherapie) eingeteilt werden (siehe Flowchart Abb. 1). Für die korrekte chirurgische Therapiewahl ist die Risikoeinteilung des nicht metastasierten UTUC gemäss EAU-Guidelines in Low Risk vs. High Risk entscheidend (Tab. 2).1
Tab. 2: Risikostratifizierung der nicht metastasierten UTUC in Low und High Risk gemäss EAU-Guidelines
Abb. 1: Überblick über die Erstlinientherapien des metastasierten klarzelligen Nierenzellkarzinoms im zeitlichen Verlauf
3.1 Low-Risk-Tumoren
Bei Low-Risk-Tumoren sollte immer die Option einer nierenerhaltenden Chirurgie (NSS für engl. «nephron-sparing surgery») evaluiert werden. In einem systematischen Review zeigte sich, dass das tumorspezifische Überleben nach endoskopischem Management bei Low-Risk-UTUC mit dem nach der RNU zu vergleichen war, abgesehen von. einem erhöhten Risiko für Lokalrezidive.45 Niereninsuffiziente Patienten haben ein generell schlechteres tumorspezifisches Überleben, ein erhöhtes Risiko für kardiovaskuläre Ereignisse und zusätzlich auch Einschränkungen bei allfällig notwendigen Systemtherapien.45–47 Die Indikation für die NSS kann daher in speziellen Fällen ausgeweitet werden, z.B. bei einer vorbestehenden Niereninsuffizienz oder einer funktionellen/anatomischen Einzelniere. So können die Notwendigkeit einer Dialyse und die oben genannten Nachteile gegebenenfalls umgangen werden.48 Die nierenerhaltende Chirurgie wird beim UTUC entweder endoskopisch oder durch eine Harnleitersegmentresektion (siehe 3.3) erreicht. Die endoskopische Behandlung erfolgt entweder retro- oder anterograd (via perkutane Nierenpunktion) und man verwendet vor allem Laser-gestützte Verfahren zur Tumorablation. In der Studie von Scotland und Kollegen konnte nachgewiesen werden, dass 37% der Patienten mit einem Low-Grade-Tumor nach durchschnittlich 71 Monaten ein Rezidiv entwickelten. Bei High-Grade-Tumoren wurde ein Rezidiv bei 63% der Patienten bereits nach 36 Monaten diagnostiziert.49
Die endoskopische Behandlung birgt die Gefahr einer «Unterbehandlung», da die Entscheidung für eine endoskopische Behandlung in der Regel auf den Ergebnissen von endoskopischen Minibiopsien beruht, die bezüglich T-Stadium und Grading Diskordanzen mit dem tatsächlichen Tumorstadium aufweisen können. Somit ist die endoskopische Behandlung des UTUC insgesamt der RNU onkologisch unterlegen.50,51 Entsprechend sind engmaschige Nachkontrollen (inklusive URS) von endoskopisch behandelten Patienten sehr wichtig.52 Bei Low-Grade-Tumoren liegt die Wahrscheinlichkeit eines Rezidivs bei 4–29%, wobei die endoskopisch behandelten Patienten gegenüber der RNU rund viermal häufiger einen Tumorprogress erleiden (4–42% vs. 0–11%). Bei High-Grade-Tumoren ist der Unterschied dramatisch: In ca. 85% der Fälle kommt es zu einem Rezidiv/Krankheitsprogress nach endoskopischer Therapie im Gegensatz zu nur 11% nach RNU.50 Somit kann eine endoskopische Therapie bei High-Grade-Tumoren nicht empfohlen werden.
3.2 High-Risk-Tumoren
Der Goldstandard in der chirurgischen Therapie bei High-Risk-Tumoren ist die RNU in Kombination mit einer Template-Lymphadenektomie. Die Operation kann entweder offen, konventionell laparoskopisch oder roboterassistiert laparoskopisch erfolgen.48 Es sollte immer die Resektion des gesamten Harnleiters inkl. Uretermündung (sog. Blasenmanschette) erfolgen, da ansonsten ein Ureterstumpf-Rezidiv in 30–45% der Fälle droht, welches schwierig zu therapieren ist.48,53–55 Die konventionelle und die roboterassistierte laparoskopische RNU sind bezüglich der kurz- und langfristigen onkologischen Resultate der offenen Nephroureterektomie nicht unterlegen.56–60 Das offene Vorgehen geht mit längerer Spitalaufenthaltsdauer, mehr Schmerzen und einem erhöhten Blutverlust einher.61,62 Bei lokal fortgeschrittenen oder organüberschreitenden Befunden sollte die offene Operation aber den laparoskopischen Verfahren vorgezogen werden.63,64 Eine Template-basierte Lymphadenektomie sollte bei allen Patienten mit RNU durchgeführt werden, auch wenn bei Ta/T1-Stadien das Risiko einer Lymphknotenmetastase als gering zu betrachten ist.65,66 Die Lymphknoten-Templates unterteilen sich in ein oberes, mittleres und unteres Drittel, wobei für die Resektion unterschiedliche Techniken beschrieben wurden.67–69 Die Lymphadenektomie verringert das Risiko eines Rezidivs bei Patienten mit muskelinvasivem UTUC.69,70
3.3 Harnleitersegmentresektion
Eine nierenerhaltende Therapieform stellt auch die Harnleitersegmentresektion dar. In ausgewählten Fällen können bei isoliert distalen, lokal nicht fortgeschrittenen High-Grade-Harnleitertumoren die distale Harnleitersegmentresektion und die Neuimplantation in der Harnblase als nierenerhaltendes Verfahren angewandt werden. Die Operationstechnik kann entweder offen, konventionell oder roboterassistiert laparoskopisch erfolgen. Die Resultate der Uretersegmentresektion zeigen im Vergleich mit der RNU keine relevanten Unterschiede, was das Gesamtüberleben betrifft, und sie kann deshalb bei der Wahl der Therapieform berücksichtigt werden.71,72 Bei distalen Harnleiterresektionen kann mittels Psoas Hitch oder Boari Flap eine Ureterozystoneostomie erreicht werden.
3.4 Adjuvante Therapien
Postoperative, adjuvante Chemoinstillation
Nach Behandlung eines UTUC kommt es in rund 22–47% der Fälle zu einem Rezidiv in der Harnblase, wobei der kontralaterale, obere Harntrakt in nur 2–6% betroffen ist.8,54 Um ein intravesikales Rezidiv nach chirurgischer Behandlung zu verhindern, wurde die Wirkung einer einmaligen intravesikalen Instillationstherapie mit Mitomycin C (MMC) unmittelbar nach RNU in einer prospektiv-randomisierten Studie (ODMIT-C Trial) untersucht.73 Dabei zeigte sich eine signifikante absolute Risikoreduktion für das Auftreten eines Blasentumors innerhalb eines Jahres von 11% (relatives Risiko 40%) in der Instillationsgruppe gegenüber der Beobachtungsgruppe. Diese Resultate wurden in einer Metaanalyse bestätigt,74 sodass die postoperative Instillationstherapie empfohlen werden kann.
Adjuvante Chemotherapie
Für die adjuvante Chemotherapie nach RNU konnten Vorteile bezüglich des tumorfreien, tumorspezifischen und Gesamtüberlebens im Vergleich zur alleinigen RNU gezeigt werden.75 Limitierend für die adjuvante Chemotherapie ist der Umstand, dass viele Patienten mit einer eingeschränkten Nierenfunktion aus der chirurgischen Therapie hervorgehen und somit oft keine Cisplatin-haltige Chemotherapie infrage kommt.76 Birtle und Kollegen haben in einer prospektiv-randomisierten Studie (POUT-Trial) nachweisen können, dass bei Patienten mit lokal fortgeschrittenem UTUC (pT2–4 pN0–3 cM0 oder pT1–4 pN1–3 cM0) die adjuvante platinhaltige Chemotherapie der alleinigen «surveillance» nach RNU in allen Endpunkten überlegen war.77 Untersucht wurden die Rezidivrate, die Todesrate und das krankheits- und metastasenfreie Überleben über einen medianen Zeitraum von 30 Monaten. Bei Patienten mit einer eingeschränkten Nierenfunktion (GFR <50ml/min) wurde anstelle einer Cisplatin-basierten eine Carboplatin-basierte Chemotherapie durchgeführt. Die 3-Jahres-Zahlen zeigten ein eventfreies Überleben von 71% in der Chemotherapie-Gruppe bei nur 46% der «Surveillance»-Kohorte. Diese Daten unterstützen die Empfehlung einer adjuvanten, platinhaltigen Chemotherapie innerhalb von 90 Tagen nach der RNU bei Patienten mit High-Risk-UTUC.
Neoadjuvante Chemotherapie
Bei der neoadjuvanten, platinhaltigen Chemotherapie (Gemcitabin-Cisplatin oder Gemcitabin-Carboplatin) konnten verschiedene retrospektive Studien vielversprechende Resultate bei High-Risk-UTUC betreffend pathologisches «downstaging», komplette Remission, Rezidivraten und Mortalität nach RNU zeigen.78–81 Die Evidenzlage ist in diesem Zusammenhang jedoch nach wie vor schwach und Resultate von prospektiven Vergleichsstudien liegen noch nicht vor.
3.5 Rolle der Immuntherapie
Der Einsatz der Immuntherapie beim Urothelkarzinom mit z.B. Pembrolizumab oder Atezolizumab wird momentan in zahlreichen prospektiven Studien untersucht. Die Wirksamkeit der Immuntherapie beim UCa konnte bereits in mehreren Studien nachgewiesen werden. Zwei prospektive Studien zum metastasierten Urothelkarzinom bei Cisplatin-ungeeigneten Patienten zeigen eine objektive (partielle oder komplette) Ansprechrate von 23% respektive 24% nach medianem Follow-up von 5 und 17 Monaten.82,83 Aktuell beschränkt sich der Einsatz aufgrund der noch ungenügenden Datenlage auf Patienten, die lokal fortgeschritten oder bereits metastasiert sind, keine Cisplatin-haltige Chemotherapie erhalten dürfen oder unter/nach Chemotherapie einen Progress der Erkrankung erfahren haben. Bei der Immuntherapie des UTUC wird eine Extrapolation der Behandlungsempfehlungen vom BCa beobachtet. Die Resultate von verschiedenen Phase-III-Studien zu weiteren First-Line-Immuntherapien und deren Kombinationen müssen erst noch abgewartet werden. Der Effekt von neueren Therapien wie der Anwendung von Chemoimmunkonjugaten (sogenannte «antibody-drug conjugates» wie z.B. Enfortumab oder Sacituzumab) oder FGFR-Inhibitoren (z.B. Erdafitinib) wird zurzeit im Rahmen von klinischen Phase-II/III-Studien ebenfalls noch weiter untersucht.
4 Nachsorge
Die Nachsorge erfolgt gemäss EAU-Guidelines entsprechend der Risikoeinteilung in Low- vs. High-Risk-Tumoren und unterscheidet sich nach RNU oder NSS nur leichtgradig. Entscheidend sind diagnostische Zystoskopien inklusive Spülzytologien bei allen Patienten, um Rezidive in der Harnblase nicht zu verpassen. Nach erfolgter NSS ist in der Nachsorge zudem die diagnostische URS der behandelten Seite wichtig, um ein endoluminales Rezidiv frühzeitig erkennen zu können. Bei High-Risk-Tumoren müssen zudem regelmässig CT oder MRI von Abdomen und Thorax durchgeführt werden, um ein Lokalrezidiv, Lymphknoten- und/oder Fernmetastasen auszuschliessen.1
5 Prognose
Die Prognose von Patienten mit pTa/pT1- und Low-Grade-Tumoren ist relativ gut. Das 5-Jahres-Überleben liegt in populationsbasierten Untersuchungen bei über 90%. Deutlich schlechter sind die Aussichten bei muskelinvasivem UTUC: Das 5-Jahres-Überleben bei pT2/pT3- ist <50% und bei pT4-Tumoren nur noch <10%.84–87 Verschiedene Studien konnten zeigen, dass sich folgende Parameter negativ auf das tumorspezifische Überleben bei UTUC auswirken: Alter >65 Jahre, simultan vorliegender Blasentumor, simultan vorliegende Ureter- und Nierenbeckentumoren, Hydronephrose und aggressivere histologische Eigenschaften des Tumors (lymphovaskuIäre Invasion, höheres T-Stadium oder Grading, Lymphknotenmetastasen oder eine divergente Histologie).88,89
6 Fazit
Obwohl das UTUC eine eher seltene Erkrankung ist, gibt es wegen der Ähnlichkeit zum BCa klare Guidelines zu dessen Behandlung. Low-Risk-Tumoren können bei guter Sicherheit oft organerhaltend therapiert werden. Bei den High-Risk-Tumoren ist eine Reihe von Therapieempfehlungen zu berücksichtigen, welche leider nicht immer konsequent befolgt werden. Dabei sind die komplette Resektion des Harnleiters inklusive der Blasenmanschette und die reguläre Lymphadenektomie im Rahmen der RNU sowie auch die adjuvante Chemotherapie mitsamt den Chemoinstillationen relevant, um ein optimales Resultat erzielen zu können. Die Immuntherapie wird mit grosser Wahrscheinlichkeit das Management des UTUC in Zukunft weiter verändern und hoffentlich auch das Outcome der Patienten, insbesondere bei High-Risk-Fällen, weiter verbessern.
Literatur:
1 Roupret M et al.: European Association of Urology Guidelines on upper urinary tract urothelial carcinoma: 2020 update. Eur Urol 2021; 79(1): 62-79 2 Raman JD et al.: Incidence and survival of patients with carcinoma of the ureter and renal pelvis in the USA, 1973-2005. BJU Int 2011; 107(7): 1059-64 3 Soria F et al.: Epidemiology, diagnosis, preoperative evaluation and prognostic assessment of upper-tract urothelial carcinoma (UTUC). World J Urol 2017; 35(3): 379-87 4 Siegel RL et al.: Cancer statistics, 2019. CA Cancer J Clin 2019; 69(1): 7-34 5 Favaretto RL et al.: The effect of tumor location on prognosis in patients treated with radical nephroureterectomy at Memorial Sloan-Kettering Cancer Center. Eur Urol 2010; 58(4): 574-80 6 Green DA et al.: Urothelial carcinoma of the bladder and the upper tract: disparate twins. J Urol 2013; 189(4): 1214-21 7 Cosentino M et al.: Upper urinary tract urothelial cell carcinoma: location as a predictive factor for concomitant bladder carcinoma. World J Urol 2013; 31(1): 141-5 8Xylinas E et al.: Multifocal carcinoma in situ of the upper tract is associated with high risk of bladder cancer recurrence. Eur Urol 2012; 61(5): 1069-70 9 Rouprêt M et al.: Upper urinary tract urothelial cell carcinomas and other urological malignancies involved in the hereditary nonpolyposis colorectal cancer (lynch syndrome) tumor spectrum. Eur Urol 2008; 54(6): 1226-36 10 Koornstra JJ et al.: Management of extracolonic tumours in patients with Lynch syndrome. Lancet Oncol 2009; 10(4): 400-8 11 Colin P et al.: Environmental factors involved in carcinogenesis of urothelial cell carcinomas of the upper urinary tract. BJU Int 2009; 104(10): 1436-40 12 McLaughlin JK et al.: Cigarette smoking and cancers of the renal pelvis and ureter. Cancer Res 1992; 52(2): 254-7 13 Rink M et al.: Impact of smoking on oncologic outcomes of upper tract urothelial carcinoma after radical nephroureterectomy. Eur Urol 2013; 63(6): 1082-90 14 Shinka T et al.: Factors affecting the occurrence of urothelial tumors in dye workers exposed to aromatic amines. Int J Urol 1995; 2(4): 243-8 15 Chen CH et al.: Aristolochic acid-associated urothelial cancer in Taiwan. Proc Natl Acad Sci U S A 2012; 109(21): 8241-6 16 Crivelli JJ et al.: Effect of smoking on outcomes of urothelial carcinoma: a systematic review of the literature. Eur Urol 2014; 65(4): 742-54 17 Koutros S et al.: Potential effect modifiers of the arsenic-bladder cancer risk relationship. Int J Cancer 2018; 143(11): 2640-6 18 Steinmaus C et al.: Increased lung and bladder cancer incidence in adults after in utero and early-life arsenic exposure. Cancer Epidemiol Biomarkers Prev 2014; 23(8): 1529-38 19 Babjuk M et al.: European Association of Urology Guidelines on non-muscle-invasive bladder cancer (TaT1 and carcinoma in situ) - 2019 update. Eur Urol 2019; 76(5): 639-57 20 Dobruch J et al.: Gender and bladder cancer: a collaborative review of etiology, biology, and outcomes. Eur Urol 2016; 69(2): 300-10 21 Skeldon SC et al.: Patients with Lynch syndrome mismatch repair gene mutations are at higher risk for not only upper tract urothelial cancer but also bladder cancer. Eur Urol 2013; 63(2): 379-85 22 Audenet F et al.: Clonal relatedness and mutational differences between upper tract and bladder urothelial carcinoma. Clin Cancer Res 2019; 25(3): 967 23 Jung H et al.: Association of hematuria on microscopic urinalysis and risk of urinary tract cancer. J Urol 2011; 185(5): 1698-703 24 Fankhauser CD et al.: Diagnostic accuracy of ultrasonography, computed tomography, cystoscopy and cytology to detect urinary tract malignancies in patients with asymptomatic hematuria. World J Urol 2021; 39(1): 97-103 25 Inman BA et al.: Carcinoma of the upper urinary tract: predictors of survival and competing causes of mortality. Cancer 2009; 115(13): 2853-62 26 Raman JD et al.: Does preoperative symptom classification impact prognosis in patients with clinically localized upper-tract urothelial carcinoma managed by radical nephroureterectomy? Urol Oncol 2011; 29(6): 716-23 27Olgac S et al.: Urothelial carcinoma of the renal pelvis: a clinicopathologic study of 130 cases. Am J Surg Pathol 2004; 28(12): 1545-52 28 Perez-Montiel D et al.: High-grade urothelial carcinoma of the renal pelvis: clinicopathologic study of 108 cases with emphasis on unusual morphologic variants. Mod Pathol 2006; 19(4): 494-503 29 Kim JK et al.: Variant histology as a significant predictor of survival after radical nephroureterectomy in patients with upper urinary tract urothelial carcinoma. Urol Oncol 2017; 35(7): 458. e9-e15 30 Desai FS J et al.: Retrospective evaluation of risk factors and immunohistochemical findings for pre-neoplastic and neoplastic lesions of upper urinary tract in patients with chronic nephrolithiasis. Asian Pac J Cancer Prev 2015; 16(18): 8293-8 31 Sakano S et al.: Impact of variant histology on disease aggressiveness and outcome after nephroureterectomy in Japanese patients with upper tract urothelial carcinoma. Int J Clin Oncol 2015; 20(2): 362-8 32 Mori K et al.: Prognostic value of variant histology in upper tract urothelial carcinoma treated with nephroureterectomy: a systematic review and meta-analysis. J Urol 2020; 203(6): 1075-84 33 Zamboni S et al.: Incidence and survival outcomes in patients with upper urinary tract urothelial carcinoma diagnosed with variant histology and treated with nephroureterectomy. BJU Int 2019; 124(5): 738-45 34 Rojas CP et al.: Low biopsy volume in ureteroscopy does not affect tumor biopsy grading in upper tract urothelial carcinoma. Urol Oncol 2013; 31(8): 1696-700 35 Subiela JD et al.: Diagnostic accuracy of ureteroscopic biopsy in predicting stage and grade at final pathology in upper tract urothelial carcinoma: systematic review and meta-analysis. Eur J Surg Oncol 2020; 46(11): 1989-97 36 Clements T et al.: High-grade ureteroscopic biopsy is associated with advanced pathology of upper-tract urothelial carcinoma tumors at definitive surgical resection. J Endourol 2012; 26(4): 398-402 37 Messer J et al.: Urinary cytology has a poor performance for predicting invasive or high-grade upper-tract urothelial carcinoma. BJU Int 2011; 108(5): 701-5 38 Marchioni M et al.: Impact of diagnostic ureteroscopy on intravesical recurrence in patients undergoing radical nephroureterectomy for upper tract urothelial cancer: a systematic review and meta-analysis. BJU Int 2017; 120(3): 313-9 39 Lee HY et al.: The diagnostic ureteroscopy before radical nephroureterectomy in upper urinary tract urothelial carcinoma is not associated with higher intravesical recurrence. World J Surg Oncol 2018; 16(1): 135 40 Cowan NC: CT urography for hematuria. Nat Rev Urol 2012; 9(4): 218-26 41 Chlapoutakis K et al.: Performance of computed tomographic urography in diagnosis of upper urinary tract urothelial carcinoma, in patients presenting with hematuria: systematic review and meta-analysis. Eur J Radiol 2010; 73(2): 334-8 42 Fritz GA et al.: Multiphasic multidetector-row CT (MDCT) in detection and staging of transitional cell carcinomas of the upper urinary tract. Eur Radiol 2006; 16(6): 1244-52 43 Verhoest G et al.: Predictive factors of recurrence and survival of upper tract urothelial carcinomas. World J Urol 2011; 29(4): 495-501 44 Takahashi N et al.: Gadolinium enhanced magnetic resonance urography for upper urinary tract malignancy. J Urol 2010; 183(4): 1330-65 45 Seisen T et al.: Oncologic outcomes of kidney-sparing surgery versus radical nephroureterectomy for upper tract urothelial carcinoma: a systematic review by the EAU Non-muscle Invasive Bladder Cancer Guidelines Panel. Eur Urol 2016; 70(6): 1052-68 46 Weight CJ et al.: Nephrectomy induced chronic renal insufficiency is associated with increased risk of cardiovascular death and death from any cause in patients with localized cT1b renal masses. J Urol 2010; 183(4): 1317-23 47 Campos-Sanudo JA et al.: Impact of radical nephrectomy on kidney function and prognostic factors for adverse cardiovascular events. Actas Urol Esp 2020; 44(4): 239-44 48 Gakis G et al.: Update of the ICUD-SIU consultation on upper tract urothelial carcinoma 2016: treatment of localized high-risk disease. World J Urol 2017; 35(3): 327-35 49 Scotland KB et al.: Ureteroscopic management of large >/=2cm upper tract urothelial carcinoma: a comprehensive 23-year experience. Urology 2018; 121: 66-73 50 Cutress ML et al.: Endoscopic versus laparoscopic management of noninvasive upper tract urothelial carcinoma: 20-year single center experience. J Urol 2013; 189(6): 2054-60 51 Vemana G et al.: Survival comparison between endoscopic and surgical management for patients with upper tract urothelial cancer: a matched propensity score analysis using surveillance, epidemiology and end results-Medicare data. Urology 2016; 95: 115-20 52 Villa L et al.: Early repeated ureteroscopy within 6-8 weeks after a primary endoscopic treatment in patients with upper tract urothelial cell carcinoma: preliminary findings. World J Urol 2016; 34(9): 1201-6 53 Lughezzani G et al.: Should bladder cuff excision remain the standard of care at nephroureterectomy in patients with urothelial carcinoma of the renal pelvis? Apopulation-based study. Eur Urol 2010; 57(6): 956-62 54 Li WM et al.: Oncologic outcomes following three different approaches to the distal ureter and bladder cuff in nephroureterectomy for primary upper urinary tract urothelial carcinoma. Eur Urol 2010; 57(6): 963-9 55 Xylinas E et al.: Impact of distal ureter management on oncologic outcomes following radical nephroureterectomy for upper tract urothelial carcinoma. Eur Urol 2014; 65(1): 210-7 56 Favaretto RL et al.: Comparison between laparoscopic and open radical nephroureterectomy in a contemporary group of patients: Are recurrence and disease-specific survival associated with surgical technique? Eur Urol 2010; 58(5): 645-51 57 Ni S et al.: Laparoscopic versus open nephroureterectomy for the treatment of upper urinary tract urothelial carcinoma: a systematic review and cumulative analysis of comparative studies. Eur Urol 2012; 61(6): 1142-53 58 Walton TJ et al.: Oncological outcomes after laparoscopic and open radical nephroureterectomy: results from an international cohort. BJU Int 2011; 108(3): 406-12 59 Aboumohamed AA et al.: Oncologic outcomes following robot-assisted laparoscopic nephroureterectomy with bladder cuff excision for upper tract urothelial carcinoma. J Urol 2015; 194(6): 1561-6 60 Clements MB et al.: Robotic-assisted surgery for upper tract urothelial carcinoma: a comparative survival analysis. Ann Surg Oncol 2018; 25(9): 2550-62 61 Raman JD, Jafri SM: Complications following radical nephroureterectomy. Curr Urol Rep 2016; 17(5): 36 62 Rosiello G et al.: Preoperative frailty predicts adverse short-term postoperative outcomes in patients treated with radical nephroureterectomy. J Surg Oncol 2020; 121(4): 688-96 63 Simone G et al.: Laparoscopic versus open nephroureterectomy: perioperative and oncologic outcomes from a randomised prospective study. Eur Urol 2009; 56(3): 520-6 64 Peyronnet B et al.: Oncological outcomes of laparoscopic nephroureterectomy versus open radical nephroureterectomy for upper tract urothelial carcinoma: an European Association of Urology Guidelines systematic review. Eur Urol Focus 2019; 5(2): 205-23 65 Xylinas E et al.: Prediction of true nodal status in patients with pathological lymph node negative upper tract urothelial carcinoma at radical nephroureterectomy. J Urol 2013; 189(2): 468-73 66 Zareba P et al.: Association between lymph node yield and survival among patients undergoing radical nephroureterectomy for urothelial carcinoma of the upper tract. Cancer 2017; 123(10): 1741-50 67 Kondo T et al.: Template-based lymphadenectomy in urothelial carcinoma of the renal pelvis: a prospective study. Int J Urol 2014; 21(5): 453-9 68 Matin SF et al.: Patterns of lymphatic metastases in upper tract urothelial carcinoma and proposed dissection templates. J Urol 2015; 194(6): 1567-74 69 Dominguez-Escrig JL et al.: Potential benefit of lymph node dissection during radical nephroureterectomy for upper tract urothelial carcinoma: a systematic review by the European Association of Urology Guidelines Panel on non-muscle-invasive bladder cancer. Eur Urol Focus 2019; 5(2): 224-41 70 Dong F et al.: Lymph node dissection could bring survival benefits to patients diagnosed with clinically node-negative upper urinary tract urothelial cancer: a population-based, propensity score-matched study. Int J Clin Oncol 2019; 24(3): 296-305 71 Colin P et al.: Comparison of oncological outcomes after segmental ureterectomy or radical nephroureterectomy in urothelial carcinomas of the upper urinary tract: results from a large French multicentre study. BJU Int 2012; 110(8): 1134-41 72 Jeldres C et al.: Segmental ureterectomy can safely be performed in patients with transitional cell carcinoma of the ureter. J Urol 2010; 183(4): 1324-9 73 O’Brien T et al.: Prevention of bladder tumours after nephroureterectomy for primary upper urinary tract urothelial carcinoma: aprospective, multicentre, randomised clinical trial of a single postoperative intravesical dose of mitomycin C (the ODMIT-C Trial). Eur Urol 2011; 60(4): 703-10 74 Fang D et al.: Prophylactic intravesical chemotherapy to prevent bladder tumors after nephroureterectomy for primary upper urinary tract urothelial carcinomas: a systematic review and meta-analysis. Urol Int 2013; 91(3): 291-6 75Leow JJ et al.: Neoadjuvant and adjuvant chemotherapy for upper tract urothelial carcinoma: a 2020 systematic review and meta-analysis, and future perspectives on systemic therapy. Eur Urol 2021; 79(5): 635-54 76 Kaag MG et al.: Changes in renal function following nephroureterectomy may affect the use of perioperative chemotherapy. Eur Urol 2010; 58(4): 581-7 77 Birtle A et al.: Adjuvant chemotherapy in upper tract urothelial carcinoma (the POUT trial): a phase 3, open-label, randomised controlled trial. Lancet 2020; 395(10232): 1268-77 78 Almassi N et al.: Impact of neoadjuvant chemotherapy on pathologic response in patients with upper tract urothelial carcinoma undergoing extirpative surgery. Clin Genitourin Cancer 2018; 16(6): e1237-42 79 Liao RS et al.: Comparison of pathological stage in patients treated with and without neoadjuvant chemotherapy for high risk upper tract urothelial carcinoma. J Urol 2018; 200(1): 68-73 80 Matin SF et al.: Incidence of downstaging and complete remission after neoadjuvant chemotherapy for high-risk upper tract transitional cell carcinoma. Cancer 2010; 116(13): 3127-34 81 Meng X et al.: High response rates to neoadjuvant chemotherapy in high-grade upper tract urothelial carcinoma. Urology 2019; 129: 146-52 82 Balar AV et al.: First-line pembrolizumab in cisplatin-ineligible patients with locally advanced and unresectable or metastatic urothelial cancer (KEYNOTE-052): a multicentre, single-arm, phase 2 study. Lancet Oncol 2017; 18(11): 1483-92 83 Balar AV et al.: Atezolizumab as first-line treatment in cisplatin-ineligible patients with locally advanced and metastatic urothelial carcinoma: a single-arm, multicentre, phase 2 trial. Lancet 2017; 389(10064): 67-76 84 Lughezzani G et al.: Prognostic factors in upper urinary tract urothelial carcinomas: a comprehensive review of the current literature. Eur Urol 2012; 62(1): 100-14 85 Wang Q et al.: Prognosis and risk factors of patients with upper urinary tract urothelial carcinoma and postoperative recurrence of bladder cancer in central China. BMC Urol 2019; 19(1): 24 86 Li WM et al.: The prognostic predictors of primary ureteral transitional cell carcinoma after radical nephroureterectomy. J Urol 2009; 182(2): 451-8 87 Lughezzani G et al.: Nephroureterectomy and segmental ureterectomy in the treatment of invasive upper tract urothelial carcinoma: apopulation-based study of 2299 patients. Eur J Cancer 2009; 45(18): 3291-7 88 Zeng S et al.: Development and external validation of a nomogram predicting prognosis of upper tract urothelial carcinoma after radical nephroureterectomy. Urol Oncol 2019; 37(4): 290. e17-24 89 Margulis V et al.: Outcomes of radical nephroureterectomy: a series from the Upper Tract Urothelial Carcinoma Collaboration. Cancer 2009; 115(6): 1224-33
Das könnte Sie auch interessieren:
Adjuvantes Osimertinib reduziert ZNS-Rezidive bei EGFR-mutierter Erkrankung
Etwa 30% der Patienten mit nicht kleinzelligem Lungenkarzinom (NSCLC) präsentieren sich mit resezierbarer Erkrankung und werden einer kurativen Operation unterzogen. Viele Patienten ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...