Den molekularen Code des Endometriumkarzinoms entziffern
Autorin:
PD Dr. med. Simone Münst Soysal
Institut für Pathologie und medizinische Genetik
Universitätsspital Basel
E-Mail: simone.muenst@usb.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die Entdeckung unterschiedlicher molekularer Subtypen des Endometriumkarzinoms hat zu tiefgreifenden Veränderungen in Diagnostik und Therapie dieser Erkrankung geführt. Eine molekulare Subtypisierung durch die Pathologie ist heute unabdingbar für die Einschätzung der Prognose sowie die weitere Therapieplanung. Hier ein Update zu den wichtigsten diagnostischen Prozessen im Rahmen dieser Subtypisierung, ihren Resultaten und ihrer Interpretation im klinischen Alltag.
Keypoints
-
Endometriumkarzinome stellen keine einheitliche Erkrankung dar, sondern bestehen aus mindestens vier unterschiedlichen molekularen Subtypen.
-
Die molekulare Subtypisierung soll unabhängig vom histologischen Subtyp oder Grading des Karzinoms erfolgen.
-
Es gibt Karzinome, welche mehr als ein Merkmal einer molekularen Subgruppe aufweisen (sogenannte «Multiple classifier»-Endometriumkarzinome). Bei diesen scheint die jeweils prognostisch günstigere Subgruppe entscheidend zu sein (POLE>MSI>p53).
-
Es laufen aktuelle Studien zur Individualisierung der adjuvanten Behandlung auf der Grundlage der molekularen Subtypisierung.
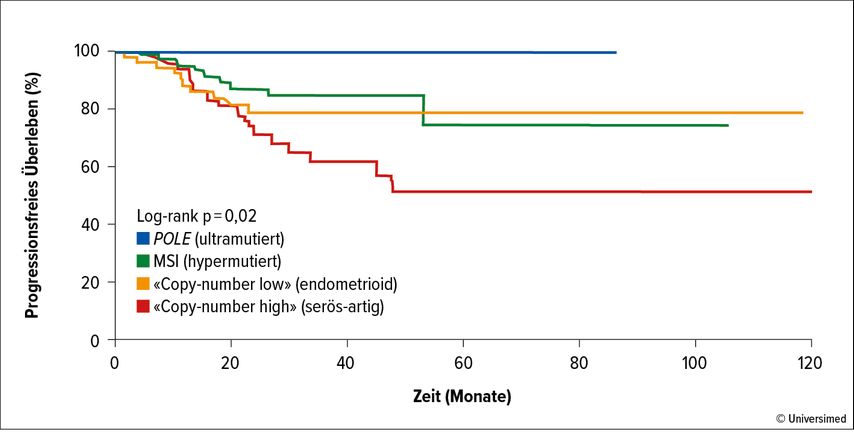
Bis vor einigen Jahren haben wir uns für die Einschätzung der Prognose und die Therapieplanung bei Endometriumkarzinomen hauptsächlich auf den histologischen Subtyp, die Differenzierung sowie das Stadium verlassen. Vor 10 Jahren zeigte die wichtige Publikation des «Cancer Genome Atlas»(TCGA)-Forschungsnetzwerkes jedoch, dass es sich beim Endometriumkarzinom nicht um eine einheitliche Erkrankung, sondern vielmehr um vier eigenständige molekulare Subtypen handelt, welche sich bezüglich ihrer Prognose signifikant unterscheiden (Abb. 1).1 Diese vier Subtypen sind:
-
POLE(DNA-Polymerase-Epsilon)-ultramutierte Karzinome (ca. 10%),
-
mikrosatelliteninstabile Karzinome (ca. 30%) ,
-
«Copy number high» (ca. 10%) und
-
«Copy number low»(CNL)-Karzinome (ca. 50%) .2
Abb. 1: Die Karzinome wurden in vier Subtypen stratifiziert. POLE-ultramutierte Tumoren zeigen das signifikant längste PFS, «Copy-number high»-Tumore das kürzeste. Modifiziert nach Cancer Genome Atlas Research Network et al.1
Am histologischen Schnitt lassen sich diese vier Subtypen nicht unterscheiden, und auch aufgrund des Differenzierungsgrades und des histologischen Subtyps ist bezüglich der molekularen Einteilung keine Aussage möglich.
Während die POLE-ultramutierten Karzinome eine exzellente Prognose haben, zeigen diejenigen aus der «Copy number high»-Gruppe einen sehr aggressiven klinischen Verlauf.1 Die mikrosatelliteninstabilen Karzinome sowie die der CNL-Gruppe haben eine intermediäre Prognose.
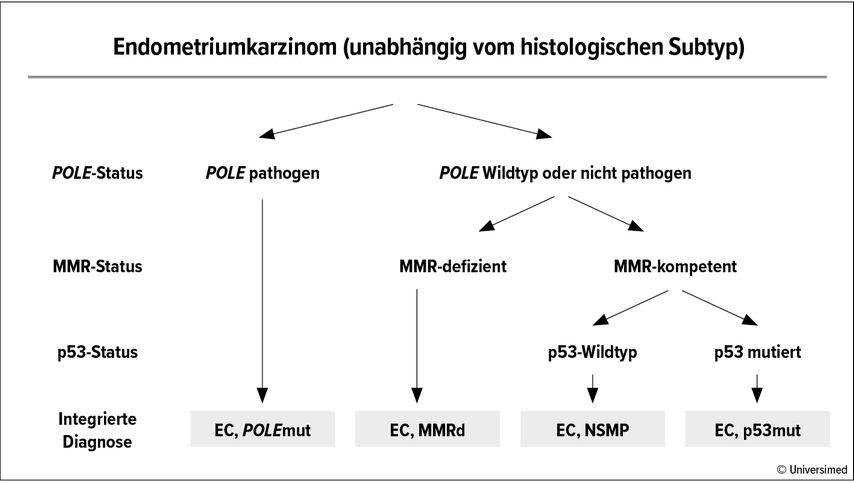
Eine molekulare Subtypisierung aller Endometriumkarzinome bei Diagnosestellung ist daher essenziell und wird in der aktuellen WHO-Klassifikation der Tumoren des weiblichen Genitaltraktes von 2020 auch für alle Endometriumkarzinome, und zwar unabhängig vom histologischen Subtyp, empfohlen.3 Dazu schlägt die WHO ein Schema mit konsekutiver Abklärung von POLE, Mikrosatellitenstabilität und p53-Expression vor (Abb. 2).3 In der diagnostischen Routine werden jedoch meist alle Analysen zum gleichen Zeitpunkt veranlasst, idealerweise am in der Kürettage gewonnenen Gewebe, da hier die Fixation optimal ist. Im Folgenden soll auf die einzelnen Abklärungsschritte näher eingegangen werden.
Abb. 2: Diagnosealgorithmus für die integrierte molekulare Klassifizierung des Endometriumkarzinoms (EC). MMR: «mismatch repair»; NSMP: «no specific molecular profile». Nach Bosse T in der WHO Classification of Tumours3
POLE-Mutationsanalyse
POLE ist eine DNA-Polymerase mit einer Korrekturlese-Domäne (Exonuklease), welche die Erkennung und Exzision von Basenfehlpaarungen bei der DNA-Replikation ermöglicht.4 Bei einer «Loss of function»-Mutation des POLE-Gens kommt es durch die fehlende Korrekturlesung zu einer Ansammlung von Mutationen und in der Folge zu einem sogenannten ultramutierten Endometriumkarzinom. Die hohe Zahl an Mutationen führt zu einer verstärkten Expression von Tumor-assoziierten Antigenen, welche durch das Immunsystem erkannt werden. Dies ermöglicht eine gute und gezielte Immunreaktion gegen diese ultramutierten Tumoren, was der Grund dafür ist, das diese Karzinome trotz häufig schlechter Differenzierung und des Vorliegens von Gefässeinbrüchen auch in höheren Stadien eine exzellente Prognose haben.4
Der Nachweis einer POLE-Mutation erfolgt über Next-Generation Sequencing (NGS) oder, seltener, über eine Sanger-Sequenzierung. Wichtig ist, dass bisher nur 11 pathogene Mutationen des POLE-Gens bekannt sind, welche in den Exonen 9, 11, 13 und 14 liegen.5 Wird in der NGS-Analyse eine Mutation nachgewiesen, welche nicht zu diesen 11 pathogenen Mutationen gehört, fällt das Endometriumkarzinom nicht in die POLE-ultramutierte Gruppe. Aus diesem Grund ist es entscheidend, dass die Ergebnisse der POLE-Mutationsanalyse von einer/einem erfahrenen Molekularpathologen/-patholog*in interpretiert werden, um eine falsche Zuordnung des Karzinoms zu vermeiden. Bisher gibt es keinen Surrogatmarker für das Vorliegen einer POLE-Mutation, welcher immunhistochemisch nachgewiesen werden könnte.
Abklärung auf Mikrosatelliteninstabilität
Liegt keine pathogene POLE-Mutation vor, folgt als Nächstes die Analyse der DNA-Reparaturproteine mittels Immunhistochemie. Die DNA-Reparaturproteine umfassen MLH1 und PMS2 sowie MSH2 und MSH2, welche als Heterodimere in der Zelle vorliegen und daher jeweils paarweise ausfallen.5,6 Bei fehlender nukleärer Expression eines dieser beiden Paare liegt ein mikrosatelliteninstabiles (MSI) Karzinom vor. Dies bedeutet, dass die DNA-Reparatur nicht korrekt ablaufen kann, was ebenfalls zu einer Akkumulation von Mutationen führt.
Bei einem Verlust von MLH1 muss in einem zweiten Schritt zwingend zwischen einem somatischen Ausfall, bedingt durch eine Hypermethylierung des MHL1-Promotors, und einer Mutation des MLH1-Gens unterschieden werden. Dies geschieht mittels einer MLH1-Methylierungsanalyse. Liegt, wie in über 90% der Fälle, eine MLH1-Hypermethylierung vor, ist von einem sporadischen, mikrosatelliteninstabilen Karzinom auszugehen.7 Fehlt jedoch eine solche MLH1-Methylierung, oder liegt ein Verlust eines anderen DNA-Reparaturproteins (PMS2, MSH2 oder MSH6) vor, besteht der Verdacht auf ein Lynch-Syndrom, und der Patientin sollte eine humangenetische Beratung angeboten werden.
Die Internationale Gesellschaft für gynäkologische Pathologie (ISGyP) empfiehlt eine MSI-Testung in allen Endometriumkarzinomen, da sie einerseits von prognostischer Bedeutung ist, andererseits aber auch Patientinnen mit Lynch-Syndrom identifiziert werden können. Zudem ist eine MSI prädiktiv für das Ansprechen auf Immun-Checkpoint-Inhibitoren wie Pembrolizumab.5 Interessanterweise wurde kürzlich in einer kleinen Fallserie von 24 Endometriumkarzinompatientinnen gezeigt, dass alle 6 Patientinnen mit einem zugrunde liegenden Lynch-Syndrom auf die Therapie mit Pembrolizumab ansprachen, jedoch nur 44% der Patientinnen mit einer MLH1-Hypermethylierung (n=18).8
Analyse der p53-Expression
Ist das Karzinom mikrosatellitenstabil und weist keine pathogene POLE-Mutation auf, wird in einem letzten Schritt die Expression von p53 untersucht. Dies geschieht ebenfalls mittels Immunhistochemie.
In der originalen TCGA-Publikation von 2013 wurde zunächst die «Copy number high»-Kategorie beschrieben, die mit serösen und wenig differenzierten endometrioiden Endometriumkarzinomen sowie mit TP53-Mutationen korrelierte.1 Darüber hinaus gibt es molekulare Ähnlichkeiten zwischen dieser «Copy number high»-Gruppe und serösen «High grade»-Tubo-Ovarial-Karzinomen sowie tripelnegativen Mammakarzinomen, welche alle durch das Vorhandensein von TP53-Mutationen gekennzeichnet sind.9 In der ProMisE-Studie wurde gezeigt, dass eine abnorme p53-Expression in der Immunhistochemie ein adäquates Surrogat für diese «Copy number high»-Gruppe darstellt,2 mit einer starken Korrelation zwischen einer aberranten p53-Expression und der durch Sequenzierung ermittelten TP53-Mutation, wenn die p53-Immunhistochemie an der Endometriumkürettage gemacht wird.10,11
Das normale oder «Wildtyp»-Färbemuster von p53 zeigt ein buntes Bild mit positiven und negativen Zellkernen. Daneben gibt es drei mögliche pathogene Expressionsmuster. Das häufigste ist eine starke Färbung aller Zellkerne, welche auf eine Missense-Mutation des TP53-Gens zurückzuführen ist. Seltener ist ein kompletter Verlust der Färbung (sogenanntes «Null-Muster»), bedingt durch eine deletierende Mutation des Gens. Das seltenste aberrante Färbemuster schliesslich ist eine zytoplasmatische Färbung, welche ebenfalls meist durch eine Missense-Mutation bedingt ist.11 Seltenerweise kommt es nur zu einer herdförmigen pathologischen Expression von p53 innerhalb des Tumors, welche meist durch eine subklonale TP53-Mutation bedingt ist. Auf diesen speziellen Fall wird später im Artikel noch eingegangen.
Die Identifizierung der Patientinnen mit einem p53-aberranten Endometriumkarzinom ist sehr wichtig, da diese Karzinome, obwohl sie nur etwa 10% aller Endometriumkarzinome ausmachen, für bis zu 70% aller Endometriumkarzinom-assoziierten Todesfälle verantwortlich sind.2 Zudem konnte gezeigt werden, dass diese Patientinnen von einer platinhaltigen Chemotherapie profitieren.12
Die CNL-Gruppe
Falls das Endometriumkarzinom nach allen oben beschriebenen Analysen keiner der besprochenen Gruppen zuzuordnen ist (keine pathogene POLE-Mutation, mikrosatellitenstabil, keine aberrante p53-Expression), fällt es in die sogenannte «Copy number low»(CNL)- oder auch «No specific molecular subtype»(NSMP)-Gruppe. Diese Gruppe beinhaltet über 50% aller Endometriumkarzinome.
Karzinome der CNL-Gruppe sind häufig «low grade» mit endometrioider Histologie, hormonrezeptorpositiv und haben eine intermediäre Prognose. Auf molekularer Ebene finden sich häufig PTEN-, CTNNB1- und PIK3CA-Mutationen.4 Da ein Grossteil der Endometriumkarzinome in diese Gruppe fallen, wurden in den letzten Jahren Bestrebungen angestellt, diese grosse Gruppe von Patientinnen durch zusätzliche Untersuchungen weiter zu stratifizieren. Dabei scheint eine nachgewiesene CTNNB1-Mutation mit einer schlechteren Prognose assoziiert zu sein.13,14 Ebenso ist eine Expression des Zell-Adhäsions-Moleküls L1CAM in mehr als 10% der Tumorzellen in dieser Gruppe von Karzinomen mit einem aggressiveren klinischen Verlauf vergesellschaftet.15 Aufgrund der Positivität für Hormonrezeptoren werden diese Patientinnen häufig antihormonell, zum Beispiel mit Aromatasehemmern, behandelt.
Die «Multiple classifier»- Endometriumkarzinome
Ca. 5% aller Endometriumkarzinome weisen mehrere der oben beschriebenen Veränderungen auf und lassen sich damit nicht eindeutig einer der vier molekularen Subgruppen zuordnen.16 Bei diesen Fällen spricht man von «Multiple classifier»-Karzinomen.
Patientinnen mit einer pathogenen POLE-Mutation und gleichzeitig einer aberranten p53-Expression (1% der Fälle) zeigen eine gleich gute Prognose wie Patientinnen mit POLE-ultramutierten Karzinomen.16 Es ist davon auszugehen, dass die TP53-Mutation im Rahmen der Akkumulation von Mutation zufällig entsteht und in diesen Fällen nicht den onkogenen «Driver» darstellt. Typischerweise sind diese TP53-Mutationen subklonal, was auch in der p53-Immunhistochemie ersichtlich ist.
Patientinnen mit einer gleichzeitig vorliegenden pathogenen POLE-Mutation und einer Mikrosatelliteninstabilität (1%) zeigen ebenfalls eine exzellente Prognose, sodass auch hier das Vorliegen der POLE-Mutation der für den Krankheitsverlauf entscheidende Faktor zu sein scheint.
Bei Patientinnen mit gleichzeitiger MSI und aberranter p53-Expression (2%) liegt häufig ebenfalls eine subklonale TP53-Mutation vor, welche die Prognose nicht negativ zu beeinflussen scheint,16 da diese Patientinnen einen identischen Verlauf wie die Patientinnen in der MSI-Gruppe zeigen.
Aufgrund dieser Ergebnisse lässt sich sagen, dass die Ergebnisse der MSI- und der p53-Analyse nur in Kenntnis des POLE-Mutationsstatus interpretiert werden können. Insbesondere sollte davon abgesehen werden, Patientinnen mit einer aberranten p53-Expression automatisch der «Copy number high»-Gruppe von Endometriumkarzinomen zuzuordnen, da bei einer gleichzeitig vorliegenden POLE-Mutation die TP53-Mutation keinen Einfluss auf die Prognose hat. Aus diesem Grund ist die POLE-Mutationsanalyse auch im WHO-Schema allen anderen Abklärungen vorangeschaltet (Abb. 2).
Bei den extrem seltenen «Triple classifier»-Karzinomen (<1%), mit gleichzeitig vorliegender POLE-Mutation, MSI und aberranter p53-Expression, sind zurzeit aufgrund der geringen Fallzahlen keine Aussagen über die Prognose möglich.16
Ausblick
Die molekulare Klassifikation der Endometriumkarzinome wurde in die europäischen Behandlungsrichtlinien (ESGO/ESTRO/ESP) integriert und sorgt unter Einbezug der molekularen Ergebnisse für eine neue Einteilung der Patientinnen in verschiedene Risikogruppen.17 Diese auf den molekularen Veränderungen basierende, genauere Einteilung soll zu wirksameren und weniger toxischen, adjuvanten Behandlungsstrategien für Patientinnen mit Endometriumkrebs führen.18
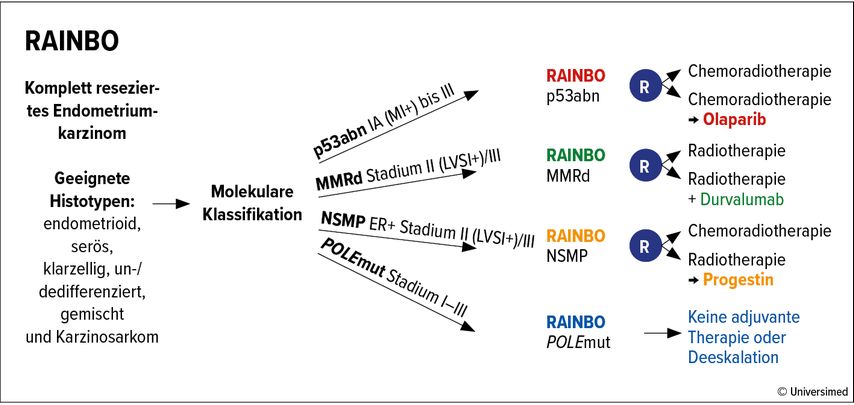
Im Rahmen des RAINBO-Programms («Refining adjuvant treatment in endometrial cancer based on molecular features») werden zurzeit in vier internationalen klinischen Studien vier auf die verschiedenen molekularen Subtypen ausgerichtete adjuvante Behandlungsstrategien nach chirurgischer Resektion untersucht (Abb. 3). Damit sollen die Heilungsraten der aggressiveren Subtypen durch den Einsatz neuartiger zielgerichteter Therapien erhöht und gleichzeitig – für die POLE-mutierten Karzinome – die Lebensqualität der Patientinnen durch eine Deeskalation der Behandlung verbessert werden.18
Da dies die ersten Studien sind, welche die Auswirkung der molekularen Subklassifizierung prospektiv untersuchen, werden die Ergebnisse naturgemäss mit grosser Spannung erwartet.
Literatur:
1 Cancer Genome Atlas Research Network et al.: Nature 2013; 497(7447): 67-73 2 Kommoss S et al.: Ann Oncol 2018; 29(5): 1180-8 3 IARC: WHO Classification of Tumours 2020. 5th Edition, Volume 4 4 Mitric C, Bernardini MQ: Curr Oncol 2022; 29(2): 741-57 5 Casey L, Singh N: Int J Gynecol Pathol 2021; 40(1): 5-16 6 Favier A et al.: Cancers (Basel) 2022; 14(15): 3783 7 Pasanen A et al.: Cancers 2022; 14(5): 1348 8 Bellone S et al.: Cancer 2022; 128(6): 1206-18 9 Jamieson A et al.: Int J Gynecol Cancer 2021; 31(6): 907-13 10 Singh N et al.: J Pathol 2020; 250(3): 336-45 11 Matsumoto N et al.: Int J Gynecol Pathol 2022; online ahead of print 12 Leon-Castillo A et al.: J Clin Oncol 2020; 38(29): 3388-97 13 van den Heerik A et al.: Int J Gynecol Cancer 2020; 30(12): 2002-7 14 Kurnit KC et al.: Mod Pathol 2017; 30(7): 1032-1041 15 Guo M et al.: Medicine (Baltimore) 2021; 100: e25330 16 Leon-Castillo A et al.: J Pathol 2020; 250(3): 312-22 17 Concin N et al.: Radiother Oncol 2021; 154: 327-53 18 RAINBO Research Consortium: Int J Gynecol Cancer 2022; 33(1): 109-17
Das könnte Sie auch interessieren:
Adjuvantes Osimertinib reduziert ZNS-Rezidive bei EGFR-mutierter Erkrankung
Etwa 30% der Patienten mit nicht kleinzelligem Lungenkarzinom (NSCLC) präsentieren sich mit resezierbarer Erkrankung und werden einer kurativen Operation unterzogen. Viele Patienten ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...