Chirurgische Behandlung von GIST im unteren Gastrointestinaltrakt
Autor:
Prim. Prof. Dr. Felix Aigner
Chirurgische Abteilung
Barmherzige Brüder Krankenhaus Graz
E-Mail: Felix.aigner@bbgraz.at
Gastrointestinale Stromatumoren (GIST) gehören zu den häufigsten mesenchymalen Neoplasien des Verdauungstraktes, wenngleich die GIST des unteren Gastrointestinaltraktes (Dünndarm, Kolon, Rektum) wesentlich seltener vorkommen als die des Ösophagus, Magens und Duodenums. Von der WHO grundsätzlich als maligne eingestuft, ist der Goldstandard in der Therapie der GIST die chirurgische Resektion, welche gerade im Enddarmbereich eine besondere Herausforderung hinsichtlich Funktion und Lebensqualität für den Patienten und den behandelnden Chirurgen darstellt.
Keypoints
-
Chirurgische Resektion ist Goldstandard.
-
Falls keine R0-Resektion möglich, Neoadjuvanz anstreben.
-
GIST des Rektums haben höheres Progressionsrisiko und eine schlechtere Prognose.
-
GIST des Rektums ≤2cm können organerhaltend lokal exzidiert werden.
-
GIST des Rektums ≥2cm sollten onkologisch radikal reseziert werden (anteriore Resektion, APR).
Epidemiologie
Die GIST des unteren Gastrointestinaltraktes (GIT) sind im Vergleich zu den Manifestationen im oberen GIT selten (Magen 50–70%, Dünndarm 20–30%, Kolon/Rektum 5–10%). GIST weisen zum Zeitpunkt der Diagnose bereits zu 50% Metastasen (Leber und Peritoneum, seltener Lunge und Knochen) auf und werden von der WHO unabhängig von ihrer Größe, Lokalisation und Mitoseindex als maligne eingestuft.1 Die Inzidenz der GIST hat in den letzten Jahren deutlich zugenommen, was am ehesten mit der Zunahme an Vorsorgeendoskopien vergesellschaftet ist.2
Diagnostik
Neben der Endoskopie (Rektoskopie/Kolonoskopie) und der histologischen Sicherung der Diagnose GIST im unteren GIT durch die endoskopische bzw. endosonografisch gesteuerte Biopsie oder die perkutane Tumorpunktion steht für GIST des Rektums v.a. die Becken-MRT für Untersuchung bzgl. einer lokalen Tumorausbreitung zur Verfügung. Letztere spielt zunehmend auch für die Evaluierung des Therapieansprechens mit Tyrosinkinaseinhibitoren (TKI) bei intentierter neoadjuvanter Therapie eine Rolle, wobei Kriterien wie Tumorverkleinerung („downsizing“) und Perfusionsalteration („early morphological change“, EMC) herangezogen werden.3 Das Therapieansprechen kann mittels CT darüber hinaus nach den Choi-Kriterien ermittelt werden. Als Therapieansprechen gelten dabei eine Größenabnahme >10% und/oder eine Dichteabnahme (HU) um ≥15%.4 Obligater Bestandteil der Diagnostik der GIST ist heutzutage die molekulargenetische Analyse des KIT- bzw. PDGFRA-Mutationsstatus v.a. in Hinblick auf eine medikamentöse Therapie.
Prognose
Die Prognose von GIST hängt von tumor- und patientenbezogenen Faktoren und nicht zuletzt von der chirurgischen Qualität der Resektion ab. Tumorbezogene Faktoren sind Größe, Differenzierung, anatomische Lokalisation, histologischer Typ, Infiltrationstiefe, Metastasierungsstatus und die Mitoserate. Zusätzlich sind der Mutationsstatus sowie die Position der Mutation von KIT- und PDGFRA-Genen prognosebestimmend.
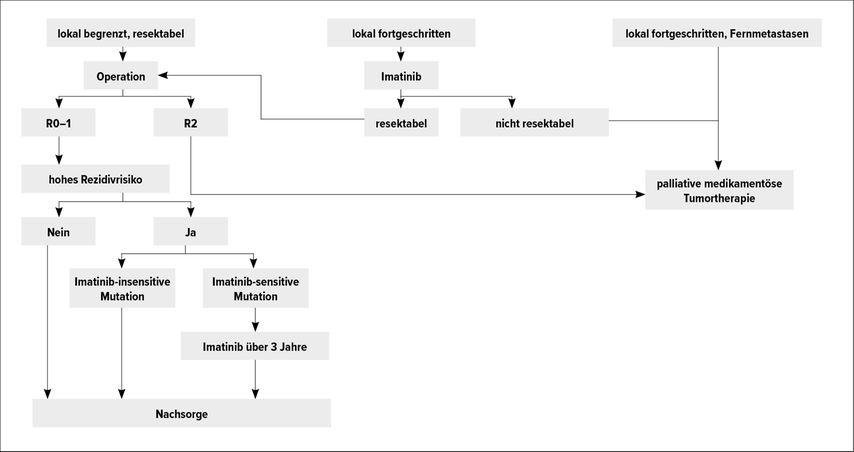
Lokal oder lokoregionäres Stadium
Die chirurgische Therapie von GIST unterscheidet sich von der kolorektaler Karzinome grundsätzlich darin, dass eine Lymphknotendissektion bildgebend und intraoperativ makroskopisch unauffälliger Lymphknoten nicht notwendig ist (Abb. 1). Die Unversehrtheit des Tumors sowie das Vermeiden der intraoperativen Tumorruptur sind unabdingbar und der Zugang ist entsprechend zu wählen. Laparoskopische inklusive robotisch-assistierte Verfahren sind nach Zentrumsexpertise als gleichwertig dem konventionellen offenen Zugang zu bewerten und, wenn möglich, ist die minimal invasive Chirurgie aufgrund der allgemein bekannten Vorteile vorzuziehen.
GIST des Rektums, wenngleich auch deutlich seltener als GIST des Dünn- oder Dickdarms, stellen eine besondere Herausforderung für die behandelnden Chirurgen dar. Aufgrund der engen Lagebeziehung zu Beckenorganen des mittleren und vorderen Beckenkompartimentes und zu den Schließmuskeln müssen bei der Planung der radikalen Operation der mögliche Kollateralschaden und eine Verletzung der pelvinen Nervenstrukturen sowie eine dadurch resultierende Beeinträchtigung der Kontinenzfunktion berücksichtigt werden.
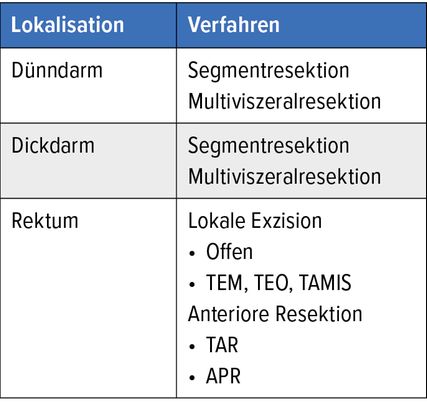
Lokale Exzisionsmethoden sind für GIST des Rektums bis zu einer Größe von 2cm auch sphinktererhaltend möglich. Hierzu stehen der transanale Zugang, je nach Höhe des Tumors offen bzw. endoskopisch (TAMIS, TEM, TEO), oder aber auch der dorsale Zugang nach Kraske (je nach Infiltrationstiefe) oder der perineale Zugang zur Verfügung (Tab. 1). Größere Tumoren sollten einer onkologisch radikalen Operation (anteriore sphinktererhaltende Resektion, TAR, oder abdominoperineale Resektion, APR) unterzogen werden.
Eine große europäische Multicenterstudie mit 210 Patienten mit GIST des Rektums, im Median 61 Jahre alt, über einen zehnjährigen Beobachtungszeitraum (2009–2018) zeigte eine mediane Tumorgröße bei Diagnose von 65mm (3–250mm) und eine mediane Tumorhöhe von 34mm (0–200mm) ab Analrand, was wiederum von vornherein mit einem sehr hohen Progressions- und Rezidivrisiko vergesellschaftet ist.5
In 109 dokumentierten Fällen wurde eine chirurgische Therapie je nach Größe mittels lokaler Exzision, TAR oder APR mit niedriger schwerer Komplikationsrate (4,4%) durchgeführt. Die Patienten mit onkologisch radikaler Operation (TAR, APR) erhielten häufiger eine neoadjuvante TKI-Therapie als jene Patienten in der lokalen Exzisionsgruppe (77%, 91% vs. 54%), der Unterschied nivellierte sich in der adjuvanten Therapie (86%, 61% vs. 61%). Es muss aber betont werden, dass jene Patienten, die in nicht GIST-spezialisierten Krankenhäusern operiert wurden, seltener einer neoadjuvanten oder adjuvanten Therapie zugeführt wurden und eine signifikant höhere Rate an intraoperativen Tumorrupturen mit daraus resultierendem signifikant kürzerem rezidivfreiem Überleben in der univariaten, nicht aber in der multivariaten Regressionsanalyse aufwiesen.
Die Lokalrezidivrate in der operierten Gruppe betrug 28% und die Mortalität 5%. Das Lokalrezidiv wurde in dieser Studie entgegen den Erwartungen der Autoren in der multivariaten Analyse nicht signifikant durch die intraoperative Tumorruptur oder tumorfreie Resektionsränder beeinflusst, was aber mitunter einem Selektionsbias zuzuschreiben war. Die Autoren schlussfolgern, dass die chirurgische Therapie abhängig von der Größe und an spezialisierten Zentren mit hoher Fallzahl an kolorektalen Eingriffen durchgeführt werden sollte.
Das onkologische Outcome rektaler GIST nach chirurgischer Entfernung steht in direktem Zusammenhang mit der Größe und ist, gemessen am rezidivfreien Überleben, nach lokaler Exzision bei Tumoren ≥2cm signifikant schlechter (p=0,046). Dies konnte auch in einer großen chinesischen Multicenterstudie bestätigt werden, in der zwei nach Alter, Geschlecht, Tumorgröße, Vorbehandlung und Mitoserate vergleichbare Gruppen („propensity score- matched analysis“) tiefer GIST des Rektums in Hinblick auf rezidivfreies Überleben gegenübergestellt wurden.6 In der Gruppe mit Tumoren ≤2cm wurde kein signifikanter Unterschied im rezidivfreien Überleben festgestellt, wenn die Patienten organerhaltend lokal exzidiert oder onkologisch radikal reseziert wurden. Dies änderte sich jedoch signifikant zugunsten der radikalen Resektion bei größeren Tumoren (≥2cm) (p=0,046). Die Gruppe von Patienten mit lokal exzidiertem GIST hatten hingegen signifikant kürzere Operationszeiten, weniger perioperative Komplikationen sowie einen kürzeren Krankenhausaufenthalt. Die Autoren schlussfolgern, dass ein „downsizing“ größerer rektaler GIST mittels TKI-Therapie angestrebt werden sollte, vor allem wenn eine R0-Resektion primär schwierig oder nur mittels Multiviszeralresektion möglich erscheint. Ebenso wurden neoadjuvante Therapiekonzepte zum „downsizing“ und anschließend lokaler Exzision tiefer GIST des Rektums diskutiert, um die Rate an Rektumamputationen zu senken.
Die adjuvante Therapie mittels TKI richtet sich nach dem Mutationsstatus (KIT, PDGFRA) und sollte über drei Jahre durchgeführt werden.7
Fallbeispiel
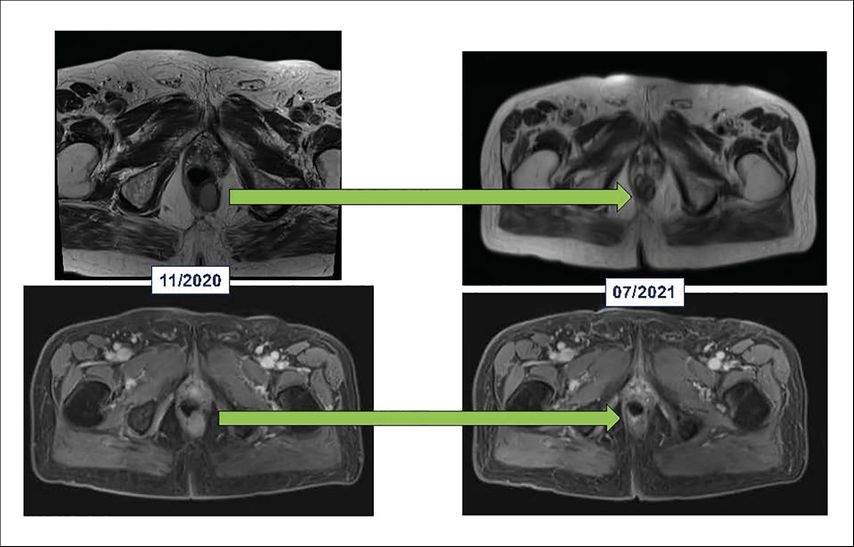
Ein Fall aus unserer eigenen Abteilung zeigt den Nutzen einer neoadjuvanten Therapie mit TKI. Ein 70-jähriger männlicher Patient mit einem 2,3cm großen rektalen GIST direkt an der Linea dentata wurde bereits 2013 durch eine transanale lokale Exzision operiert und in toto reseziert. Damals wurde eine leitliniengerechte adjuvante Therapie mit Imatinib 400mg 1x1 über insgesamt drei Jahre durchgeführt bei insgesamt sehr guter Lebensqualität und guter Schließmuskelfunktion. Ende 2020 wurde der Patient mit einem 2,9cm großen Rezidiv am ehemaligen Operationsgebiet vorstellig (KIT-Exon-11-mutiert), weswegen wir bei onkologisch nicht sinnvollem Sphinktererhalt eine Reexposition mit Imatinib 1x400mg eingeleitet haben, um dem Patienten eine Rektumamputation zu ersparen. In weiterer Folge kam es zu einem deutlichen Schrumpfen des Tumors (Abb. 2). Wir planen nun die neuerliche lokale Exzision mittels transanalen Zugangs.
Abb. 2: Rektaler GIST vor (linke Bildseite) und nach (rechte Bildseite) neoadjuvanter Therapie mit Imatinib 400mg 1x1 mit deutlicher Schrumpfung des Tumors
Zusammenfassung
GIST des unteren GIT stellen an sich eine seltene Entität dar, davon sind die GIST des Dünndarms mit einer Inzidenz von ca. 25% aller GIST die häufigsten, die GIST des Kolons und Rektums mit jeweils 2% und die analen GIST mit <1% die seltensten GIST des unteren GIT. Prognoseentscheidende Faktoren in Hinblick auf das Progressions- und Rezidivrisiko sind die Mitosezahl und die Größe der GIST. Das primäre Therapieziel ist die R0-Resektion und das Vermeiden einer intraoperativen Tumorruptur. Minimal-invasive Operationsmethoden (laparoksopisch, transanal oder robotisch-assistiert) sind der Vorzug aus bekannten Vorteilen (raschere Regeneration, weniger Wundheilungsstörungen und postoperative Schmerzen) zu geben. GIST des Rektums werden größenabhängig sphinktererhaltend lokal exzidiert oder radikal reseziert, was aber durchaus mit einer Rektumamputation und dauerhaftem künstlichem Darmausgang vergesellschaftet sein kann. Daher sind neoadjuvante Therapien mit TKI zum „downsizing“ im interdisziplinären Tumorboard zu diskutieren.
Literatur:
1 WHO Classification of Tumours Editorial Board: Soft Tissue and Bone Tumours. 5th ed. Lyon, France: IARC; 2020 2 Sonderauswertung der Gesellschaft der Epidemiologischen Krebsregister in Deutschland (GEKID): Gesellschaft der epidemiologischen Krebsregister in Deutschland e.V. Atlas der Krebsinzidenz und -mortalität in Deutschland (GEKID-Atlas). Lübeck, 2017. Verfügbar über: http://www.gekid.de. Falldefinition: ICD-O3: Morphologiecodes 8936/1 und 8936/9. Länder im Pool: SH, NI, HB, RegBez Münster, BY, BB, MV, SN, TH 3 Ishida T et al.: New response evaluation criteria using early morphological change in imatinib treatment for patients with gastrointestinal stromal tumor. Gastric Cancer 2021, online ahead of print 4 Choi H et al.: Correlation of computed tomography and positron emission tomography in patients with metastatic gastrointestinal stromal tumor treated at a single institution with imatinib mesylate: proposal of new computed tomography response criteria. J Clin Oncol 2007; 25(13): 1753-9 5 IJzerman NS et al.: Quality of treatment and surgical approach for rectal gastrointestinal stromal tumour (GIST) in a large European cohort. Eur J Surg Oncol 2020; 46(6): 1124-30 6 Wang T et al.: Radical resection versus local excision for low rectal gastrointestinal stromal tumor: a multicenter propensity score-matched analysis. Eur J Surg Oncol 2021; 47(7): 1668-74 7 Casali PG et al.: Gastrointestinal stromal tumours: ESMO-EURACAN Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2018; 29(Suppl 4): iv68-iv78
Das könnte Sie auch interessieren:
Adjuvantes Osimertinib reduziert ZNS-Rezidive bei EGFR-mutierter Erkrankung
Etwa 30% der Patienten mit nicht kleinzelligem Lungenkarzinom (NSCLC) präsentieren sich mit resezierbarer Erkrankung und werden einer kurativen Operation unterzogen. Viele Patienten ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...