CAR-T-Zell-Therapie: vielfältige Pfade in die Zukunft
Bericht:
Dr. Judith Moser
Mitte Februar fand das 4. Europäische CAR-T-Zell-Meeting der European Hematology Association und der European Group for Blood and Marrow Transplantation als virtueller Kongress statt. Unter anderem standen aktuelle CAR-T-Technologien und innovative Anwendungsbereiche innerhalb und außerhalb der Hämatologie im Mittelpunkt der Veranstaltung.
Nachdem im Laufe der letzten fünf Jahre mehrere CD19-spezifische CAR(„chimeric antigen receptor“)-T-Zell-Produkte ihren Weg in das therapeutische Armamentarium bei B-Zell-Malignomen gefunden haben, konzentrieren sich die Forschungen auf die Erweiterung der Einsatzbereiche. „Ein wichtiges Ereignis war letztes Jahr die Zulassung der ersten CAR-T-Zellen, die am B-Zell-Reifungsantigen BCMA ansetzen“, betonte Dr. Carl June, Parker Institute for Cancer Immunotherapy, University of Pennsylvania, in seiner Keynote Lecture. „Das ist eine Target-unabhängige Strategie, von der wir hoffen, dass sie auf alle Malignome ausgeweitet werden kann.“
Von autolog zu allogen
Einschränkungen in der praktischen Handhabung der CAR-T-Zell-Therapie ergeben sich nach wie vor durch die komplexe Herstellung und die bekannten Nebenwirkungen wie Zytokin-Release-Syndrom (CRS) und Immuneffektorzell-assoziiertes Neurotoxizitätssyndrom (ICANS), die häufig auch höhergradig ausfallen. Jedoch könnte die autologe Herstellungsweise bald der Vergangenheit angehören. June: „Aktuell werden Off-the-Shelf-Zellen aus Nabelschnurblut, von gesunden Spendern und induzierten pluripotenten Stammzellen entwickelt.“ Für die nächste Dekade prognostizierte der Experte die Verfügbarkeit potenterer allogener T-Zellen auf der Basis von Genom-Editing und synthetischer Biologie.
June wies darauf hin, dass die Zellen im Organismus mindestens ein Jahrzehnt persistieren und eine Evolution durchlaufen können, sodass Effektivität und Toxizitäten schließlich von Zellen ausgehen, die sich von den ursprünglich infundierten unterscheiden. Eigene Langzeitbeobachtungen zeigten einen Übergang von CD8-Positivität während der akuten CAR-T-Zell-Antwort zu CD4-Positivität in der Langzeitremission.1 Trotz der phänotypischen Verschiebung blieben die Zellen funktionsfähig und erhielten eine Homöostase durch fortgesetzte Proliferation und negative regulatorische Mechanismen aufrecht. „Hier entstand eine anhaltende, aber gezügelte Anti-B-Zell-Response.“
Bispezifischer Ansatz zur Reduktion des Antigen-Escape
Im Rahmen der Entwicklung neuer CAR-T-Technologien muss eine Balance zwischen Faktoren wie Target-Identifikation, Antigenverlust als Resistenzmechanismus (Antigen-Escape), Off-Tumor-Toxizität im Bereich von gesunden Geweben und Immunsuppression gefunden werden. Unterschiedliche Engineering-Strategien legen den Fokus auf den einen oder anderen Aspekt.
Dr. Yvonne Chen, University of California, Los Angeles, wies darauf hin, dass der Antigen-Escape die Dauer des Ansprechens auf die CAR-T-Zell-Therapie signifikant limitiert. „Im Rezidiv finden sich sehr häufig CD19-negative Tumorzellen.“ Wenn bei einem bestimmten Malignomtyp der Antigen-Escape im Vordergrund steht, kann ein bispezifischer Ansatz mit zwei Targets, von denen jedes für sich die CAR-T-Zell-Response triggert, eine Lösung bringen. „Andererseits nimmt hier das Potenzial für Off-Tumor-Toxizitäten zu,“ betonte Chen. Die Expertin präsentierte die Ergebnisse einer Phase-I-Dosiseskalationsstudie mit bispezifischen, sowohl gegen CD19 als auch CD20 gerichteten CAR-T-Zellen. Patienten mit Non-Hodgkin Lymphom (NHL) und chronischer lymphatischer Leukämie (CLL), von denen die meisten eine sehr hohe Tumorlast aufwiesen, nahmen an der Untersuchung teil. Bis dato erzielten sieben von acht behandelten Patienten Komplettremissionen und konnten diese auch aufrechterhalten. In vier Fällen wurde das Ansprechen mit der niedrigsten Dosis von 50 x 106 Zellen erreicht, in drei mit 200 x 106. Als überraschend günstig erwies sich das Nebenwirkungsprofil: Es traten keine Neurotoxizitäten auf, und CRS-Ereignisse wurden maximal als Grad 1 kategorisiert. „Man hielt signifikante Toxizitäten bei einigen Patienten bisher für den unvermeidlichen Preis einer hohen Effektivität“, so Chen. „Diese Studie zeigt, dass dies bei einem entsprechenden Design der T-Zellen nicht unbedingt der Fall sein muss.“
ARI-0001-CAR-T-Zellen bei CLL
CD19-spezifische ARI-0001-Zellen stellen einen weiteren innovativen Ansatz dar. Sie werden mit einem CAR-Konstrukt der zweiten Generation hergestellt, das auf dem monoklonalen Antikörper A3B1 in Kombination mit CD8:41BB:CD3z-Regionen basiert.2 Dr. Valentin Ortiz-Maldonado, Hospital Clinic de Barcelona, präsentierte frühe klinische Daten zur Anwendung von ARI-0001-CAR-T-Zellen bei relapsierter/refraktärer CLL und Richter-Transformation. Neun Patienten wurden behandelt, wobei in jeweils sechs Fällen ein (sehr) hohes Risiko laut internationalem prognostischem Index (IPI) bzw. eine Richter-Transformation vorlag. Die Zieldosis umfasste 1 x 106 Zellen/kg bei CLL und 5 x 106 Zellen/kg bei Richter-Transformation.
„Alle CLL-Patienten erzielten MRD(minimale Resterkrankung)-Negativität mit Komplettremissionen im Knochenmark und peripheren Blut“, berichtete Ortiz-Maldonado. Innerhalb eines Beobachtungszeitraums von mindestens 51 Monaten manifestierten sich keine Rezidive.
Die Gruppe mit Richter-Transformation zeigte eine Gesamtansprechrate von 100%, bei der Hälfte trat eine komplette metabolische Response ein. „Zwei Patienten mit partieller Response bzw. Krankheitsstabilisierung erfuhren aufgrund von CD19-Verlust eine Progression“, so Ortiz-Maldonado. CRS-Ereignisse aller Grade wurden bei acht Studienteilnehmern beobachtet, ein schweres Ereignis (Grad ≥3) bei einem. Neurologische Toxizitäten traten nicht zutage.
Insgesamt weisen ARI-0001-Zellen diesen Daten zufolge ein Sicherheits- und Wirksamkeitsprofil auf, das jenem anderer bei CLL/Richter-Transformation verfügbarer, CD19-spezifischer CAR-T-Produkte entspricht.
Tripel-Immunschema: experimentelle Daten
Dr. Robert Zeiser vom Universitätsklinikum Freiburg stellte das Konzept der Tripel-Immuntherapie beim chemoresistenten kleinzelligen Lungenkarzinom (SCLC) vor. Bekanntermaßen spricht ein sehr hoher Anteil der Patienten mit SCLC auf die initiale Chemotherapie an, Rezidive folgen jedoch unausweichlich, da die Behandlung die Krebsstammzellen nicht eradizieren kann.
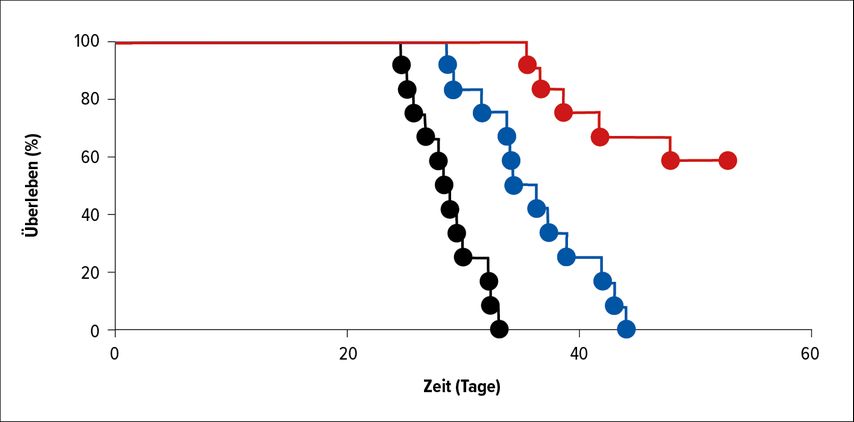
„Chemotherapie-resistente SCLC-Zellen sind durch die Expression des Krebsstammzellmarkers CD133 charakterisiert und zeigen eine hohe Proliferationsrate“, so Zeiser.3 Im Xenograft-Mäusemodell konnte die Tumorlast durch eine CD133-gezielte CAR-T-Zell-Therapie reduziert werden, es trat jedoch kein völliges Verschwinden ein.3 Um Escape-Mechanismen entgegenzuwirken, fassten die Forscher eine Kombinationsstrategie ins Auge, die zusätzlich zur CAR-T-Zell-Therapie eine PD-1-Hemmung und schließlich die Inhibition des membrangebundenen Enzyms Ecto-5-Nucleotidase (CD73) beinhaltete. „Sowohl PD-L1 als auch CD73 wird von Tumorzellen, Makrophagen und Neutrophilen exprimiert“, erklärte Zeiser. Tatsächlich erreichten die mittels der Tripelkombination behandelten Mäuse die niedrigste Tumorlast und das längste Überleben im Vergleich zu jenen unter alleiniger CAR-T-Zell-Therapie bzw. einer Kombination aus dieser mit einem CD73-Hemmer (Abb. 1). Der Kurvenverlauf wies erstmals auf ein Langzeitüberleben hin. Gleichzeitig war die Elimination chemoresistenter SCLC-Zellen nicht von Graft-versus-Host-Phänomenen oder Knochenmarkaplasie begleitet.
Abb. 1: Überlebenskurven bei Mäusen mit chemoresistentem SCLC unter CAR-T-Zell-Therapie alleine (schwarz) bzw. kombiniert mit einem CD73-Inhibitor (blau) bzw. unter Tripeltherapie mit einem PD-1-Inhibitor (rot). Modifiziert nach Zeiser M: Abstr. PS04-4
Bedeutung des Mikrobioms für die Outcomes
Eine signifikante Rolle für die Gesundheit wird dem Mikrobiom zugeordnet, das pro Person 103 Spezies an symbiotischen Mikroorganismen und Kommensalen umfasst und zu 98% im Gastrointestinaltrakt beheimatet ist. Bekanntermaßen setzt eine Breitspektrumantibiotikatherapie im Vorfeld der Gabe von Checkpoint-Inhibitoren (CPIs) das Gesamtüberleben herab.4 Die von Dr. Christoph Stein-Thöringer, Nationales Centrum für Tumorerkrankungen Heidelberg, präsentierte internationale translationale Studie evaluierte das Zusammenspiel zwischen dem Mikrobiom des Darms und den Outcomes unter einer CD19-spezifischen CAR-T-Zell-Therapie. Insgesamt nahmen 172 Patienten teil, wobei 66 aus Deutschland und 106 aus den USA stammten. Das diffuse großzellige B-Zell-Lymphom (DLBCL) fand sich als häufigste Diagnose.
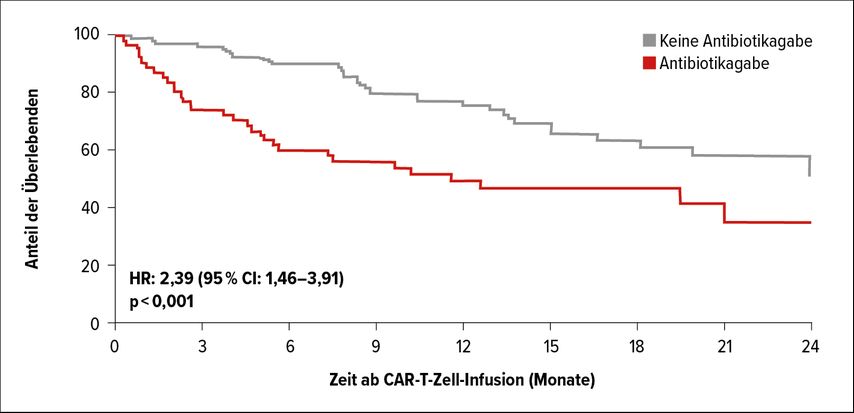
Ebenso wie im Setting der CPI-Therapie verschlechterte eine vorangegangene Antibiose die Outcomes. „Patienten, die in den drei Wochen vor der CAR-T-Infusion Antibiotika erhalten hatten, zeigten im Vergleich zu den Kontrollen ein signifikant verkürztes Gesamtüberleben“, berichtete Stein-Thöringer (Abb. 2). Hauptsächlich ging von Breitspektrumantibiotika ein negativer Effekt aus; gegenüber Substanzen mit schmälerem Spektrum und einer nicht stattgehabten Behandlung resultierte eine signifikante Steigerung der Progressionswahrscheinlichkeit (jeweils p<0,0001). „Laut multivariater Analyse blieb dieser Effekt auch nach Korrektur um Faktoren wie Alter, ECOG PerformanceStatus und LDH-Spiegel bestehen“, erläuterte Stein-Thöringer.
Abb. 2: Gesamtüberleben bei CAR-T-Zell-Empfängern in Abhängigkeit von einer Antibiotikatherapie im Vorfeld der Infusion. Modifiziert nach Stein-Thöringer C: Abstract PS03-4
Im Hinblick auf das Mikrobiom selbst erbrachte die laufende Analyse von Stuhlproben eine signifikante Abnahme der Bandbreite der Spezies nach der CAR-T-Zell-Infusion. „Diese Reduktion wurde vor allem durch die Exposition gegenüber Antibiotika vorangetrieben und korrelierte mit Response und früher Progression, während mit CRS und ICANS keine Korrelation bestand.“ Interessanterweise stellten die Forscher eine Assoziation zwischen der Präsenz von E. coli und Parabacteroides vor Behandlungsbeginn und der Tendenz zu einer frühen Progression in den ersten sechs Monaten nach der Infusion fest. Dagegen waren andere Keime wie Ruminokokken, Eubacterium oder Bifidobacterium longum bei Patienten, die nie oder später progredient wurden, überrepräsentiert.
Covid und CAR-T-Zellen
Wie seit Beginn der Pandemie bekannt ist, haben Krebspatienten ein erhöhtes Risiko für schwere Verläufe einer Covid-19-Infektion. Dr. Arnon Nagler, Chaim Sheba Medical Center, Tel Hashomer, Israel, nahm Bezug auf die Verwerfungen infolge der Pandemie im Bereich der CAR-T-Zell-Therapie. Gemäß einem von Juli bis November 2020 durchgeführten europäischen Survey gaben während der ersten Welle 51% von 49 Zentren in 12 Ländern eine reduzierte Kapazität an ihren Abteilungen an.5 Bei 29% kam es zu Verzögerungen der CAR-T-Zell-Therapie, und bei 68% führten diese dazu, dass die Patienten eine zusätzliche Therapie vor der Infusion benötigten.
Massiv herabgesetzt ist laut einer multizentrischen Studie der EBMT die Prognose jener Personen, die nach einer CAR-T-Zell-Therapie an Covid-19 erkranken.6 80% der Betroffenen mussten hospitalisiert werden, bei 42,9% war eine Sauerstoffgabe erforderlich. „39,3% wurden auf die Intensivstation aufgenommen, und 72,7% benötigten eine mechanische Beatmung.“ Die Mortalitätsrate war mindestens um den Faktor 4 erhöht: 44,6% der Patienten verstarben, und nach 24 Wochen lag die Gesamtüberlebensrate lediglich bei 50,8%.
Bei Patienten, die eine CAR-T-Zell-Therapie erhalten haben, hält das Coronavirus-Shedding mindestens zwei Monate an.7 Nagler: „Daher sollte eine längere Isolation in Erwägung gezogen werden.“ Dringend zu empfehlen ist der Schutz von CAR-T-Zell-Empfängern mit den verfügbaren Maßnahmen wie Social Distancing und Masken für mindestens sechs Monate nach der Infusion, ebenso wie die Immunisierung der Patienten selbst sowie von Gesundheitspersonal und Familienmitgliedern.
Neue Indikationen
Auch außerhalb des hämatoonkologischen Bereichs tun sich innovative Anwendungsbereiche auf. Dr. Jonathan Epstein, University of Pennsylvania, berichtete über Erfahrungen in der Therapie der kardialen Fibrose. Ein Ansatzpunkt resultiert hier aus der Tatsache, dass Fibroblasten bei Kardiomyopathie das FAP(familiäre adenomatöse Polyposis)-Gen exprimieren, nicht aber im gesunden Herzen. Mithilfe einer FAP-gezielten CAR-T-Zell-Therapie könnten aktivierte Fibroblasten gezielt aus dem Weg geräumt und die kardiale Funktion verbessert werden.8
Da autoreaktive B-Zellen auch in der Pathogenese schwerer Autoimmunerkrankungen eine Rolle spielen, ist ein Einsatz hier ebenfalls denkbar. Bei Patienten mit refraktärem systemischem Lupus erythematodes (SLE) induzierten CD19-spezifische CAR-T-Zellen bei hoher Verträglichkeit eine rasche Remission.9 „Alle vier Patienten konnten sämtliche SLE-spezifische Therapien inklusive Steroide absetzen“, berichtete Dr. Andreas Mackensen, Universitätsklinikum Erlangen. Eine Phase-I/II-Studie bei Patienten mit refraktären, B-Zell-mediierten Autoimmunerkrankungen ist geplant.
Quelle:
EBMT-EHA 4th European CAR T-cell Meeting, 10.–12. Februar 2022, virtuell
Literatur:
1 Melenhorst JJ et al.: Nature 2022; 602: 503-9 2 Castella M et al.: Mol Ther Methods Clin Dev 2018; 12: 134-44 3 Taromi S et al.: Cancer Lett 2021; 520: 385-99 4 Pinato DJ et al.: JAMA Oncol 2019; 5: 1774-8 5 Ghorashian S et al.: Bone Marrow Transplant 2022; 57: 299-301 6 Spanjaart AM et al.: Leukemia 2021; 35: 3585-8 7 Aydillo T et al.: NEngl J Med 2020; 383: 2586-8 8 Aghajanian H et al.: Nature 2019; 573: 430-3 9 Mougiakakos D et al.: N Engl J Med 2021; 385: 567-9
Das könnte Sie auch interessieren:
Adjuvantes Osimertinib reduziert ZNS-Rezidive bei EGFR-mutierter Erkrankung
Etwa 30% der Patienten mit nicht kleinzelligem Lungenkarzinom (NSCLC) präsentieren sich mit resezierbarer Erkrankung und werden einer kurativen Operation unterzogen. Viele Patienten ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...