Ausgewählte Highlights zu Sarkomen
Autor:
PD Dr. med. Attila Kollár
Leitender Arzt
Co-Zentrumsleiter Sarkomzentrum
Universitätsklinik für Medizinische Onkologie
Inselspital, Universitätsspital Bern
E-Mail: attila.kollar@insel.ch
Sarkome stellen eine ausserordentlich heterogene Tumorentität dar und werden in über 100 Subtypen eingeteilt. Dies spiegelt sich auch inden präsentierten Forschungsarbeiten des diesjährigen Meetings der American Society of Clinical Oncology (ASCO) wider. Der folgende Bericht gibt einen Überblick über einige der neuen Daten und Highlights zu diesem spannenden Thema.
Keypoints
-
Der neoadjuvante Einsatz von Trabectedin bei myxoiden Liposarkomen scheint einer Therapie mit Epirubicin/Ifosfamid hinsichtlich DFS/OS nicht unterlegen zu sein. Ob eine neoadjuvante Systemtherapie mit Trabectedin per se das Gesamtüberleben verlängert, ist unklar.
-
Die adjuvante Radiotherapie bei Ewing-Sarkom der Extremitäten führt zu keiner Verbesserung des EFS, dies auch bei Vorliegen von ungünstigen prognostischen Faktoren (schlechtes histologisches Ansprechen und hohes Tumorvolumen).
-
Hochdosiertes Ifosfamid stellt gemäss der rEECur-Studie hinsichtlich Wirksamkeit die zu favorisierende Chemotherapie bei primär refraktärem/rezidivierendem Ewing-Sarkom dar.
-
Erfolgversprechende Daten zur Behandlung von «Wild-typ»-GIST nehmen zu.
Weichteilsarkome: lokalisiertes Tumorstadium
Neoadjuvante Therapiekonzepte
Im Rahmen einer bereits publizierten internationalen, multizentrischen, randomisierten Phase-III-Studie (NCT01710176) konnten Gronchi et al. zeigen, dass eine neoadjuvante Chemotherapie mit Epirubicin in Kombination mit Ifosfamid (EI) im Vergleich mit einer Histologie-adaptierten Chemotherapie bei vordefinierten Sarkomsubtypen (undifferenziertes, pleomorphzelliges Sarkom, Leiomyosarkom, maligner peripherer Nervenscheidentumor und Synovialsarkom, myxoides Liposarkom) mit hohem Rezidivrisiko (Grad 3 nach FNCLCC, Grösse >5cm, tief gelegen) mit einem besseren Gesamtüberleben assoziiert ist1, mit Ausnahme der myxoiden Liposarkome (MLS).
Das aktuelle Update berichtet über den Vergleich von EI mit Trabectedin in dieser äusserst chemosensiblen Sarkomart.2 Der primäre Endpunkt in dieser Non-Inferioritäts-Analyse war das krankheitsfreie Überleben (DFS). Insgesamt wurden 101 Patienten eingeschlossen. Die Wahrscheinlichkeit für das DFS und Gesamtüberleben (OS) nach 60 Monaten lag bei 0,86 und 0,73 im Trabectedin- und 0,88 und 0,90 für den EI-Arm (für DFS: HR: 0,60; 95% CI: 0,24–1,46; p=0,26 für OS: HR: 1,20; 95% CI: 0,37–3,93; p=0,77). Diese Studie bestätigt einmal mehr, dass Trabectedin bei MLS eine sehr wirksame systemtherapeutische Option darstellt. Jedoch bleibt bei fehlendem Placeboarm in der Studie weiterhin unklar, ob eine neoadjuvante Systemtherapie mit Trabectedin bei MLS zu einem verbesserten Überleben führt.
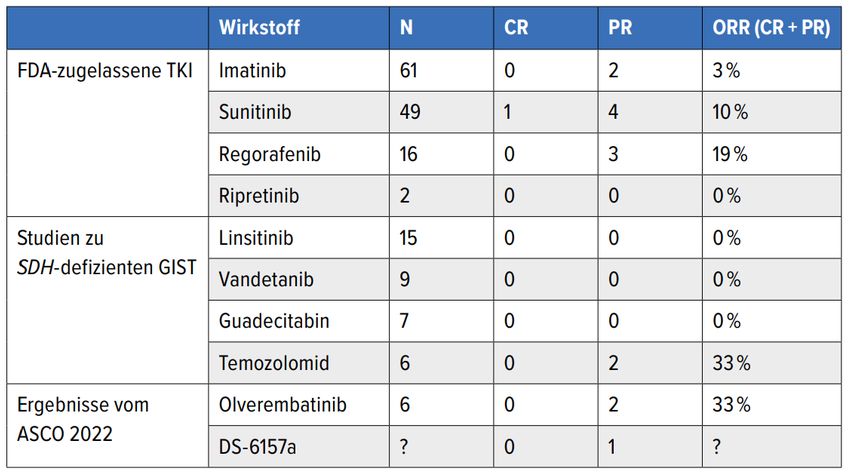
Tab. 1:Wirksamkeit von ausgewählten Systemtherapien bei Wildtyp-GIST. SDH, Sukzinat-Dehydrogenase; CR, komplette Remission; PR, partielle Remission; ORR, Gesamtansprechrate. Modifiziert nach 17
Weichteilsarkome: lokal fortgeschrittenes/metastasiertes Tumorstadium
Kombinationstherapie bei L-Sarkomen
Im Rahmen der Phase-Ib/II-Studie LEADER (NCT03526679) wurden die Durchführbarkeit sowie die Wirksamkeit der Therapie mit Eribulin in Kombination mit Lenvatinib bei Liposarkomen (LS) und Leiomyosarkomen (LMS) untersucht. Eribulin wurde vor einigen Jahren basierend auf den Resultaten einer randomisierten Phase-III-Studie zur Monotherapie des inoperablen Liposarkoms bei Progression nach zwei Vortherapien im fortgeschrittenen/metastasierten Stadium bei Erwachsenen zugelassen.3 Im Vergleich zu Dacarbazin konnte Eribulin das Gesamtüberleben um 2 Monate verlängern. Die damalige Subgruppenanalyse konnte keinen Nutzen bei Leiomyosarkomen nachweisen.
In der aktuellen Studie wurde Eribulin 1,1mg/m2an Tag D1,8 mit Lenvatinib in einer Dosis von 14mg/Tag (Zyklusdauer 21 Tage) kombiniert.4 Die Ansprechrate nach RECIST-1.1.-Kriterien, was dem primären Endpunkt entsprach, lag bei 20%. Nach einer medianen Beobachtungszeit von 20,1 Monaten lag in der gesamten Kohorte (n=30) das mediane PFS bei 8,56 Monaten (95% CI: 4,40–nicht erreicht [NR]) und die 6-Monats-PFS-Rate bei 59%. Das mediane PFS für LMS (8,56 Monate; 95% CI: 4,17– NR) und jenes für LS (11,36 Monate; 95% CI: 4,4–NR) waren statistisch nichtsignifikant unterschiedlich (p=0,73).
Bei zwei Dritteln der Patienten traten mindestens eine Grad-3- oder -4-Toxizität auf. Zu den häufigsten Nebenwirkungen gehörten: arterielle Hypertonie, Hand-Fuss-Syndrom, Proteinurie und (teils febrile) Neutropenie.
Im Vergleich zu einer Monotherapie mit Eribulin (Ansprechrate von ca. 5% bei LMS und LS) scheint diese Kombinationstherapie mit einer höheren Ansprechrate assoziiert zu sein. Aufgrund der geringen Zahl an eingeschlossenen Patienten und im Vergleich zur bei der genannten Phase-III-Studie früher in der Therapielinie eingesetzten Eribulin-haltigen Chemotherapie (im Median 1 Vortherapie) gilt es, diese Erfolgversprechende Kombination weiter prospektiv zu untersuchen.
Zielgerichtete Therapie mit Palbociclib
CDK4/6-Inhibitoren zeigten vorgängig Erfolgversprechende Resultate zur Behandlung von dedifferenzierten Liposarkomen (DDLS), welche in bis zu 90% mit einer CDK4-Amplifikation assoziiert sind.5 Präklinische Daten suggerieren eine Korrelation zwischen CDK4-Expression und Wirksamkeit dieser Medikamentenklasse.
Die Phase-II-Studie (NCT03242382) der Spanish Group for Research on Sarcoma (GEIS) untersuchte den Nutzen von Palbociclib bei vorbehandelten Sarkomen (ausser DDLS) in Abhängigkeit von der CDK4/CDKN2A-Expression.6 22 Patienten wurden mittels Palbociclib in einer Dosis von 125mg an Tag 1–21, Zyklusdauer 4 Wochen, behandelt. Eine CDK4-Expression konnte bei 28% der initial gescreenten Sarkome objektiviert werden.
Das mediane PFS und die 6-Monats-PFS-Rate (primärer Endpunkt) waren 4,2 Monate (95% CI: 0,9–7,4) bzw. 30% (95% CI: 9–51). Eine Tumorstabilisierung wurde in 58% erzielt. Patienten mit einer CDK4-Expression über dem Median profitierten von einem signifikant längeren medianen PFS von 5,9 (95% CI: 1,4–10,4) vs. 1,9 Monate (95% CI: 0,6–3,2; p=0,046) und einem längeren OS von 15,5 (95% CI: 6,8–24,3) vs. 10,6 Monate (95% CI: 0–23,2; p=0,047).
Die Studie weist auf die Wirksamkeit dieser Substanzklasse bei diversen Sarkomarten, sprich nicht nur DDLS, in einem stark vorbehandelten Kollektiv (median 3 Vortherapien) und eine mögliche prädiktive Bedeutung der CDK4-Expression hin.
Immuntherapie bei ausgewählten Sarkomsubtypen
In einer Phase-II-Pilotstudie (NCT02992743) berichten D’Angelo et al. über die Wirksamkeit und die Verträglichkeit von Lete-cel, einer NY-ESO-1-spezifischen, autologen T-Zell-Therapie, bei myxoiden, rundzelligen Liposarkomen (MRCLS) nach Anthrazyklin-haltiger Vortherapie.7 Grundlage hierfür bietet die in 80–90% vorliegende Expression dieses Tumorantigens bei MRCLS. 2 Kohorten, die insgesamt 23 Patienten beinhalteten, mit unterschiedlichen Dosen der lymphodepletierenden Chemotherapie, bestehend aus Fludarabin (90 vs. 120mg/m2) und Cyclophosphamid (1800 vs. 2700mg/m2), wurden untersucht.
Die Ansprechraten gemäss RECIST 1.1. lagen bei 40% vs. 20% zugunsten der Dosis-intensiven Therapie. Ebenfalls war das mediane PFS mit 8,7 (95% CI: 0,9–NE) vs. 5,4 Monate (95% CI: 2,0–11,5) länger. Das Zytokinfreisetzungssyndrom und die Hämatotoxizität gehörten zu den prägendsten Nebenwirkungen. Dieser immuntherapeutische Ansatz weist auf deren Wirksamkeitbei jener seltenen Sarkomentität hin. Da der Einsatz dieser T-Zell-Therapie auf eine HLA-A*02:01-, A*02:05- oder A*02:06-basierte Antigen-Präsentation eingeschränkt ist, kann leider nur ein begrenzter Teil der Erkrankten profitieren. Die Dosis der lymphodepletierenden Chemotherapie scheint für die Wirksamkeit relevant zu sein.
Zu obigem Thema wurden ebenfalls dieResultate einer Phase-I-Studie (NCT04318964) berichtet, welche den Einsatz einer NY-ESO-1-spezifischen T-Zell-Therapie bei HLA-A*02:01-Patienten, welche an einem fortgeschrittenen Weichteilsarkom (nicht Histologie-spezifisch) litten, prüfte.8 Interessanterweise war die Ansprechrate mit 41,7% (12 Patienten insgesamt) relativ hoch. Die Kohorte wird in Zukunft weiter untersucht werden.
Knochensarkome
Ewing-Sarkom: Welches ist die beste Chemotherapie in der Rezidivsituation?
Die rEECur-Studie (NCT36453794) ist eine internationale, multizentrische, prospektiv randomisierte Studie, welche die Wirksamkeit von 4 unterschiedlichen Chemotherapie-Schemata zur Behandlung von Ewing-Sarkomen in der primär refraktären oder rezidivierenden Krankheitssituation untersucht (Gemcitabin/Docetaxel [GD] vs. Irinotecan/Temozolomid [IT] vs. Hochdosis-Ifosfamid [IFOS] vs. Topotecan/Cyclophosphamid [TC]). Aufgrund einer teils minimal geringeren Ansprechrate, welche im Rahmen des initialen Studiensettings dem primären Endpunkt entsprach, haben sich IFOS (3000mg/m2an Tag 1–5) und TC (T 0,75mg/m2 und C 250mg/m2an Tag 1–5) als die erfolgversprechendsten Regimes herauskristallisiert.
Dr. Martin McCabe (Manchester, United Kingdom) stellte im Rahmen der Plenarsitzung die Resultate des Vergleiches dieser beiden Therapien vor.9 Der primäre Endpunkt in diesem Phase-III-Teil der Studie war dasereignisfreie Überleben (EFS). Für die Analyse wurden 146 Patienten untersucht. Bei ungefähr 18% war eine primär refraktäre Situation vorliegend. Sowohl das mediane EFS als auch das OS waren im IFOS-Arm länger, in Zahlen 5,7 (95% CI: 3,8–7,0) vs. 3,7 Monate (95% CI: 2,1–6,2) und 15,4 (95% CI: 11,3–20,9) vs. 10,5 Monate (95% CI: 7,2–15,0). Der Unterschied bei Patienten <14 Jahren war deutlich imposanter.
Die Rate an febrilen Neutropenien war in beiden Therapiearmen ähnlich, 35% für TC und 28% für IFOS. Die höhere Rate an Nephro- und ZNS-Toxizität unter der IFOS-Therapie gilt es zu beachten. Auch die erhobenen Lebensqualitätsdaten unterstützen die Gabe von IFOS im Vergleich zu TC.
Die Resultate dieser Studie sind von relevanter Bedeutung, einerseits für den klinischen Alltag und andererseits für zukünftige Studien. Sie bieten erstmalig prospektive Daten zur Wirksamkeit verschiedener Systemtherapien und stellen IFOS als das wahrscheinlich wirksamste chemotherapeutische Agens dar. Zu klärende Fragen sind:
-
Ist insbesondere IT hinsichtlich des primären Endpunkts wirklich schlechter als IFOS?
-
Hat eine Ifosfamid-haltige Vortherapie einen Einfluss auf das Ergebnis? Und vor allem:
-
Welchen Stellenwert haben andere Systemtherapien, z.B. Tyrosinkinase-Inhibitoren, in der Therapiesequenz in der Rezidivsituation?
Rate an sekundären Malignomen
Basierend auf den Resultaten der Studie Euro Ewing 2012 (NCT92192408) wurde das VDC/IE-Chemotherapie-Schema als heutiger Standard der perioperativen Therapie beim lokalisierten Ewing-Sarkom etabliert.10
Die aktuell präsentierte COG-Studie AEWS0031 (NCT00006734) verglich vorgängig eine 2- versus 3-wöchentliche Zyklusdauer hinsichtlich Wirksamkeit und Verträglichkeit.11 Das aktuelle Update bestätigt erstmalig eine signifikante Verbesserung im 10-Jahres-OS von 69% auf 76% (p=0,03) zugunsten der Intervallverkürzung.12 Die Rate von sekundären Malignomen scheint durch diese Therapie-Intensivierung nicht ungünstig beeinflusst zu werden: 4,2% bei 21-tägigem Intervall versus 3,2% im Dosis-intensiven Arm (p=0,5).
Rolle der Radiotherapie bei Ewing-Sarkom der Extremitäten
Basierend auf der Studie Euro Ewing 2008(NCT00987636) wurde unter anderem die Bedeutung der adjuvanten Radiotherapie beim lokalisierten Ewing-Sarkom der Extremitäten untersucht. 360 Patienten wurden in 2 Kohorten eingeteilt: Tumorresektion gefolgt von Radiotherapie versus alleinige Operation.
Die mediane 5-Jahres-EFS-Rate war in beiden Gruppen gleich, 0,76 (0,70, 0,83) in der Chirurgie-Gruppe und 0,73 (0,64, 0,83) in der Gruppe der Kombinationstherapie.13 Erwähnenswert ist, dass auch Patienten mit ungünstigen prognostischen Faktoren, wie schlechtem histologischem Therapieansprechen (≥10% vitale Tumorzellen) und hohem Tumorvolumen (≥200mL), von keinem signifikanten Nutzen einer additiven Radiotherapie profitieren konnten (HR: 0,72; CI: 0,25–2,06; p=0,54).
Gastrointestinale Stromatumoren
Verträglichkeitsvergleich zwischen Sunitinib und Ripretinib
Die INTRIGUE-Studie (NCT03673501) verglich im Rahmen eines Phase-III-Designs die Wirksamkeit und Verträglichkeit von Ripretinib und Sunitinib als Zweitlinientherapie zur Behandlung von gastrointestinalen Stromatumoren (GIST). Die Studienresultate wurden bisher noch nicht abschliessend publiziert, jedoch bereits präsentiert.Ein Unterschied im Nutzen konnte nicht nachgewiesen werden.
Am diesjährigen ASCO-Meeting wurden die Verträglichkeit und der Einfluss der Therapie auf die Lebensqualität (QoL) berichtet.14 Hierfür wurden als Endpunkt schwerwiegende und lebensbedrohliche Therapie-bedingte Nebenwirkungen (Grad ≥3) gewählt und «Patient-reported outcomes» (PROS) mittels diverser Fragebogen (EORTC QLQ-C30 und Dermatology Life Quality Index [DLQI]) erhoben. Die Therapie mit Ripretinib war mit signifikant weniger Nebenwirkungen (Müdigkeit, Appetitminderung, Diarrhö, Nausea/Emesis, Schmerzen und Hauttoxizität) und besserer Erhaltung der Rollenfunktion assoziiert. Zurzeit ist Ripretinib zur Behandlung von GIST in der vierten Linie, nach Versagen und Intoleranz von Imatinib, Sunitinib und Regorafenib, zugelassen.
Wirksame Medikamente bei «Wildtyp»-GIST
Im Rahmen einer Phase-Ib/II-Studie (NCT03594422) wurden die Toxizität und die Wirksamkeit von Olverembatinib, einem Tyrosinkinase-Inhibitor (ABL1, KIT, PDGFR, FGFR, FLT3, VEGFR und SCR), unter die Lupe genommen.15 Hervorzuheben war hierbei die Wirksamkeit bei Patienten mit KIT-Wildtyp-GIST, wobei in 6 von 8 eine Sukzinat-Dehydrogenase-Defizienz (SDH) vorlag. In zwei dieser Fälle konnte ein partielles Tumoransprechen (33%) und in vier eine Tumorstabilisierung objektiviert werden.
In einer weiteren sehr interessanten Phase-I-Studie wurde nebst den Dosisfindungsdaten auch der Nutzen einer weiteren Substanz, namentlich DS-6157a, präsentiert.16 DS-6157a ist ein Antikörper-Medikament-Konjugat, wobei der Antikörper an GPR20 bindet (wird in GIST exprimiert) und das Medikament einem Topoisomerase-I-Inhibitor entspricht. Eine Tumorverkleinerung wurde bei vier Patienten, welche an einem KIT/PDGFR-Wildtyp-GIST litten, berichtet. Bei einem Patienten mit einem SDH-defizienten GIST und NF1-Mutation konnte eine partielle Remission erreicht werden.
Diese beiden Wirkstoffe gilt es zukünftig aufgrund der Erfolgversprechenden Resultate in jener seltenen Population weiter zu untersuchen. Tabelle 1 liefert dazu einen Überblick über bereits zur Verfügung stehende Daten zur Systemtherapie bei Wildtyp-GIST.
Literatur:
1 Gronchi A et al.: J Clin Oncol 2020; 38: 2178-862 Gronchi A et al.: ASCO 2022; Abstr. #11508 3 Schöffski P et al.: Lancet 2016; 387: 1629-37 4 Chen TWW et al.: ASCO 2022; Abstr. #11506 5 Dickson MA et al.: J Clin Oncol 2013; 31: 2024-8 6 Broto JM et al.: ASCO 2022; Abstr. #11511 7 DʼAngelo SP et al.: ASCO 2022; Abstr. #11500 8 Zhang X et al.: ASCO 2022; Abstr. #11502 9 McCabe M et al.: ASCO 2022; Abstr. #LBA2 10 Brennan B et al.: J Clin Oncol 2020; 38: 11500 11 Womer RB et al.: J Clin Oncol 2012; 30: 4148-54 12 Cash T et al.: ASCO 2022; Abstr. #11505 13 Heesen P et al.: ASCO 2022; Abstr. #11531 14 Gelderbloom H et al.:ASCO 2022; Abstr. #11541 15 Qiu H et al.: ASCO 2022; Abstr. #11513 16 George S et al.: ASCO 2022; Abstr. #11512 17 Sicklick J: ASCO 2022; Vortrag
Das könnte Sie auch interessieren:
Adjuvantes Osimertinib reduziert ZNS-Rezidive bei EGFR-mutierter Erkrankung
Etwa 30% der Patienten mit nicht kleinzelligem Lungenkarzinom (NSCLC) präsentieren sich mit resezierbarer Erkrankung und werden einer kurativen Operation unterzogen. Viele Patienten ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...