Ausblick in die Zukunft: Adjuvante Therapie des Kolorektalkarzinoms
Autor:
Assoc. Prof. Priv.-Doz. Dr. Lukas Weiss, PhD
Universitätsklinik für Innere Medizin III
Salzburg Cancer Research Institute (SCRI)
Laboratory for Immunological and Molecular
Cancer Research (LIMCR)
Center for Clinical Cancer and Immunology Trials (CCCIT)
Paracelsus Medizinische Universität, Salzburg
E-Mail: lu.weiss@salk.at
Optimistisch stimmende Remissionsraten unter Immuntherapie bei Rektumkarzinomen mit Mikrosatelliten-Instabilität bzw. Mismatch-Repair-Defizienz (MSI-H/dMMR) und erste belastbare Daten zum Einsatz von zirkulierender Tumor-DNA (ctDNA) zur Steuerung der adjuvanten Therapie beim Kolonkarzinom im Stadium II kündigen mögliche Paradigmenwechsel in der adjuvanten Therapie des Kolorektalkarzinoms an. Bereits laufende und geplante Studien sollten hier innerhalb der kommenden Jahre eine solide Datenbasis bilden.
Neoadjuvante Anti-PD-1-Therapie bei MSI-H/dMMR-Rektumkarzinom
In eine Phase-II-Studie wurden Patient*innen mit lokal fortgeschrittenem Rektumkarzinom (Stadium II und III) und nachgewiesener Mikrosatelliten-Instabilität oder Mismatch-Repair-Defizienz eingeschlossen.1 Diese Subgruppe stellt etwa 5–10% aller Kolorektalkarzinome dar.
Gemäß Protokoll bestand die Therapie in der Gabe des Anti-PD-1-Antikörpers Dostarlimab 500mg i.v. alle drei Wochen über sechs Monate, gefolgt von einer standardmäßigen Langzeit-Radiochemotherapie mit Capecitabin, gefolgt von einer onkologischen Resektion (totale mesorektale Exzision). Im Falle einer klinisch kompletten Remission (cCR) bereits nach der Immuntherapie oder nach der Radiochemotherapie konnten Patient*innen unter Verzicht auf weitere Behandlungschritte (Radiochemotherapie und/oder Operation) in einem „Watch & wait“-Protokoll nachbeobachtet werden.
Die Remissionsbeurteilung erfolgt anhand der MRT des Rektums (T2- und diffusionsgewichtet), der Rektoskopie inklusive Biopsie und der digital-rektalen Untersuchung. Zusätzlich wurden auch FDG-PET-CT und CT (Thorax bis Becken) durchgeführt.
Die primären Endpunkte umfassten zum einen anhaltende klinisch komplette Remission zwölf Monate nach Ende der Therapie mit Dostarlimab und die Gesamtansprechrate, wobei nun Letztere berichtet wurde. Von den ersten 14 Patient*innen erreichten 100% eine cCR unter Dostarlimab und bislang wurde keine weitere Therapie benötigt (Radiochemotherapie und/oder Operation).
Das mediane Follow-up betrug 6,8 Monate, wobei einige Patient*innen bereits über 20 Monate nachbeobachtet werden konnten. Der Remissionsstatus wurde alle vier Monate kontrolliert. Dostarlimab wurde in dieser kleinen Kohorte sehr gut toleriert, es gab keine Toxizitäten ≥ Grad 3.
Wie können diese Daten eingeordnet werden? Zum einen sind sie wissenschaftlich plausibel: Bei metastasiertem MSI-H/dMMR-Kokorektalkarzinom stellen Pembrolizumab in der Erstlinie und die Kombinationstherapie von Nivolumab und Ipilimumab in der Zweitlinie (nach einer Chemotherapie in der Erstlinie) den aktuellen Standard dar.
Aber auch im lokalisierten Stadium gibt es bereits weitere Belege für die Wirksamkeit der Immuntherapie: So wurden in der NICHE-Studie 32 Patient*innen mit lokalisiertem MSI-H/dMMR-Kolonkarzinom oder Rektumkarzinom im oberen Drittel neoadjuvant mit Nivolumab und Ipilimumab für nur sechs Wochen behandelt. In allen Fällen folgte die Operation und es konnte eine sehr gute pathologische Remission bei 96% der Patient*innen festgestellt werden.2
Auch in der PICC-Studie wurden 34 Patient*innen mit lokalisiertem MSI-H/dMMR-Kolorektalkarzinom einer neoadjuvanten Immuntherapie unterzogen. Hierbei wurde der Anti-PD-1-Antikörper Toripalimab mit oder ohne den COX2-Hemmer Celecoxib neoadjuvant für drei Monate verabreicht. Pathologisch komplette Remissionen wurden bei 65% bzw. 88% der Patient*innen berichtet.3
Zum anderen sind die Daten klinisch hochrelevant: Die Therapie des lokal fortgeschrittenen Rektumkarzinoms beinhaltet in den meisten Fällen eine trimodale Therapie bestehend aus den Komponenten Radiotherapie, Chemotherapie und Chirurgie. Die trimodale Therapie kommt rezent immer häufiger in der Form der sogenannten totalen neoadjuvanten Therapie (TNT) zur Anwendung.
Hierbei werden die Radiotherapie bzw. die Chemoradiotherapie und die nachfolgende Chemotherapie bereits vor der Operation verabreicht. Bei Erreichen einer cCR kann – unter Einhaltung eines engmaschigen Follow-ups – auch auf die nachfolgende Operation verzichtet werden.
In der OPRA-Studie4 lag die Rate des TME-freien Überlebens (entspricht dem non-operativen Management) nach drei Jahren bei Patient*innen mit distalem Rektumkarzinom nach Langzeit-Radiochemotherapie mit Capecitabin gefolgt von vier Monaten Chemotherapie mit CAPOX (Capecitabin und Oxaliplatin) bei 53%.
In Anbetracht dieser Effektivitätsunterschiede im indirekten Vergleich (wobei die MSI-H/dMMR-Subgruppe in der OPRA-Studie nicht untersucht wurde) und der möglichen Auswirkungen der (Chemo-)Radiotherapie und Operation auf Fertilität, Sexualität, Darm- und Blasenfunktion – insbesondere beim distalen Rektumkarzinom – sind die Ergebnisse der Dostarlimab-Studie als klinisch relevant einzuordnen.
Darüber hinaus gibt es Hinweise aus der neoadjuvanten FOxTROT-Studie, dass Patient*innen mit MSI-H/dMMR-Kolorektalkarzinom deutlich weniger von einer Chemotherapie mit FOLFOX (Folinsäure, Fluorouracil und Oxaliplatin) profitieren könnten als bei MSS/pMMR-Tumoren.5
Take-Home-Message 1
Bevor jedoch Anti-PD-1-Antikörper bei der Therapie des lokal fortgeschrittenen MSI-H/dMMR-Rektumkarzinoms ihren Weg in den klinischen Alltag finden, müssen die weiteren klinisch relevanten Endpunkte der vorliegenden Studie abgewartet und die präliminären Daten dieser kleinen monozentrischen Studie im Rahmen größerer, multizentrischer Phase-II- oder Phase-III-Studien bestätigt werden.
Ob zukünftige Studien angesichts der berichteten Effektivitätsunterschiede aus ethischer Sicht in randomisierter Form durchgeführt werden sollten, bleibt fragwürdig. Angesichts der vergleichsweise niederschwelligen Verfügbarkeit von Anti-PD-1-Antikörpern für den individuellen Off-Label-Einsatz in Österreich sollten wir alle Anstrengungen unternehmen, um Patient*innen mit MSI-H/dMMR-Rektumkarzinomen im Rahmen einer hoffentlich auch hierzulande bald zugänglichen Studie zu therapieren, und derart zur Schaffung einer adäquaten Datenlage beitragen.
Non-operatives Management beifrühem Rektumkarzinom
Die großen Studien zur TNT fokussierten vor allem auf die Therapie des lokal fortgeschrittenen Rektumkarzinoms. Die randomisierte Phase-II-Studie STAR-TREC hingegen inkludierte Patient*innen mit frühem Rektumkarzinom (Stadium I bis II), im Detail ≤mrT3b, cN0, cM0 und mit einem Tumordurchmesser von ≤40mm.
Hier wurde im Verhältnis 1:1:1 der Vergleich zwischen
-
einer primären onkologischen Resektion (totale mesorektale Exzision) mit
-
Kurzzeit-Strahlentherapie (5 x 5 Gy) oder
-
Langzeit-Radiochemotherapie (25 x 2 Gy) mit Capecitabin angestellt.
Patient*innen in den beiden (Chemo-)Radiotherapie-Armen wurden in Abhängigkeit vom Ansprechen weiterbehandelt: im Falle einer cCR Observanz, im Fall einer partiellen Remission transanale endoskopische Mikrochirurgie oder im Fall eines schlechten Ansprechens totale mesorektale Exzision nach 20 Wochen.
Der primäre Endpunkt der erfolgreichen Rekrutierung von 120 Patient*innen innerhalb von zwei Jahren wurde erreicht, um die Durchführung einer Phase-III-Studie formal zu ermöglichen. Klinisch interessant sind vor allem die sekundären Endpunkte: Der Organerhalt konnte bei der Mehrheit der Patient*innen erreicht werden, da 60% der 80 Patient*innen in den beiden (Chemo-)Radiotherapie-Armen nach zwölf Monaten noch immer eine cCR aufwiesen. Die Zeit bis zum Rezidiv war bei Organerhalt gleich lang wie nach primärer onkologischer Resektion („non-regrowth disease-free survival“).Vor einer definitiven Einordnung der Daten bleibt sicherlich die Phase-III-Studie abzuwarten. Dennoch erweitern die Ergebnisse dieser Studie die Therapieoptionen und stärken darüber hinaus auch die Rationale, bei lokal fortgeschrittenen Rektumkarzinomen residuelle Tumoren nach totaler neoadjuvanter Therapie gegebenenfalls mittels transanaler endoskopischer Mikrochirurgie zu resezieren.
Take-Home-Message 2
Zusammenfassend ermöglicht die zunehmende Datenlage ein immer differenzierteres, individualisiertes Vorgehen, mit spezieller klinischer Relevanz bei tief sitzenden Rektumkarzinomen und Unmöglichkeit zur Sphinkter-erhaltenden Operation bzw. bei distalen Rektumkarzinomen und somit hohem Risiko für ein „Low Anterior Resection Syndrom“.
Steuerung der adjuvanten Therapie mittels zirkulierender Tumor-DNA (ctDNA)
In der aktuellen klinischen Praxis erfolgt die Indikationsstellung zur adjuvanten Chemotherapie beim Kolonkarzinom im Stadium II bei Vorliegen eines oder mehrerer Risikofaktoren wie pT4, Ileus, Perforation, weniger als zwölf untersuchte Lymphknoten, G3-Differenzierung (sofern MSS/pMMR), L1, V1 oder Pn1.
Bei der Nekrose oder Apoptose von Tumorzellen werden DNA-Abschnitte in den Blutstrom abgegeben – die zirkulierende Tumor-DNA (ctDNA). Mehrere voneinander unabhängige Studien konnten die prognostische Bedeutung des postoperativen Nachweises der ctDNA demonstrieren: Patient*innen mit postoperativer ctDNA-Positivität – entsprechend einer minimalen residuellen Erkrankung (MRD) – weisen ein klinisch relevant und statistisch signifikant kürzeres krankheitsfreies Überleben auf, während Patient*innen bei postoperativer ctDNA-Negativität kaum Rezidive erleiden.
Die DYNAMIC-Studie untersuchte, ob die Zahl der Patient*innen, die eine adjuvante Chemotherapie nach Resektion eines Kolonkarzinoms im Stadium II benötigen, durch eine Indikationsstellung anhand eines positiven postoperativen ctDNA-Nachweises reduziert werden kann.6
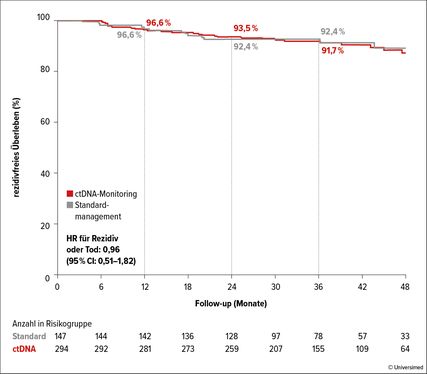
Abb. 1: Klinische Ergebnisse des Managements mit ctDNA-Monitoring im Vergleich mit Standardmanagement bei der ITT-Population. Kaplan-Meier-Kurve des rezidivfreien Überlebens. Nach 6
In dieser multizentrischen Phase-II-Studie wurden insgesamt 455 Patient*innen 2:1 randomisiert: In der einen Gruppe wurde die adjuvante Therapie im Falle von postoperativer ctDNA-Positivität indiziert, in der anderen Gruppe nach klassischen klinischen Risikofaktoren. In der Gruppe mit ctDNA-basierter Therapieentscheidung erhielten nur 15% der Patient*innen eine adjuvante Chemotherapie im Vergleich zu 28% in der Kontrollgruppe.
Hinsichtlich des primären Endpunkts rezidivfreies Überleben nach zwei Jahren war die ctDNA-basierte Therapieentscheidung mit 93,5% der Standardbehandlung mit 92,4% nicht unterlegen (Abb. 1). Das rezidivfreie 3-Jahres-Überleben betrug 86,4% bei ctDNA-positiven Patient*innen, die eine adjuvante Chemotherapie erhielten, und 92,5% bei ctDNA-negativen Patient*innen, die keine adjuvante Therapie erhielten.
Take-Home-Message 3
So konnte die ctDNA-basierte Therapieentscheidung beim Kolonkarzinom im Stadium II den Einsatz von adjuvanter Chemotherapie halbieren, ohne das rezidivfreie Überleben zu beeinträchtigen.
In Österreich wird die CIRCULATE-Studie (NCT04089631) in Kooperation mit der ABCSG (Austrian Breast and Colorectal Cancer Study Group) in 14 Zentren durchgeführt. In dieser internationalen, randomisierten Phase-III-Studie werden insgesamt 2310 Patient*innen eingeschlossen und in Abhängigkeit von der postoperativen ctDNA-Analyse behandelt.
Bei ctDNA-Positivität erfolgt eine Randomisierung in den Therapiearm nach lokalem Standard (FU-basierte Therapie für drei bis sechs Monate) versus Nachbeobachtung. Patient*innen mit postoperativer ctDNA-Negativität werden hingegen ausschließlich nachbeobachtet.
Im Unterschied zur DYNAMIC-Studie wird hier im Speziellen der Einfluss der adjuvanten Therapie in der ctDNA-positiven Hochrisikogruppe untersucht. Die Ergebnisse dieser Studien sind geeignet, das bisherige Standardvorgehen bei Stadium II zukünftig zu ändern.
Literatur:
1 Cercek A et al.: PD-1 blockade in mismatch repair–deficient, locally advanced rectal cancer. N Engl J Med 2022; 386: 2363-76 2 Conroy T et al.: Neoadjuvant chemotherapy with FOLFIRINOX and preoperative chemoradiotherapy for patients with locally advanced rectal cancer (UNICANCER-PRODIGE 23): a multicentre, randomised, open-label, phase 3 trial. Lancet Oncol 2021; 22(5): 702-15 3 Hu H et al.: Neoadjuvant PD-1 blockade with toripalimab, with or without celecoxib, in mismatch repair-deficient or microsatellite instability-high, locally advanced, colorectal cancer (PICC): a single-centre, parallel-group, non-comparative, randomised, phase 2 trial. Lancet Gastroenterol Hepatol 2022; 7(1): 38-48 4 Garcia-Aguilar et al.: Organ preservation in patients with rectal adenocarcinoma treated with total neoadjuvant therapy. J Clin Oncol 2022; 40(23): 2546-56 5 Seymour MT et al.: FOxTROT: an international randomised controlled trial in 1052 patients (pts) evaluating neoadjuvant chemotherapy (NAC) for colon cancer. ASCO 2019; Abstr. #3504 6 Tie J et al.: Circulating tumor DNA analysis guiding adjuvant therapy in stage II colon cancer. N Engl J Med 2022; 386: 2261-72
Das könnte Sie auch interessieren:
Adjuvantes Osimertinib reduziert ZNS-Rezidive bei EGFR-mutierter Erkrankung
Etwa 30% der Patienten mit nicht kleinzelligem Lungenkarzinom (NSCLC) präsentieren sich mit resezierbarer Erkrankung und werden einer kurativen Operation unterzogen. Viele Patienten ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...