Aspekte der Therapiewahl bei frühem Brustkrebs
Bericht:
Dr. Andreas Billich
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die Wahl der optimalen Therapie beim Mammakarzinom (MCa) der biologischen Frau, vor allem im frühen nichtmetastasierten Stadium, stand auch in diesem Jahr im Fokus der St.Gallen-Konferenz. Zum einen wurde der Nutzen etablierter Behandlungsoptionen diskutiert, zum anderen wurden neue systemische Therapien vorgestellt.
Endokrine Therapie im Überblick
Prof. Stefan Aebi; Luzern, Schweiz:
Tamoxifen (TAM) ist nach wie vor der Vergleichsmaßstab für die adjuvante endokrine Therapie beim Östrogenrezeptor-positiven (ER+) MCa, mit einer Reduktion der Mortalität nach fünf Therapiejahren um ca. ein Drittel.1 Kann dies durch zusätzliche oder alternative Behandlungen übertroffen werden?
Bei prämenopausalen Patient*innen führte eine Ovarialfunktionssuppression (OFS) zusätzlich zu TAM in Studien zu verbesserten klinischen Ergebnissen, vor allen bei Hochrisiko-MCa.2,3 Verwendung eines Aromataseinhibitors (AI) statt TAM (jeweils plus OFS) reduzierte das Rezidivrisiko, doch eine Senkung der MCa-bedingten Mortalität ist noch nicht nachgewiesen.4 Eine Entscheidungshilfe im Einzelfall bei der Wahl zwischen AI oder TAM und von zusätzlicher OFS bietet ein neues Webtool mit dem Namen „Tailoring Adjuvant Endocrine Therapy for Premenopausal Women“ ( online abzurufen ). In der Regel wird man bei hohem Risiko OFS anwenden und TAM durch einen AI ersetzen.
Bei postmenopausalen Frauen mit MCa bietet die Behandlung mit AI (als Monotherapie oder sequenziell nach TAM) einen Überlebensvorteil gegenüber TAM.5 Eine Dauer der endokrinen Therapie von insgesamt sieben Jahren ist bei den meisten Patient*innen angemessen.
Die Wirksamkeit der endokrinen Therapie ist unabhängig davon, ob auch eine adjuvante Chemotherapie (CTx) durchgeführt wurde oder nicht. Patient*innen mit sehr hohem Risiko für ein Rezidiv eines ER-positiven HER2-negativen MCa nach CTx profitieren von der Zufügung eines CDK4/6-Inhibitors zur endokrinen Standardtherapie, wie Daten aus der MonarchE-Studie mit Abemaciclib zeigen.6
Neue Wirkstoffe für die endokrine Therapie
Prof. Miguel Martin; Madrid, Spanien:
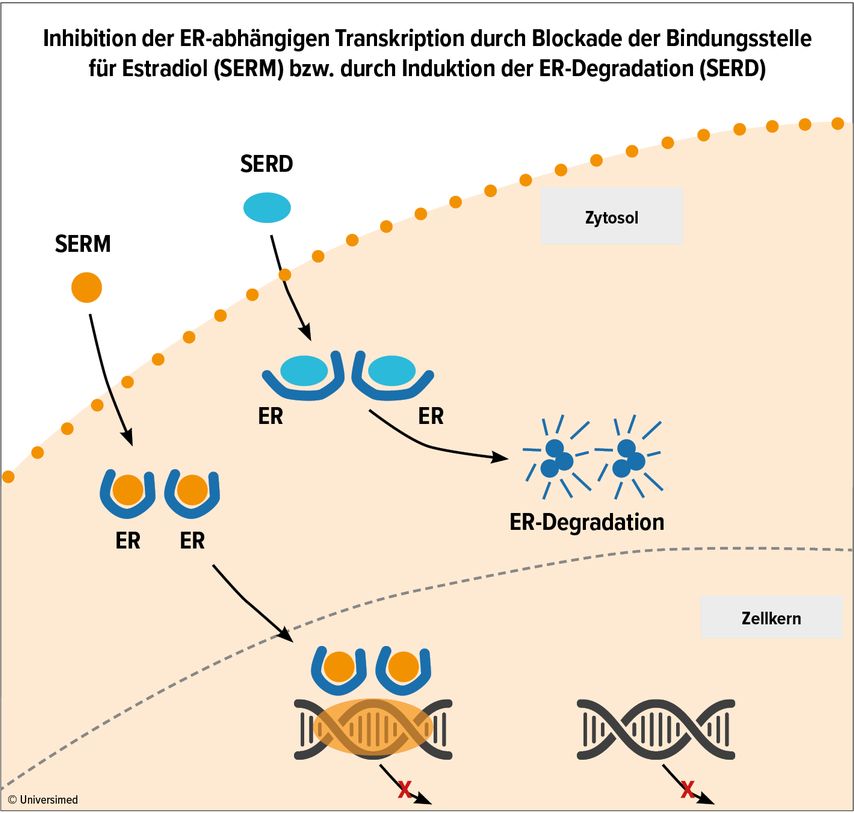
Der Östrogenrezeptor erscheint als das beste Target für die endokrine Therapie bei ER-positivem MCa. Das seit Langem bewährte TAM ist ein selektiver ER-Modulator (SERM); es wirkt im Brustgewebe als Östrogenantagonist, wodurch die transkriptionelle Aktivität des Rezeptors blockiert wird. Lasofoxifen, ein SERM der neueren Generation mit FDA-Zulassung als Osteoporosemedikament, ist in klinischer Entwicklung bei MCa.
Potenter als TAM sind neue selektive ER-Degrader (SERD), die an den ER binden und seinen Abbau induzieren (Abb. 1).7 Diese wirken im Gegensatz zu TAM unabhängig vom Mutationsstatus des ER; dies ist wichtig, da die Häufigkeit von Mutationen im ER nach Progression unter endokriner Therapie mit AI bis zu 40% beträgt. Orale SERD (Camizestrant, Elacestrant, Giredestrant, Imlunestrant, Rintodestrant), die potenter als intramuskuläres Fulvestrant (der erste Vertreter dieser Klasse) sind, befinden sich in klinischer Entwicklung, sowohl bei frühem MCa als auch im metastasierten Setting, z.B. nach oder kombiniert mit CDK4/6-Inhibitoren. Beispielsweise zeigte sich mit Elacestrant bei fortgeschrittenem ER-positivem HER2-negativem MCa nach Progression unter endokriner Therapie und CDK4/6-Inhibition ein längeres progressionsfreies Überleben (PFS) als mit einer konventionellen endokrinen Therapie, und zwar auch bei mutiertem ER.8
Abb. 1: Wirkungsweise von SERM und SERD am Östrogenrezeptor (ER). Modifiziert nach Wang Y & Tang SC7
Bei frühem MCa werden SERD im adjuvanten Setting in zwei verschiedenen Szenarien getestet: entweder als erste endokrine Therapie nach der Operation oder im Austausch gegen eine schon mindestens zwei Jahre durchgeführte endokrine Therapie. Phase-III-Studien mit Giredestrant und Imlunestrant sind unterwegs.
Neben neuen SERM und SERD sind auch andere Klassen endokriner Wirkstoffe in Entwicklung: selektive kovalente ER-Antagonisten (SERCA),9 ER-gerichtete „proteolysis targeting chimeras“ (PROTAC)10 und komplette ER-Antagonisten (CERAN).11
Chemotherapie beim frühen MCa
Prof. Jonas Bergh; Stockholm, Schweden:
Der Stellenwert der CTx wurde über viele Jahre kontroversiell diskutiert. Klar ist heute, dass bei ER-positivem MCa ohne hohes genomisches Risiko (Recurrence Score ≤25) eine CTx bei postmenopausalen Patientinnen nicht notwendig ist (sofern eine optimale endokrine Therapie erfolgt).12 Niedriggradige MCa, wie sie häufig beim Screening entdeckt werden, profitieren daher oftmals nicht von einer CTx.
Dagegen ergab sich z.B. in der Studie RxPONDER bei prämenopausalem MCa mit Lymphknotenbefall (N+) ein Vorteil für die Behandlung mit einer CTx zusätzlich zur endokrinen Therapie.13 Die 5-Jahres-Rate des progressionsfreien Überlebens (PFS) wurde durch die CTx von 89% auf 94,2% erhöht (HR: 0,54). Es ist unklar, ob dies ein direkter Effekt der CTx ist oder Konsequenz einer CTx-induzierten Menopause.
Die Studie TAILORx bei Frauen mit nodalnegativem (N–), ER-positivem, HER2-negativem MCa zeigte nur bei Frauen unter 50 Jahren und mit mittelgradigem Risiko-Score einen gewissen Nutzen für die zusätzliche CTx.14
Sofern eine adjuvante CTx indiziert ist, ist deren relativer Nutzen beim frühen MCa unabhängig von Risikofaktoren (Alter, Stadium etc.) und vom Hormonrezeptor(HR)- bzw. HER2-Status.15 Dosisintensivierte CTx-Regime zeigten sich in allen Subgruppen als moderat überlegen hinsichtlich Rezidivrisiko und Mortalität.16 Auch Tumoren vom Luminal-A-Subtyp können ein Ansprechen zeigen, doch ist dieses deutlich besser bei Luminal-B- und vor allem bei HER2-positivem und bei tripelnegativem Brustkrebs (TNBC).17
Genexpressionsprofile (GEP) können bei der Entscheidung für oder gegen eine adjuvante CTx helfen. Es wird vorgeschlagen, bei Patient*innen mit frühem ER-positivem, HER2-negativem, N– MCa mit hohem Rezidivrisiko gemäß GEP eine CTx vorzusehen, nicht aber bei niedrigem Risiko.18 Der ER-Status allein sollte dagegen nie über den Einsatz einer CTx entscheiden.
Adjuvante Therapie mit CDK4/6-Inhibitoren
Prof. Zefei Jiang; Beijing, China:
Trotz endokriner Therapie kommt es in etwa 20% der Fälle von MCa zu Rezidiv und Progress.5 Das Risiko für ein distantes Rezidiv korreliert dabei mit dem Ausmaß des anfänglichen Lymphknotenbefalls.19 In der bereits erwähnten MonarchE-Studie wurde gezeigt, dass ein CDK4/6-Inhibitor als Zusatz zur endokrinen Therapie das Rezidivrisiko bei HR-positivem, HER2-negativem MCa verringern kann.6 Dies ist der erste wesentliche Fortschritt für diese Indikation seit Einführung der AI-Inhibitoren vor über 15 Jahren.
Welche Patient*innen können von dieser Behandlung profitieren? Die Studiendaten zeigen, dass dies jene mit hohem Risiko sind, definiert als Befall von ≥4 Lymphknoten oder von 1–3 Lymphknoten bei Erkrankung vom Grad G3 oder Tumorgröße ≥5cm; in dieser Subpopulation betrug die absolute Reduktion der 4-Jahres-PFS-Rate 6,9% (HR: 0,65).6 Der Nutzen der CDK4/6-Inhibitor-Therapie war unabhängig von der Höhe des Ki67-Index.20 Auch Patient*innen, die zuvor eine neoadjuvante CTx erhalten hatten (meist jüngere mit größeren Tumoren), profitierten.21 Schließlich spielte es für die Wirksamkeit der CDK4/6-Inhibition bei prämenopausalen Patient*innen keine Rolle, ob TAM oder ein AI für die endokrine Therapie gewählt wurde.22
Immuntherapie (Itx) beim frühen MCa
Prof. Meteb Al-Foheidi; Riad, Saudi-Arabien:
Der Immuncheckpoint-Inhibitor Pembrolizumab ist beim frühen TNBC mit hohem Rezidivrisiko in Kombination mit neoadjuvanter CTx zugelassen. Grundlage dafür ist die KEYNOTE-522-Studie, die bei Patient*innen mit TNBC eine signifikante Erhöhung des pathologischen Komplettansprechens (pCR) durch die Chemoimmuntherapie im Vergleich zur CTx allein zeigte (64,8% vs. 51,2%).23 Die bekannten Nebenwirkungen der CTx wurden durch Pembrolizumab nicht verstärkt, doch gab die Itx verglichen mit Placebo Anlass zu vermehrten, teils schweren immunvermittelten Komplikationen (14,9% vs. 2,1% vom Grad 2–5).
Weitere große Studien mit den PD-L1-Hemmern Durvalumab24 und Atezolizumab25 haben ein verbessertes klinisches Ergebnis beim frühen TNBC gezeigt, wenn sie der neoadjuvanten CTx hinzugefügt wurden. Der Nutzen der Itx war in allen Fällen unabhängig vom PD-L1-Status, ist aber jeweils gegen die zwar seltenen, doch teilweise mit lebenslangen Konsequenzen verbundenen Nebenwirkungen abzuwägen.
Jenseits vom TNBC wird die mögliche Rolle einer Itx auch bei frühem HR-positivem MCa in noch laufenden Phase-III-Studien untersucht. Beim frühen HER2-positiven MCa ist nach negativen Resultaten einer Kombinationsstudie von Atezolizumab mit neoadjuvanter CTx derzeit kein Nutzen einer Itx erkennbar.26
Post-neoadjuvante Therapieoptionen beim TNBC
Dr. Javier Cortés; Madrid, Spanien:
Beim frühen MCa kann nach einer neoadjuvanten Systemtherapie und abgeschlossener Lokaltherapie eine risikoadaptierte adjuvante Behandlung erfolgen. Welche TNBC-Patient*innen profitieren von dieser post-neoadjuvanten Therapie?
Allgemeine Praxis ist, bei Erreichen einer pCR keine adjuvante CTx durchzuführen, was auch durch Studiendaten unterstützt wird.27 Jedoch wurde gezeigt, dass bei TNBC-Patient*innen mit pCR und niedriger Expression von PD1 eine zusätzliche CTx sehr wohl einen Vorteil bietet.28
In der schon erwähnten KEYNOTE-522-Studie wurde das Ergebnis bei Patient*innen, die zusätzlich zur neoadjuvanten Chemoimmuntherapie auch adjuvantes Pembrolizumab erhielten, weiter verbessert.23 Allerdings profitierten hier vor allem diejenigen, die nach neoadjuvanter Chemoimmuntherapie und Operation keine pCRerreicht hatten. Trotzdem plädierte Cortés für eine Fortsetzung der Itx mit Pembrolizumab im adjuvanten Setting, selbst wenn zuvor pCR erzielt wurde.
Welche adjuvante Therapie können TNBC-Patient*innen bei Nicht-Erreichen von pCR nach CTx und Operation erhalten? Eine Option ist die adjuvante Behandlung mit Capecitabin, für die ein Überlebensvorteil in diesem Setting gezeigt wurde.29 Eine zweite Option ist die Poly(ADP-ribose)-Polymerase(PARP)-Inhibition.
Die Wirksamkeit einer post-neoadjuvanten Therapie mit dem PARP-Inhibitor Olaparib wurde in der OlympiA-Studie bei Patient*innen mit HER2-negativem MCa im Frühstadium, hohem Rezidivrisiko und pathogenen Keimbahnmutationen von BRCA1 oder BRCA2 untersucht.30 Eingeschlossen wurden sowohl Patient*innen mit HR-positiven als auch solche mit tripelnegativen Tumoren. Die Behandlung mit Olaparib nach abgeschlossener Lokaltherapie und neoadjuvanter oder adjuvanter CTx ergab im Vergleich zu Placebo ein signifikant längeres Überleben ohne invasive oder distante Erkrankung (Dreijahresrate: 85,9% vs. 77,1%; HR: 0,68)31 und auch einen Vorteil hinsichtlich des Gesamtüberlebens.32
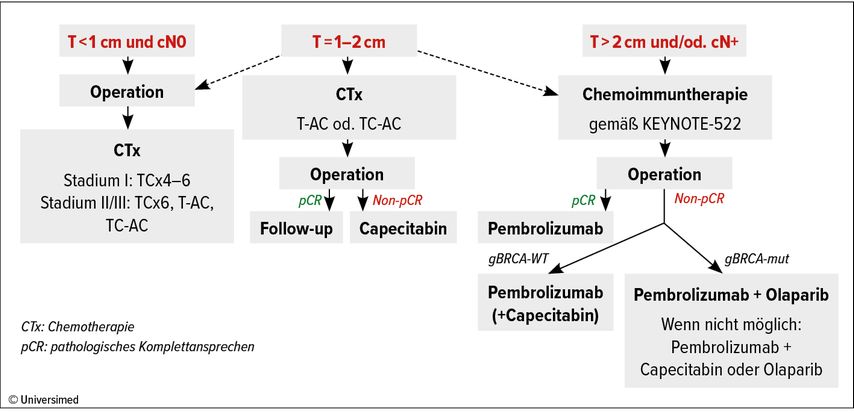
Abschließend schlug Cortés einen Algorithmus für das Management von frühem TNBC vor (Abb. 2).
Neue Therapien beim HER2-positiven MCa
Prof. Martine Piccart; Brüssel, Belgien:
Zu den etablierten und wirksamsten Behandlungsstrategien beim HER2-positiven Brustkrebs gehören die duale HER2-Blockade mit den Antikörpern Trastuzumab und Pertuzumab, das Antikörper-Wirkstoff-Konjugat Trastuzumab Deruxtecan (T-DXd) und der HER2-Tyrosinkinasehemmer Tucatinib.
Trastuzumab/Pertuzumab plus Taxan ist die unbestrittene Erstlinientherapie beim fortgeschrittenen HER2-positiven MCa.33 In der Zweit- oder Drittlinie ist T-DXd dem Konjugat Trastuzumab Emtansin (T-DM1) klar überlegen,34 und T-DXd und Tucatinib sind beide auch einer Trastuzumab/Capecitabin-Kombination überlegen.35,36
Die Therapielandschaft könnte sich aber bald aufgrund neuer Daten bzw. noch laufender Studien ändern; z.B. könnten T-DXd oder T-DXd/Pertuzumab in die Erstlinie vorrücken. Alternativ könnte Trastuzumab/Pertuzumab in der Erstlinie mit Atezolizumab oder Tucatinib kombiniert werden, oder bei ER-positivem MCa mit dem CDK4/6-Hemmer Palbociclib oder dem SERD Giredestrant, oder bei PI3KCA-Mutation mit Alpelisib.
In der Zweitlinie könnte Tucatinib der bevorzugte Kombinationspartner von T-DXd und T-DM1 werden, und die Kombination von T-DM1 mit Atezolizumab könnte eine Rolle spielen. Im post-neoadjuvanten Setting beim frühen HER2-positiven MCa bei Patient*innen mit Resterkrankung könnte T-DM1 als bisheriger Therapiestandard durch T-DXd oder Kombinationen von T-DM1 mit Atezolizumab oder Tucatinib abgelöst werden. Kritisch zu sehen sind allerdings die möglicherweise gesteigerte Toxizität von Kombinationen und auch die Kosten.
Eine Flut von neuen zielgerichteten Therapien ist derzeit noch in frühen Phasen der Entwicklung: neue Antikörper gegen HER2 und HER3, neue Antikörper-Wirkstoff-Konjugate, bispezifische Antikörper gegen HER2 und Immunzellen sowie Kombinationen mit weiteren Checkpointinhibitoren.
Quelle:
18th St. Gallen International Breast Cancer Conference 2023
Literatur:
1 EBCTCG et al.: Lancet 2011; 378: 771-84 2 Francis PA et al.: J Clin Oncol 2023; 41: 1370-5 3 Kim HA et al.: J Clin Oncol 2020; 38: 434-43 4 EBCTCG et al.: Lancet Oncol 2022; 23: 382-92 5 EBCTCG et al.: Lancet 2015; 386: 1341-52 6 Johnston SRD et al.: Lancet Oncol 2023; 24: 77-90 7 Wang Y, Tang SC: Cancer Metastasis Rev 2022; 41: 975-90 8 Bardia A et al.: SABCS 2021, Abstr. #GS2-02 9 Hamilton EP et al.: J Clin Oncol 2021; 39(15_Suppl): 1018 10 Hamilton EP et al.: J Clin Oncol 2022; 40(16_Suppl): TPS1120 11 Hodges-Gallagher L et al.: Cancer Res 2020; 80(16_Suppl): Abstr. #4376 12 Kalinsky K et al.: N Engl J Med 2021; 385: 2336-47 13 Kalinsky K et al.: SABCS 2020, Abstr. #GS3-00 14 Sparano JA et al.: N Engl J Med 2018; 379: 111-21 15 EBCTCG et al.: Lancet 2012; 379: 432-44 16 EBCTCG et al.: Lancet 2019; 393: 1440-52 17 Bonnefoi H et al.: Ann Oncol 2014; 25: 1128-36 18. Matikas A et al.: Ann Oncol 2019; 30: 1044-50 19 Pan H et al.: N Engl J Med 2017; 377: 1836-46 20 Johnston S et al.: SABCS 2022; Abstr. #GS1-09 21 Martin M et al.: ASCO 2021; Abstr. #517 22 Paluch-Simon S et al.: ESMO 2022; Poster 63 23 Schmid P et al.: N Engl J Med 2020; 382: 810-21 24 Loibl S et al.: Ann Oncol 2019; 30: 1279-88 25 Mittendorf EA et al.: Lancet 2020; 396: 1090-100 26 Huober J et al.: J Clin Oncol 2022; 40: 2946-56 27 Spring LM et al.: Cancer Res 2019; 79 (4_Suppl.): GS2-03 28 Gluz O et al.: Cancer Res 2019; 79 (4_Suppl.): GS5-06 29 Masuda N et al.: N Engl J Med 2017; 376: 2147-59 30 Lee J: J Clin Med 2023; 12: 1524 31 Tutt ANJ et al.: N Engl J Med 2021; 384: 2394-405 32 Geyer CE et al.: Ann Oncol 2022; 33: 1250-68 33 Swain SM et al.: Lancet Oncol 2020; 21: 519-30 34 Hurvitz SA et al.: Lancet 2023; 401: 105-17 35 Krop I et al.: SABCS 2022; Abstr. #GS2-01 36 Lin NU et al.: J Clin Oncol 2020; 38: 2610-19
Das könnte Sie auch interessieren:
Adjuvantes Osimertinib reduziert ZNS-Rezidive bei EGFR-mutierter Erkrankung
Etwa 30% der Patienten mit nicht kleinzelligem Lungenkarzinom (NSCLC) präsentieren sich mit resezierbarer Erkrankung und werden einer kurativen Operation unterzogen. Viele Patienten ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...