ASCO-Update 2020 zum metastasierten Kolorektalkarzinom
Autor:
Priv.-Doz. Ltd. OA Dr.Lukas Weiss, PhD
Universitätsklinik für Innere Medizin III
Paracelsus Medizinische Privatuniversität
Salzburg Cancer Research Institute (SCRI)
Cancer Cluster Salzburg
E-Mail: lu.weiss@salk.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Auf der diesjährigen Jahrestagung der American Society of Clinical Oncology (ASCO) wurden interessante Ergebnisse zum metastasierten Kolorektalkarzinom (mCRC) vorgestellt. Besonderes Augenmerk lag dabei auf Subgruppen mit klinischer Relevanz: Therapieoptionen für mCRC-Patienten mit hoher Mikrosatelliten-Instabilität (MSI-H), mit BRAF-Mutation und wohl bald auch für jene mit HER2(„Human epidermal growth factor receptor 2“)-Überexpression finden den Weg in den klinischen Alltag.
Keypoints
-
Die PD-1-Blockade mit Pembrolizumab stellt den neuen Standard in der Erstlinientherapie des mCRC mit MSI-H oder dMMR dar.
-
Encorafenib plus Cetuximab stellen den neuen – bereits zugelassenen – Standard in der Zweitlinientherapie des mCRC mit BRAF-V600E-Mutation dar.
-
Erste vielversprechende Daten zum Einsatz von Trastuzumab Deruxtecan bei HER2-positivem mCRC lassen auf eine weitere zielgerichtete Therapieoption bei mCRC hoffen.
Erstlinientherapie mit Pembrolizumab bei mCRC mit MSI-H
Eine hohe Mikrosatelliten-Instabilität (MSI-H) oder eine Mismatch-Reparatur-Defizienz (dMMR) kann bei etwa 5% aller Patienten mit metastasiertem Kolorektalkarzinom (mCRC) nachgewiesen werden und ist mit einer deutlich erhöhten Tumor-Mutationslast vergesellschaftet. Nach bereits überzeugenden Ergebnissen aus mehreren Phase-I- und -II-Studien konnte mit der KEYNOTE-177-Studie1 erstmals in einer randomisierten Phase-III-Studie die Überlegenheit einer PD-1(„Programmedcell death protein 1“)-Blockade gegenüber einer Chemotherapie in der Erstlinientherapie von Patienten mit MSI-H- oder dMMR-mCRC gezeigt werden.
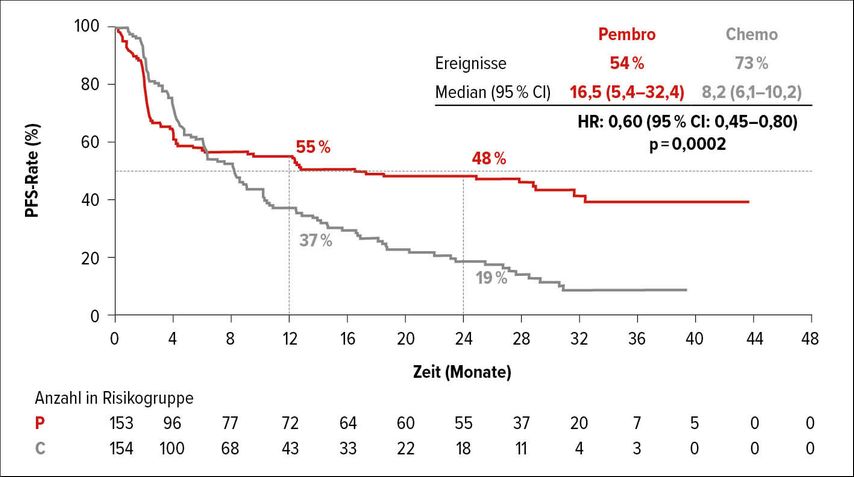
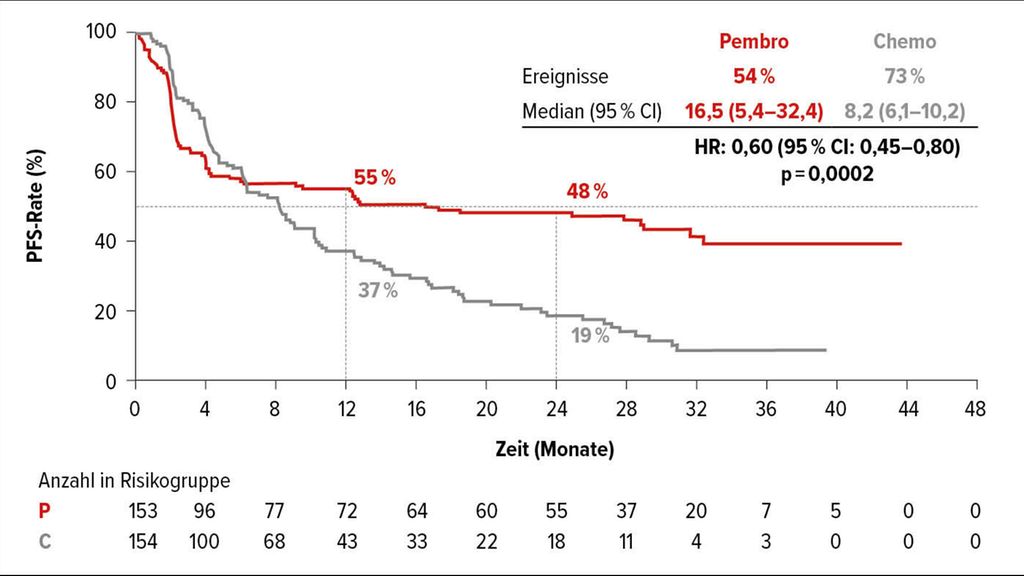
Hierbei wurde bei insgesamt 307 Patienten eine Immuntherapie mit Pembrolizumab mit einer Doublet-Chemotherapie mit Biologika (mFOLFOX6 oder FOLFIRI in Kombination mit Bevacizumab oder Cetuximab) verglichen. Das progressionsfreie Überleben (PFS) konnte durch Pembrolizumab verdoppelt werden, mit 16,5 Monaten medianem PFS gegenüber 8,2 Monaten mit Standard-Chemotherapie (HR:0,60; 95%CI:0,45–0,80; p=0,0002; Abb. 1). Sowohl die Gesamtansprechrate (ORR) mit 43,8% vs. 33,1%(p=0,0275) als auch die kompletten Remissionen (CR) mit 11,1% vs. 3,9% sprechen klar für die Therapie mit Pembrolizumab.
Abb. 1: Verdopplung des medianen PFS von mCRC-Patienten durch Pembrolizumab verglichen mit einer Doublet-Chemotherapie mit Biologika. Modifiziert nach André T et al.1
Wie von anderen Indikationen bekannt, konnten auch hier langanhaltende Remissionen beobachtet werden: eine Ansprechdauer ≥24 Monate bei 83% der Patienten im Pembrolizumab-Arm gegenüber 35% im Kontrollarm. Eine Aussage hinsichtlich des Gesamtüberlebens (OS) ist derzeit noch nicht möglich, diese könnte jedoch durch die hohe effektive Crossoverrate verfälscht werden: Immerhin 59% der Patienten des Kontrollarms erhielten im Weiteren eine Anti-PD-1/PD-L1-Therapie bei Progress. Ein gewohntes Bild zeigt sich in Bezug auf die Sicherheit: 22% der Patienten erfuhren ≥Grad-3-Toxizitäten unter Pembrolizumab gegenüber 66% im Doublet-Chemotherapie-Arm.
Zweitlinientherapie mit Encorafenib + Cetuximab beim BRAFmt mCRC
Bei etwa 8–10% der mCRC-Patienten weisen die Tumorzellen eine BRAF-V600E-Mutation auf. Die BRAF-mutierte Erkrankung ist geprägt von einem aggressiven klinischen Verlauf, häufig begleitet von Peritonealkarzinose, und mit einer besonders schlechten Prognose assoziiert. Im Gegensatz zur dramatischen Effektivität beim malignen Melanom schien im Falle des Kolorektalkarzinoms die alleinige BRAF-Inhibition bei vorliegender BRAF-V600E-Mutation beinahe wirkungslos. So musste der sogenannte „Benchto bedside“-Zyklus zweimal durchlaufen werden, ehe der BRAF-Signalweg auch beim BRAF-V600E-mutierten Kolorektalkarzinom erfolgreich inhibiert werden konnte.
Die BEACON-Studie2 ist die erste randomisierte Phase-III-Studie in der Subgruppe des BRAF-V600E-mutierten mCRC. Insgesamt 665 Patienten wurden nach 1 bis 2 Vortherapien randomisiert für eine Therapie mit dem Anti-EGFR(„epidermal growth factor receptor“)-Antikörper Cetuximab in Kombination mit dem BRAF-Inhibitor Encorafenib mit und ohne zusätzliche MEK-Inhibition mit Binimetinib, oder in den Kontrollarm mit FOLFIRI oder Irinotecan und Cetuximab.
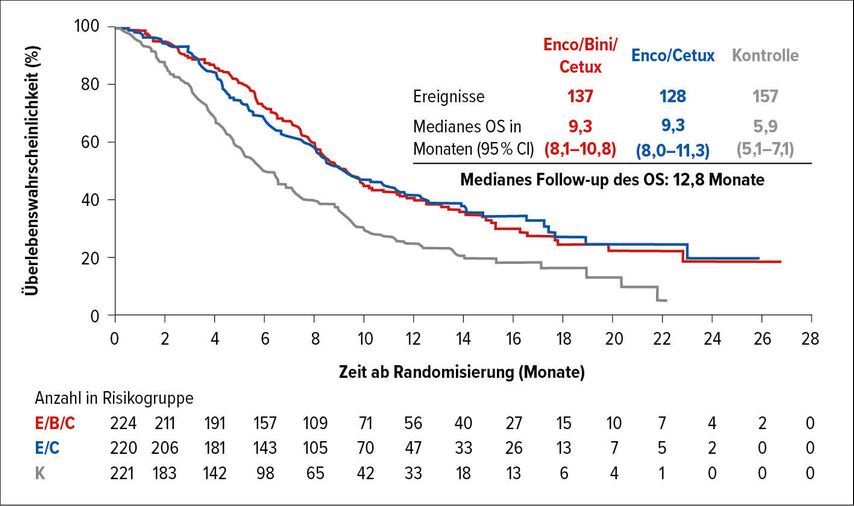
Während die Überlegenheit der chemotherapiefreien Kombinationen bereits berichtet wurde, zeigte sich in dem am diesjährigen ASCO-Kongress präsentierten Update eine Gleichwertigkeit der zweifachen und der dreifachen BRAF-Signalweg-Inhibition: Das mediane OS war mit 9,3 Monaten deckungsgleich für die Arme Cetuximab und Encorafenib mit oder ohne Binimetinib im Vergleich zu 5,9 Monaten im Chemotherapie-Kontrollarm (HR: 0,60 bzw. 0,61) (Abb. 2).
Abb. 2: Medianes OS von mCRC-Patienten mit BRAF-V600E-Mutation unter Encorafenib und Cetuximab +/– Binimetinib. Modifiziert nach Kopetz S et al.2
Diese Daten führten zur Zulassung der Zweifachkombination mit Cetuximab und Encorafenib in der Zweitlinientherapie des mCRC mit BRAF-V600E-Mutation. Ein gewisser Vorteil im Vergleich der Dreifach- gegenüber der Zweifachkombination zeigt sich in Bezug auf die Ansprechrate mit 27% vs. 20%, bei jedoch höherer Toxizität mit 58% vs. 50% an Grad-3/4-Toxizitäten.
Trastuzumab Deruxtecan bei HER2+ mCRC
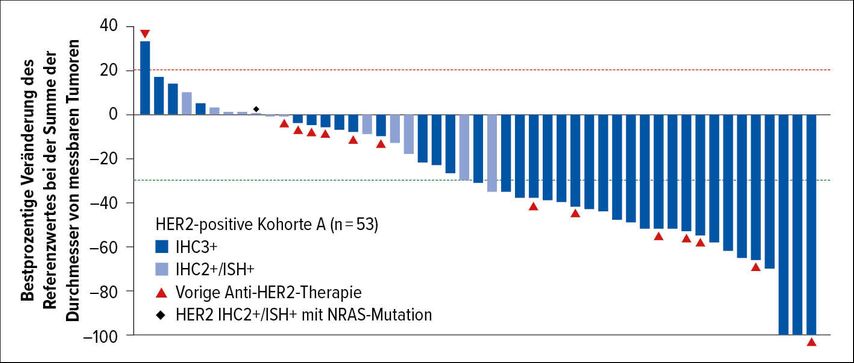
Die einarmige Phase-II-Studie DESTINY-CRC013 untersuchte den Einsatz von Trastuzumab Deruxtecan bei HER2(„human epidermal growth factor receptor 2“)-positivem mCRC. Dieses Antikörper-Konjugat besteht aus dem Anti-HER2-Antikörper Trastuzumab und dem Topoisomerase-I-Hemmer Deruxtecan. Am ASCO-Kongress wurden die Ergebnisse der Kohorte A mit 53 Patienten mit klar HER2-positiver Erkrankung (HER2-IHC[Immunhistochemie]3-positiv oder IHC2-positiv/ISH[In-situ-Hybridisation]-positiv) präsentiert. Angesichts der im Median vier Vortherapien überraschen die hohe Ansprechrate von 45,3% und eine Krankheitskontrollrate von 83,0% (Abb.3).
Abb. 3: Deutliches Ansprechen mit Trastuzumab Deruxtecan bei HER2-positivem mCRC. Modifiziert nach Siena S et al.3
Besonders bemerkenswert: Auch bei einem Teil der bereits anti-HER2-vorbehandelten Patienten konnte ein Ansprechen erzielt werden. Das mediane PFS betrug 6,9 Monate, die mediane Ansprechdauer und auch das mediane Überleben sind noch nicht erreicht. Wie bereits aus anderen Studien mit Trastuzumab Deruxtecan bekannt, muss besonderes Augenmerk auf die Lungentoxizität gelegt werden: 2 von 53 Patienten starben therapiebedingt an Pneumonitis bzw. interstitieller Lungenerkrankung.
Literatur:
1 André T et al.: Pembrolizumab versus chemotherapy for microsatellite instability-high/mismatch repair deficient metastatic colorectal cancer: the phase 3 KEYNOTE-177 study. ASCO 2020; Abstr. #LBA4 2 Kopetz S et al.: Encorafenib plus cetuximab with or without binimetinib for BRAF V600E-mutant metastatic colorectal cancer: quality-of-life results from a randomized, three-arm, phase III study versus the choice of either irinotecan or FOLFIRI plus cetuximab (BEACON CRC).ASCO 2020; Abstr. #4001 3 Siena S et al: A phase II, multicenter, open-label study of trastuzumab deruxtecan in patients with HER2-expressing metastatic colorectal cancer: DESTINY-CRC01. ASCO 2020; Abstr. #4001
Das könnte Sie auch interessieren:
Adjuvantes Osimertinib reduziert ZNS-Rezidive bei EGFR-mutierter Erkrankung
Etwa 30% der Patienten mit nicht kleinzelligem Lungenkarzinom (NSCLC) präsentieren sich mit resezierbarer Erkrankung und werden einer kurativen Operation unterzogen. Viele Patienten ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...