HFrEF: von der 4-Säulen-Therapie zur individualisierten Versorgung
Autor:
Dr. Christoph Clemens Kaufmann, MD
3. Medizinische Abteilung mit Kardiologie und Intensivmedizin, Klinik Ottakring
E-Mail: Christoph.C.Kaufmann@gmail.com
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
In den letzten Jahren haben sich die therapeutischen Optionen bei HFrEF verändert. Neue Wirkstoffklassen, rasche Aufdosierungsalgorithmen und ein immer individualisierterer Ansatz prägen die Therapie. Dieser Beitrag erläutert den aktuellen Stand der Evidenz und zeigt, wie die Therapie im Jahr 2026 umgesetzt werden sollte.
Keypoints
-
Die 4-Säulen-Therapie (RAAS-Blockade, Betablocker, MRA, SGLT2i) ist die Standardtherapie der HFrEF und sollte möglichst rasch etabliert werden.
-
Neue Studien zu Vericiguat und Digitoxin bei HFrEF können das therapeutische Spektrum im Jahr 2026 erweitern.
-
Die Zukunft liegt in der individualisierten, multidisziplinären Versorgung von HFrEF-Patienten.
Die HFrEF ist definiert durch klinische Symptome und Zeichen einer Herzinsuffizienz sowie durch eine linksventrikuläre Ejektionsfraktion (LVEF) ≤40%.1 Pathophysiologisch kommt es in der Krankheitsentstehung zu einer Kombination aus myokardialer Schädigung, neurohumoraler Aktivierung (Renin-Angiotensin-Aldosteron-System, Sympathikus- und Natriuretisches-Peptid-System) und kardialem Remodeling.2 Das Ziel einer leitliniengerechten Herzinsuffizienztherapie ist es, in die pathologischen, neurohumoralen Achsen einzugreifen sowie die Symptome und Prognose des einzelnen Patienten zu verbessern.2
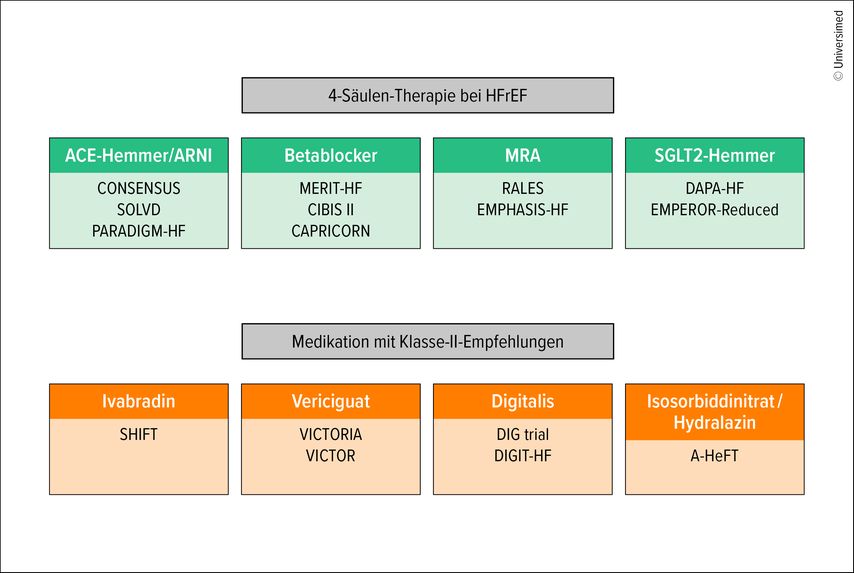
Historisch entwickelte sich die heutige evidenzbasierte HFrEF-Therapie schrittweise: Zunächst wurden ACE-Hemmer eingeführt (CONSENSUS, SOLVD), gefolgt von Betablockern (CIBIS-II, MERIT-HF, CAPRICORN), Mineralokortikoidrezeptorantagonisten (MRA; RALES, EMPHASIS-HF), Angiotensin-Neprilysin-Inhibitoren (ARNI; PARADIGM-HF) und schließlich Sodium-Glukose-Cotransporter-2-Inhibitoren (SGLT2-Inhibitoren; DAPA-HF, EMPEROR-Reduced). Diese vier Substanzklassen bilden heute die Basis jeder leitliniengerechten Therapie der HFrEF und sind in der klinischen Routine angekommen.1
Therapiesäulen der HFrEF – Quadrupeltherapie
Renin-Angiotensin-System: ACE-Hemmer, AT-II-Rezeptorblocker & ARNI
ACE-Hemmer sind seit den 1980er/1990er-Jahren ein wesentlicher Bestandteil in der Behandlung von Patienten mit Herzinsuffizienz. In der SOLVD-Studie konnte unter Therapie mit Enalapril eine Mortalitätsreduktion von 16% gezeigt werden.3 Für Patienten mit ACE-Hemmer-Unverträglichkeit stehen Angiotensin-II-Rezeptorblocker (AT-II bzw. ARB) als alternative Therapieoption zur Verfügung. Die Ergebnisse der PARADIGM-HF-Studie stellen einen Paradigmenwechsel in der Renin-Angiotensin-System(RAAS)-Blockade bei Patienten mit HFrEF dar, mit einem signifikanten Vorteil von Sacubitril/Valsartan im Vergleich zu Enalapril. Bei 8842 Patienten mit HFrEF wurde unter Sacubitril/Valsartan eine Reduktion von kardiovaskulärem Tod und Hospitalisierungen um 20% beobachtet.4 Folglich besteht bei Patienten mit HFrEF eine Klasse-I-Empfehlung zum Ersatz eines ACE-Hemmers durch einen ARNI.1
Betablocker
Analog zur RAAS-Blockade gilt die Betablockertherapie seit vielen Jahrzehnten als zentraler Bestandteil der leitliniengerechten Behandlung der Herzinsuffizienz. Mehrere randomisiert-kontrollierte Studien belegen den prognostischen Stellenwert von Betablockern bei Patienten mit HFrEF. So zeigte die MERIT-HF-Studie unter Metoprolol und CIBIS-II unter Bisoprolol eine Mortalitätsreduktion von 34%. Die CAPRICORN-Studie konnte unter Carvedilol eine Reduktion von 23% verzeichnen.5–7 Der prognostische Nutzen von Betablockern ist für Patienten mit HFrEF im Sinusrhythmus unbestritten, während die Evidenz bei Patienten mit Vorhofflimmern weniger eindeutig ist und weiterhin kontrovers diskutiert wird.8
MRA
Die MRA Spironolacton und Eplerenon erweitern das Spektrum der leitliniengerechten Herzinsuffizienztherapie. In der 1999 publizierten RALES-Studie wurde unter Spironolacton eine Mortalitätsreduktion von 35% bei Patienten mit HFrEF gezeigt, wobei der Großteil bereits einen ACE-Hemmer erhielt, Betablocker dagegen nur etwa 10%.9 Einige Jahre später konnte auch für Eplerenon im Vergleich zu Placebo eine signifikante Risikoreduktion nachgewiesen werden. Insbesondere bei Patienten mit Gynäkomastie — einer typischen Nebenwirkung von Spironolacton — stellt Eplerenon eine wertvolle therapeutische Alternative dar.10
SGLT2-Inhibitoren
Die ursprünglich als Antidiabetika eingeführten SGLT2-Inhibitoren (SGLT2i) komplettierten die 4-Säulen-Therapie der HFrEF. In DAPA-HF und EMPEROR-Reduced senkten die SGLT2i Dapagliflozin und Empagliflozin die kombinierte Rate aus Tod und Hospitalisierung unabhängig vom Diabetesstatus.11,12 Über die Wirkung bei HFrEF hinaus wirken die beiden SGLT2i auch im klinischen Kontext einer Herzinsuffizienz mit erhaltener Pumpfunktion.13
Erweiterte pharmakologische Optionen – was gibt es Neues?
Vericiguat
Das Prinzip der löslichen Guanylatzyklase(sGC)-Stimulation zielt auf die Wiederherstellung des gestörten Stickstoffmonoxid(NO)-sGC-cGMP-Signalwegs ab. Das Nukleotid cGMP fungiert als „second messenger“ in vielen Stoffwechsel- und Hormonsignalwegen. In der VICTORIA-Studie wurden 5050 Patienten mit HFrEF und rezenter kardialer Dekompensation (<3Monaten) in eine sGC-Stimulator-Vericiguat- oder Placebo-Gruppe randomisiert. Der kombinierte primäre Endpunkt (kardiovaskulärer Tod oder Hospitalisierung wegen Herzinsuffizienz) konnte über ein medianes Follow-up von etwa 11 Monaten unter Vericiguat-Therapie signifikant reduziert werden (35,5% vs. 38,5%; HR: 0,90; 95%CI: 0,82–0,98). Die Rate unerwünschter Ereignisse war zwischen den beiden Studiengruppen vergleichbar, mit einer numerisch höheren Rate symptomatischer Hypotonien unter Vericiguat ohne statistisch signifikanten Unterschied (9,1% vs. 7,9%; p=0,12).14
Die Ergebnisse der VICTORIA-Studie wurden durch die rezent publizierte VICTOR-Studie ergänzt, in der die Effektivität von Vericiguat bei 6105 Patienten mit stabiler HFrEF ohne rezente kardiale Dekompensation untersucht wurde. Dabei zeigte sich kein statistisch signifikanter Unterschied zwischen den beiden Gruppen hinsichtlich des primären Endpunkts (kardiovaskulärer Tod oder Hospitalisierung wegen Herzinsuffizienz; 18,0% vs. 19,1%; HR: 0,93; 95%CI: 0,83–1,04; p=0,22). Der sekundäre Endpunkt kardiovaskulärer Tod war unter Vericiguat numerisch reduziert (9,6% vs. 11,3%), wobei bei neutralem primärem Endpunkt sekundäre Endpunkte lediglich als nominal und hypothesengenerierend zu interpretieren sind.15
Die aktuellen ESC-Leitlinien zur Herzinsuffizienz empfehlen eine zusätzliche Therapie mit Vericiguat bei Patienten mit symptomatischer HFrEF trotz etablierter oder nicht verträglicher Quadrupeltherapie (Klasse-IIb-Empfehlung). Die Ergebnisse der VICTOR-Studie lagen zum Zeitpunkt der Leitlinienpublikation noch nicht vor.1
Digitalis & Digitoxin
Digitalispräparate waren bis in die 1990er-Jahre eine wichtige Therapiesäule in der Behandlung von Patienten mit HFrEF. Die 1997 publizierte DIG-Studie mit 6800 Patienten mit Herzinsuffizienz und reduzierter LVEF (<45%) zeigte jedoch ein neutrales Ergebnis hinsichtlich des primären Endpunkts Gesamtmortalität (34,8% vs. 35,1%; RR: 0,99; 95%CI: 0,91–1,07; p=0,80). Zu bemerken ist jedoch, dass die Rate an Hospitalisierungen wegen Herzinsuffizienz unter Digoxin signifikant reduziert werden konnte (26,8% vs. 34,7%).16 Eine im Verlauf publizierte Post-hoc-Analyse zeigte darüber hinaus, dass Patienten mit therapeutischen Digoxin-Spiegeln einen klinischen Benefit aufwiesen, während erhöhte Serumkonzentrationen mit einem signifikant erhöhten Risiko assoziiert waren (0,5–0,8ng/ml: 29,9%; 0,9–1,1ng/ml: 38,8%; ≥1,2ng/ml: 48,0%; p=0,006). Die primär renale Elimination von Digoxin ist in der breiten Anwendung mit einem erhöhten Risiko für Akkumulation und Toxizität verbunden, während Digitoxin aufgrund seiner hepatischen Metabolisierung besser steuerbar und insgesamt sicherer ist.17
Die im vergangenen Jahr publizierte DIGIT-HF-Studie untersuchte die Wirksamkeit von Digitoxin bei 1212 Patienten mit HFrEF. Über ein medianes Follow-up von 36 Monaten zeigte sich unter Digitoxin-Therapie eine signifikante Reduktion des kombinierten Endpunkts aus Gesamtmortalität oder Hospitalisierung wegen Herzinsuffizienz (39,5% vs. 44,1%; HR: 0,82; 95%CI: 0,69–0,98; p=0,003). In Subgruppenanalysen fanden sich Hinweise auf eine stärkere Effektivität bei Patienten mit höherer Herzfrequenz (≥75/min) sowie niedrigerem systolischem Blutdruck (≤120mmHg), unabhängig vom Vorliegen von Vorhofflimmern. Vor dem Hintergrund der weiterhin kontrovers diskutierten Evidenz zur Wirksamkeit von Betablockern bei Patienten mit Vorhofflimmern und HFrEF könnte eine Digitoxin-Therapie für dieses Patientenkollektiv eine potenziell attraktive Behandlungsoption darstellen. Als Limitationen der Studie sind die vergleichsweise geringe Fallzahl sowie der geringe Anteil an Patienten unter SGLT2-Inhibitoren (≈20%) zu nennen. Darüber hinaus ist das Zusammenspiel von Digitoxin und Ivabradin aufgrund der geringen Koinzidenz dieser Therapien bislang unzureichend untersucht.18
Die aktuellen ESC-Leitlinien zur Herzinsuffizienz empfehlen eine additive Therapie mit Digoxin bei Patienten mit symptomatischer HFrEF trotz etablierter oder nicht tolerierter Quadrupeltherapie. Die Einordnung von Digitoxin im therapeutischen Algorithmus der HFrEF bleibt abzuwarten, da die Ergebnisse der DIGIT-HF-Studie zum Zeitpunkt der Leitlinienpublikation noch nicht verfügbar waren.1
Praktische Hinweise für die Aufdosierung der leitlinien-gerechten Herzinsuffizienztherapie
Rasche Sequenzierung statt langsamer Aufdosierung
Das fokussierte Update der ESC-Leitlinien für Herzinsuffizienz aus dem Jahr 2023 unterstreicht den Stellenwert einer frühen und raschen Initiierung der leitliniengerechten Herzinsuffizienztherapie.19 In der STRONG-HF-Studie konnte gezeigt werden, dass eine frühe, konsequente und rasche Einleitung sowie Aufdosierung der leitliniengerechten Herzinsuffizienztherapie – bereits vor Entlassung und mit engmaschiger Nachkontrolle in den ersten 6 Wochen – das Risiko für Rehospitalisierung und Mortalität signifikant reduzieren konnte (15,2% vs. 23,3%; p=0,002).20 Trotz der überzeugenden Evidenz und der klaren Empfehlungen der aktuellen Leitlinien bleibt die Unterversorgung mit leitliniengerechter Herzinsuffizienzmedikation in der klinischen Praxis jedoch weiterhin ein relevantes Problem.21 Daher sollte jeder ärztliche oder pflegerische Kontakt mit einem Patienten mit HFrEF als Gelegenheit zur strukturierten Überprüfung und gegebenenfalls Optimierung der laufenden Therapie genutzt werden.
Herausforderungen bei der Aufdosierung der Herzinsuffizienztherapie
Die häufigsten Schwierigkeiten bei der Aufdosierung einer leitliniengerechten Herzinsuffizienztherapie ergeben sich aus niedrigem Blutdruck, niedriger Herzfrequenz, Hyperkaliämie und eingeschränkter Nierenfunktion.1 Eine Blutdrucksenkung unter etablierter neurohumoraler Therapie ist ein erwarteter Klasseneffekt dieser Substanzen. Eine adäquate Aufklärung der Patienten über normale Blutdruckwerte sowie das Erkennen einer symptomatischen Hypotonie können unnötige Dosisreduktionen oder ein vorzeitiges Absetzen wirksamer Therapien vermeiden. Der frequenzmodulierende Effekt von Betablockern ist ebenfalls zu erwarten und sollte in der Regel nur bei Bradykardie-assoziierten Beschwerden oder prognoserelevanter Bradykardie zu einer Dosisreduktion führen. Die Einführung der Kaliumbinder (Patiromer oder Natrium-Zirkonium-Cyclosilikat) hat das Management der Hyperkaliämie in den letzten Jahren deutlich erleichtert. Eine Verschlechterung der Nierenfunktion ist insbesondere in der Titrationsphase der Herzinsuffizienztherapie häufig zu beobachten – in vielen Fällen kommt es jedoch langfristig zu einer Stabilisierung oder sogar Verbesserung der Nierenfunktion und Proteinurie. Dennoch gibt es in der klinischen Praxis Situationen, die ein vorübergehendes oder langfristiges Absetzen einzelner neurohumoraler Therapeutika erforderlich machen können – dies sollte jedoch stets substanzspezifisch erfolgen und nicht zu einem kompletten Abbruch der gesamten krankheitsmodifizierenden Therapie führen.22
Blick in die Zukunft: individuelle Therapieentscheidungen
Die stetige Erweiterung therapeutischer Optionen in der Behandlung von Patienten mit HFrEF ermöglicht zunehmend individualisiertere medikamentöse Entscheidungen, abgestimmt auf den jeweiligen Patienten. In welchem Ausmaß die kürzlich publizierten VICTOR- und DIGIT-HF-Studien die klinische Praxis sowie die in diesem Jahr erscheinenden ESC-Herzinsuffizienz-Leitlinien prägen werden, bleibt abzuwarten.
Literatur:
1 McDonagh TA et al.: 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J 2021; 42: 3599-726 2 Ge Z et al.: Pathogenesis and pathophysiology of heart failure with reduced ejection fraction: translation to human studies. Heart Fail Rev 2019; 24: 743-58 3 SOLVD Investigators et al.: Effect of enalapril on survival in patients with reduced left ventricular ejection fractions and congestive heart failure. N Engl J Med 1991; 325: 293-302 4 McMurray JJV et al.: Angiotensin-neprilysin inhibition versus enalapril in heart failure. N Engl J Med 2014; 371: 993-1004 5 Hjalmarson A et al.: Effects of controlled-release metoprolol on total mortality, hospitalizations, and well-being in patients with heart failure: the Metoprolol CR/XL randomized intervention trial in congestive heart failure (MERIT-HF). MERIT-HF Study Group. JAMA 2000; 283: 1295-302 6 CIBIS-II Investigators and Committees: The cardiac insufficiency bisoprolol study II (CIBIS-II): a randomised trial. Lancet 1999; 353: 9-13 7 Dargie HJ: Effect of carvedilol on outcome after myocardial infarction in patients with left-ventricular dysfunction: the CAPRICORN randomised trial. Lancet 2001; 357: 1385-90 8 Kotecha D et al.: Efficacy of β blockers in patients with heart failure plus atrial fibrillation: an individual-patient data meta-analysis. Lancet 2014; 384: 2235-43 9 Pitt B et al.: The effect of spironolactone on morbidity and mortality in patients with severe heart failure. Randomized aldactone evaluation study investigators. N Engl J Med 1999; 341: 709-17 10 Zannad F et al.: Eplerenone in patients with systolic heart failure and mild symptoms. N Engl J Med 2011; 364: 11-21 11 McMurray JJV et al.: Dapagliflozin in patients with heart failure and reduced ejection fraction. N Engl J Med 2019; 381: 1995-2008 12 Packer M et al.: Cardiovascular and renal outcomes with Empagliflozin in heart failure. N Engl J Med 2020; 383: 1413-24 13 Jaiswal A et al.: SGLT2 inhibitors among patients with heart failure with preserved ejection fraction: a meta-analysis of randomised controlled trials. Medicine (Baltimore) 2023; 102: e34693 14 Armstrong PW et al.: Vericiguat in patients with heart failure and reduced ejection fraction. N Engl J Med 2020; 382: 1883-93 15 Butler J et al.: Vericiguat in patients with chronic heart failure and reduced ejection fraction (VICTOR): a double-blind, placebo-controlled, randomised, phase 3 trial. Lancet 2025; 406: 1341-50 16 Digitalis Investigation Group: The effect of digoxin on mortality and morbidity in patients with heart failure. N Engl J Med 1997; 336: 525-33 17 Rathore SS et al.: Association of serum digoxin concentration and outcomes in patients with heart failure. JAMA 2003; 289: 871-78 18 Bavendiek U et al.: Digitoxin in patients with heart failure and reduced ejection fraction. N Engl J Med 2025; 393: 1155-65 19 McDonagh TA et al.: 2023 focused update of the 2021 ESC guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J 2023; 44: 3627-39 20 Mebazaa A et al.: Safety, tolerability and efficacy of up-titration of guideline-directed medical therapies for acute heart failure (STRONG-HF): a multinational, open-label, randomised, trial. Lancet 2022; 400: 1938-52 21 Schjødt I et al.: Real-world use of guideline-directed therapy for heart failure: Insights from the danish heart failure registry. ESC Heart Fail 2025; 12: 3003-17 22 Zhang Z et al.: Advancing guideline-directed medical therapy in heart failure: overcoming challenges and maximizing benefits. Am J Cardiovasc Drugs 2024; 24: 329-42
Das könnte Sie auch interessieren:
Pulsed Field Ablation – Beginn einer neuen Ära?
Mit der Pulsed Field Ablation (PFA) hält ein neuartiges, nichtthermisches, gewebsselektives Ablationsverfahren Einzug in die interventionelle Therapie des Vorhofflimmerns. Aktuelle ...
ESC-Guideline zur Behandlung von Herzvitien bei Erwachsenen
Kinder, die mit kongenitalen Herzvitien geboren werden, erreichen mittlerweile zu mehr 90% das Erwachsenenalter. Mit dem Update ihrer Leitlinie zum Management kongenitaler Vitien bei ...
ESC gibt umfassende Empfehlung für den Sport
Seit wenigen Tagen ist die erste Leitlinie der ESC zu den Themen Sportkardiologie und Training für Patienten mit kardiovaskulären Erkrankungen verfügbar. Sie empfiehlt Training für ...