Es lohnt sich zu wissen, was das Immunsystem beschäftigt
Bericht: Ines Schulz-Hanke
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die atopische Dermatitis lässt sich mit topischen Steroiden und Calcineurin-Inhibitoren sicher und häufig gut behandeln. Ausserdem hat sich das Spektrum der Systemtherapeutika deutlich erweitert. Ist es also noch nötig, gleichzeitig bestehende Allergien und Autoimmunphänomene abzuklären und zu behandeln? Und kann umgekehrt die AD-Therapie diese Komorbiditäten bessern? In vielen Aspekten lautet die Antwort: Ja.
Keypoints
-
Trotz verbesserter symptomatischer Therapie sollten Allergien bei Menschen mit AD abgeklärt und behandelt werden, um den Therapieerfolg für AD und Allergien zu optimieren.
-
Besteht eine respiratorische Indikation für eine AIT (allergenspezifische Immunreaktion), sollte auch bei Neurodermitis hyposensibilisiert werden, da dies auch der Haut guttun könnte.
-
Auch Autoimmunität und autoreaktive IgE sind mit der AD assoziiert, möglicherweise auch mit dem Ansprechen auf Dupilumab. Hier besteht weiterhin Forschungsbedarf.
Bis vor einigen Jahren seien Ciclosporin als Intervalltherapie (ab 16 Jahren), einige Immunsuppressiva, die «off-label» eingesetzt wurden (Methotrexat, Azathioprin, Mycophenolat Mofetil), sowie systemische Glukokortikoide für maximal 3 Wochen die einzigen Systemtherapien bei atopischer Dermatitis (AD) gewesen, berichtete Prof. Dr. med. Thomas Werfel, Hannover. Inzwischen habe sich gerade für Kinder das Spektrum der zur Langzeittherapie zugelassenen Wirkstoffe deutlich erweitert:
-
Dupilumab (ab 6 Monaten),
-
Tralokinumab, Lebrikizumab und Nemolizumab (alle ab 12 Jahren) sowie
-
die JAK-Inhibitoren Abrocitinib, Upadacitinib (beide ab 12 Jahren) und Baricitinib (ab 2 Jahren).1
Allergische Erkrankungen und AD-Therapie
Für das Ansprechen auf diese Systemtherapien spielen allergische Komorbiditäten offenbar keine wesentliche Rolle, wie Werfel für Abrocitinib und Dupilumab zeigte. Sie wirkten bei Vorliegen und Fehlen allergischer Erkrankungen gleichermassen.2,3
Doch bessert Dupilumab bei AD nicht nur das Ekzem, sondern auch allergische Symptome um gut ein Drittel und senkt die Titer der allergenspezifischen IgE-Antikörper signifikant. Dies zeigte eine Metaanalyse über 12 Studien beispielsweise für Nahrungsmittelallergien und Asthmaanfälle.4 Ob dieser Effekt möglicherweise den atopischen Marsch, also das sequenzielle Auftreten IgE-assoziierter atopischer Krankheitsbilder, bremse, lasse sich erst in 10 Jahren beurteilen, da Dupilumab noch nicht lange für Säuglinge zugelassen ist. Doch liefere die Metaanalyse «erste spannende Hinweise», schloss Werfel.
Erhöhtes Sensibilisierungsrisiko über die entzündete Haut
Es gebe Hinweise darauf, dass eine AD das Sensibilisierungsrisiko erhöht. Eine Studie bei voll gestillten Säuglingen habe eine deutliche Assoziation zwischen AD und Nahrungsmittelallergien gezeigt (Odds-Ratio [OR] 6,18), berichtete Werfel. Manche der Kinder hätten bereits spezifische IgE-Antikörper aufgewiesen, obwohl sie die entsprechenden Nahrungsmittel noch nie verzehrt hatten. Ausserdem bestehe eine deutliche Assoziation zwischen der Schwere der AD und derartigen Sensibilisierungen.5
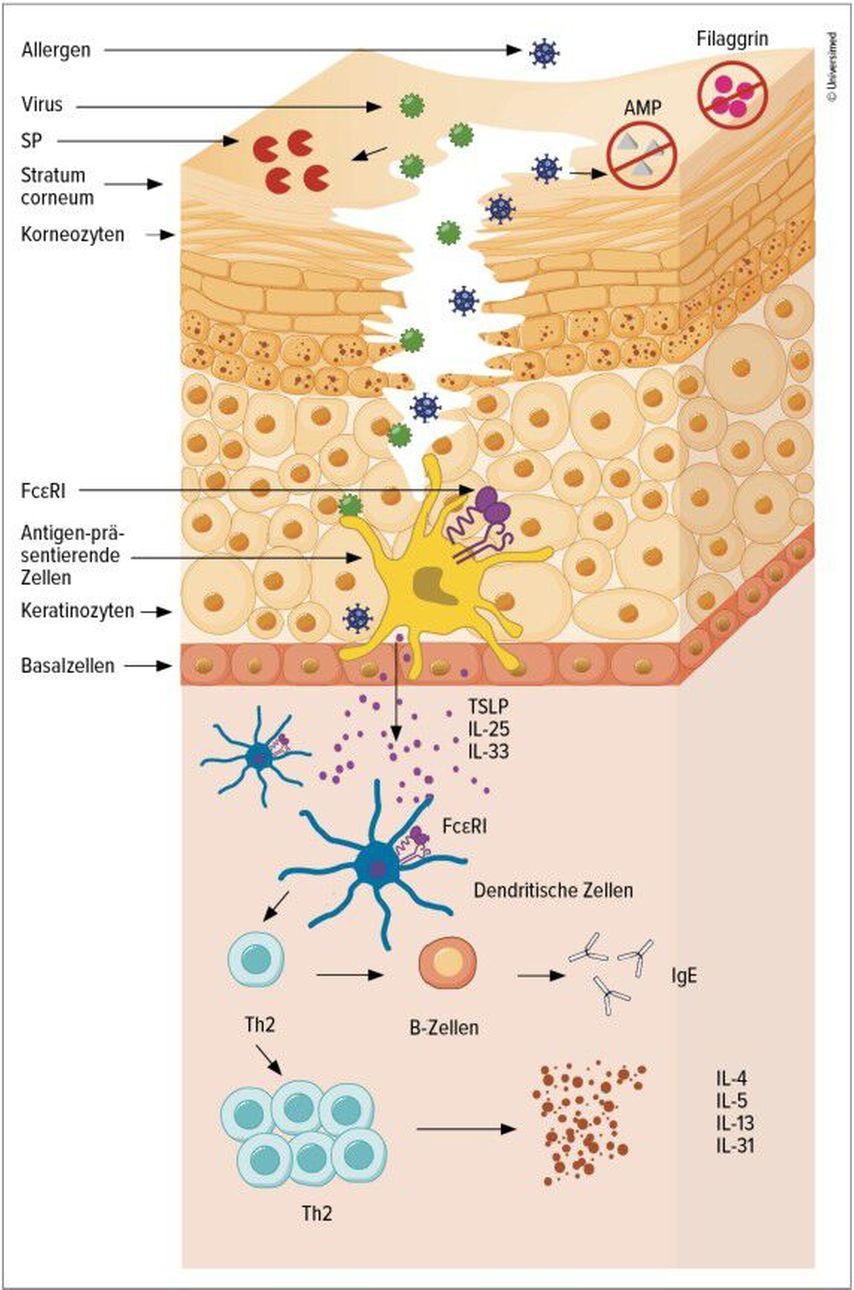
Dass sie über volatile Allergene verlaufen könnten, sei nachgewiesen,6,7 beispielsweise wenn in der Familie bestimmte Speisen wie Erdnüsse verzehrt würden. Noch hypothetisch seien die Folgen eines «Möhren-Massakers» beim Füttern: Gelange Möhrenbrei umfangreich auf ekzematöse Säuglingshaut, könnten Nahrungsmittelallergene aufgrund der gestörten Hautbarriere leichter penetrieren, in Kontakt mit Antigen-präsentierenden Zellen gelangen und so möglicherweise eine Sensibilisierung anstossen (Abb. 1).8
Abb. 1: Eindringen von Allergenen über eine gestörte Hautbarriere bei AD mit anschliessender Sensibilisierung (modifiziert nach Sampson HA 2024)8
Neurodermitistherapie oder frühe Konfrontation mit Allergenen?
Die experimentelle Behandlung der gesamten Haut mit Alclometason und Betamethason (2x/d für 14 Tage, dann 2x pro Woche bis zur 28. Woche) hat in einer Proof-of-Concept-Studie die Häufigkeit der Hühnereiallergie vom Soforttyp signifikant stärker reduziert als eine konventionelle Therapie (31,4% vs. 41,9%). Dieses Vorgehen war von einem signifikant verlangsamten Körperwachstum begleitet. Doch könne es sich lohnen, die Neurodermitis – leitliniengerecht – gut zu behandeln, um das Risiko einer Nahrungsmittelallergie zu reduzieren, führte Werfel aus.9
Dass sich das Risiko IgE-vermittelter Nahrungsmittelallergien auch durch Zufüttern allergener Nahrungsmittel reduzieren lässt, sei vielfach belegt. Erste Daten weisen daraufhin, dass die Einführung dieser Beikost im ersten Lebensjahr auch das AD-Risiko senken kann.10 Dazu sollten gemäss der aktuellen S3-Leitlinie Allergieprävention Säuglinge für 4 bis 6 Monate möglichst voll gestillt werden und ab dem 5., spätestens ab Beginn des 7. Lebensmonats auch allergene Lebensmittel wie Fisch, Milch und Hühnerei erhalten.11
Klinische Relevanz IgE-vermittelter Allergien für Ekzeme bei AD
Anamnestische Hinweise auf eine saisonale Verschlechterung der AD, beispielsweise bei Gräserpollenallergie im Sommer, deuteten darauf hin, dass IgE-vermittelte Allergien für Ekzeme der AD klinisch relevant sind. Auch Ekzemreaktionen durch epikutan getestete Inhalations- und Nahrungsmittelallergene im Atopie-Patch-Test wiesen in diese Richtung.12 Zudem träten bei einigen Kindern mit AD nach oraler Aufnahme allergener Nahrungsmittel am Folgetag Flare-up-Reaktionen auf. Dies sei bereits in die Leitlinien zur oralen Provokation eingeflossen.13
Birkenpollen-assoziierte Nahrungsmittel wie Haselnuss, Karotte, Apfel und Sellerie könnten bei Birkenpollen-Sensibilisierten den Ekzem-Score signifikant verschlechtern, also eine Spätreaktion auslösen. Bei 40% der oral provozierbaren Probanden sei dies der Fall gewesen, berichtete Werfel.14
Ausserdem habe man in einer Allergenprovokationskammer Gräserpollen-sensibilisierte Menschen mit Neurodermitis ausserhalb der Saison aerogenen Allergenen ausgesetzt. Dies habe bereits am Abend der Provokation Flare-up-Reaktionen mit Juckreiz ausgelöst. Besonders in nicht bedeckten Hautbereichen seien durch Kratzen schliesslich Ekzemläsionen entstanden.15 Wurde die Haut mit einer Basistherapie behandelt, liess sich weniger Interleukin 13 (IL-13) nachweisen sowie immunhistologisch weniger TH2-Zellen und eine stabilere Artenvielfalt des Mikrobioms.16
Dem Modell zufolge treffen Aeroallergene auf IgE- und Antigen-präsentierende Zellen in der Haut. Es kommt zu einer erleichterten Allergenpräsentation und zur Stimulation der T-Zellen. Mittels T-Zell-Rezeptor-Sequenzierungen liessen sich bei AD bis zu 28% aeroallergenspezifische T-Zellen in der Haut nachweisen, was darauf hindeutet, dass über die Haut erkannte (Aero-)Antigene eine wichtige Rolle bei der AD spielen.17 Die krankheitsspezifischen T-Zell-Cluster waren überwiegend der TH2-Subpopulation zuzuordnen.18
Allergien bei atopischer Dermatitis individuell abklären
Die Leitlinie atopische Dermatitis liefert Empfehlungen zur Abklärung von Allergien.
-
Ihr zufolge soll bei Betroffenen eine individuelle Allergiediagnostik durchgeführt werden und kein ungezieltes Allergie-Screening.
-
Die klinische Relevanz nachgewiesener Sensibilisierungen gegen Nahrungsmittel soll durch Karenz- und Provokationstests überprüft werden.
-
Epikutantestungen mit Proteinallergenen (Atopie-Patch-Test) sollen nicht routinemässig durchgeführt werden, Epikutantestungen mit niedermolekularen Substanzen bei anamnestischem oder klinischem Verdacht hingegen schon, weil sich so zusätzlich bestehende Kontaktallergien aufdecken liessen.1
Sei eine klinisch relevante Sensibilisierung gegen Inhalationsallergene bei AD gefunden worden, dann solle eine Karenz oder Allergenreduktion angestrebt werden. Auch könne man «über eine allergenspezifische Immuntherapie reden», so Werfel.
Allergenspezifische Immuntherapie
Zusammengenommen bestätigten Studien der letzten 30 Jahre den Erfolg der allergenspezifischen Immuntherapie (AIT), und zwar für die subkutane Immuntherapie (SKIT) und die sublinguale (SLIT).19 Daher gelte: «Wenn eine respiratorische Indikation zur allergenspezifischen Immuntherapie besteht, dann bitte auch bei Neurodermitis hyposensibilisieren – es könnte auch der Haut guttun», forderte Werfel.
Zur Kombination einer AIT mit Dupilumab gebe es bisher erste, noch zu kleine Studien. In ihnen unterschied sich die Verbesserung des Haut-Scores (EASI) kaum unter AIT, Dupilumab oder der Kombination aus beiden. Grosse Effekte seien nicht zu erwarten.20,21
Zielgerichtete Therapieeinsätze
Die IgE-spezifische Immunadsorption habe durchaus Therapieeffekte, jedoch sei das Verfahren sehr aufwendig und speziellen Patient:innen vorbehalten, berichtete Werfel.22 Überraschend hätten sich die Anti-IgE-Antikörper Omalizumab und Ligelizumab in kontrollierten Studien nicht als wirksam erwiesen, weshalb keine Leitlinienempfehlung hierfür vorliege.23,24
Autoimmunität und autoreaktive IgE-Antikörper
Die AD sei mit Autoimmunerkrankungen assoziiert, wie sich anhand von Daten aus dem dänischen nationalen Kohortenregister habe zeigen lassen. Eine enge Assoziation bestehe demnach zur Alopecia areata (OR: 29,9) und zur Vitiligo (OR: 20,1). Auch Kollagenosen seien – schwächer – mit der AD assoziiert, was im klinischen Alltag nicht auffalle, aber Forschungsanlass sein könne.25
Darüber hinaus sei das Vorliegen autoreaktiver IgE-Antikörper bei AD gut gesichert. Dies sei neurodermitisspezifisch und wurde nicht bei Gesunden oder Menschen mit allergischer Rhinokonjunktivitis oder Psoriasis gefunden.26 Sie entstünden durch Kreuzreaktionen auf mikrobielle oder andere exogene Antigene wie Malassezia sympodialis, die die Head-and-Neck-Dermatitis bei Neurodermitis mit verschlechtern könne.
Im Pricktest habe ein humanes kreuzreaktives Antigen zum Malassezia-Protein (Mala S11) eine positive Reaktion ausgelöst sowie eine Ekzemreaktion im Patch-Test. Im Biopsat von Patchs, die durch Mala S13 induziert worden waren, fanden sich T-Zellen, die zum grossen Teil kreuzreaktiv zu humanen Proteinen waren. Autoimmunität durch Kreuzreaktionen könne also eine Rolle spielen, folgerte Werfel.27,28
«IgE Molecular Mimicry Index» als Biomarker für klinische Phänotypen
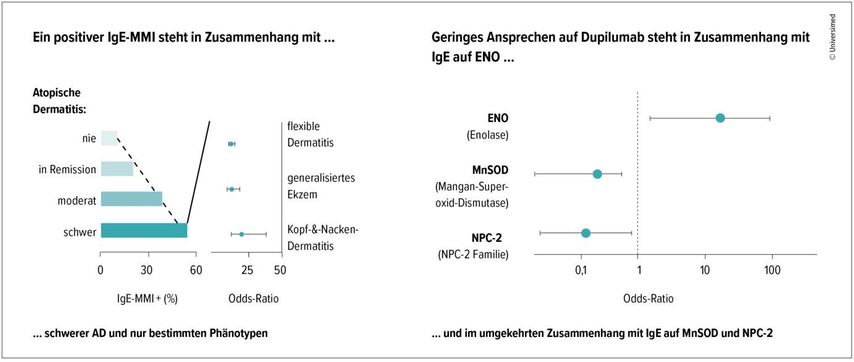
Der IgE Molecular Mimicry Index verknüpft das Vorliegen human-homologer exogener molekularer Allergene mit der Schwere einer AD und könnte sich möglicherweise als Prädiktor für ein Ansprechen auf Dupilumab eignen. In einer Studie wurde das Serum von 3325 allergischen Patient:innen, davon 577 mit AD, mittels Microarray auf das Vorliegen von 183 IgE-Antikörpern gegen human-homologe exogene molekulare Allergene getestet. Das individuelle Muster dieser Allergene, die aufgrund ihrer Aminosäuresequenz und 3D-Konformation eine Kreuzreaktion auf humane Proteine auslösen können, wurde zusammen mit der Schwere der AD und ihren Phänotypen genutzt, um einen Molecular Mimicry Index (MMI) für jede Person zu berechnen. Ein positiver Index wurde bei Teilnehmenden ohne AD selten festgestellt (10,7%). Mit der Schwere der AD stieg der Anteil positiver MMI-Befunde auf 54%.
Eine Sensibilisierung gegen Enolase erwies sich als Prädiktor für ein schlechtes Ansprechen auf Dupilumab. Eine Sensibilisierung auf Mangan-Superoxid-Dismutase oder Proteine der NPC-2-Familie war eher mit einem guten Ansprechen auf Dupilumab assoziiert. Wegen der noch kleinen Fallzahlen blieben diese «spannenden Ergebnisse» noch zu bestätigen (Abb. 2).29
Quelle:
«Atopische Dermatitis 2025: Spielen Allergien und Autoimmunphänomene noch eine Rolle?», Vortrag von Prof. Dr. med. Thomas Werfel, Hannover, im Rahmen der Session «Chronisch entzündliche Dermatosen – quo vadis?» anlässlich der DDG-Tagung am 1. Mai 2025 in Berlin
Literatur:
1 Werfel T et al.: S3 Guideline atopic dermatitis: Part 1 - general aspects, topical and non-drug therapies, special patient groups. J Dtsch Dermatol Ges 2024; 22(1): 137-55 2 Schmid-Grendelmaier P et al.: Efficacy and safety of abrocitinib in patients with moderate-to-severe atopic dermatitis and comorbid allergies. Allergy 2024; 79(1): 174-83 3 Dekkers C et al.: Type 2 immune-dominant endotype is not associated with increased responsiveness to dupilumab treatment in adult atopic dermatitis patients. Clin Exp Allergy 2025; 55(1): 97-9 4 Geba GP et al.: Attenuating the atopic march: meta-analysis of the dupilumab atopic dermatitis database for incident allergic events. J Allergy Clin Immunol 2023; 151(3): 756-66 5 Flohr C et al.: Atopic dermatitis and disease severity are the main risk factors for food sensitization in exclusively breastfed infants. J Invest Dermatol 2014; 134(2): 345-50 6 Trendelenburg V et al.: Peanut allergen in house dust of eating area and bed--a risk factor for peanut sensitization? Allergy 2013; 68: 1460-2 7 Brough HA et al.: Atopic dermatitis increases the effect of exposure to peanut antigen in dust on peanut sensitization and likely peanut allergy. J Allergy Clin Immunol 2015; 135(1): 164-70 8 Sampson HA: The riddle of response to cutaneous allergen exposure in patients with atopic dermatitis. Ann Allergy Asthma Immunol 2024; 133(3): 244-51 9 Yamamoto-Hanada K et al.: Enhanced early skin treatment for atopic dermatitis in infants reduces food allergy. J Allergy Clin Immunol 2023; 152(1): 126-35 10 Tuballa A et al.: Introduction of allergenic food to infants and allergic and autoimmune conditions: a systematic review and meta-analysis. BMJ Evid Based Med 2024; 29(2): 104-13 11 Kopp MV et al.: S3 guideline allergy prevention. Allergol Select 2022; 6(1): 61-97 12 Darsow U, Ring J: Immunoglobulin e-mediated allergy plays a role in atopic eczema as shown in the atopy patch test. World Allergy Organ J 2008; 1(3): 51-6 13 Worm M et al.: Update of the S2k guideline on the management of IgE-mediated food allergies. Allergol Select 2021; 5: 195-243 14 Wassmann-Otto A et al.: Birch pollen-related foods can cause late eczematous reactions in patients with atopic dermatitis. Allergy 2018; 73(10): 2046-54 15 Werfel T et al.: Exacerbation of atopic dermatitis on grass pollen exposure in an environmental challenge chamber. J Allergy Clin Immunol 2015; 136(1): 96-103 16 Heratizadeh A et al.: Basic skin therapy effects on skin inflammation and microbiome composition in patients with atopic dermatitis after challenges with grass pollen. J Eur Acad Dermatol Venereol 2022; 36(6): e480-e483 17 Roesner LM et al.: T-cell receptor sequencing specifies psoriasis as a systemic and atopic dermatitis as a skin-focused, allergen-driven disease. Allergy 2022; 77(9): 2737-47 18 Zhang B et al.: Single-cell profiles reveal distinctive immune response in atopic dermatitis in contrast to psoriasis. Allergy 2023; 78(2): 439-53 19 Yepes-Nunez JJ et al.: Allergen immunotherapy for atopic dermatitis: systematic review and meta-analysis of benefits and harms. J Allergy Clin Immunol 2023; 151(1): 147-58 20 Kim J et al.: Combined dupilumab and allergen-specific immunotherapy in severe refractory atopic dermatitis. Allergy Asthma Immunol Res 2024; 16(6): 682-9 21 Liu J et al.: Allergen immunotherapy and dupilumab in atopic dermatitis: clinical efficacy and disparities in immunological indicators. World Allergy Organ J 2025; 18(3): 101043 22 Kasperkiewicz M et al.: IgE-specific immunoadsorption for treatment of recalcitrant atopic dermatitis. JAMA Dermatol 2014; 150(12): 1350-1 23Heil PM et al.: Omalizumab therapy in atopic dermatitis: depletion of IgE does not improve the clinical course - a randomized, placebo-controlled and double blind pilot study. J Dtsch Dermatol Ges 2010; 8(12): 990-8 24 Bangert C et al.: IgE depletion with ligelizumab does not significantly improve clinical symptoms in patients with moderate-to-severe atopic dermatitis. J Invest Dermatol 2023; 143(10): 1896-905 25 Anderson YMF et al.: Autoimmune diseases in adults with atopic dermatitis. J Am Acad Dermatol 2017; 76(2): 274-80 26 Tang TS et al.: Does „autoreactivity“ play a role in atopic dermatitis? J Allergy Clin Immunol 2012; 129(5): 1209-15 27 Schmid-Grendelmeier P et al.: IgE-mediated and T cell-mediated autoimmunity against manganese superoxide dismutase in atopic dermatitis. J Allergy Clin Immunol 2005; 115(5): 1068-75 28 Roesner LM et al.: Autoimmunity (or not) in atopic dermatitis. Front Immunol 2019; 10: 2128 29 Scala E et al.: A microarray-based IgE-molecular mimicry index (IgE-MMI): a biomarker for disease severity, clinical phenotypes, and therapeutic response in atopic dermatitis? Allergy 2024; 79(12): 3415-29
Das könnte Sie auch interessieren:
Nächster Halt: Krankheitsmodifikation?
Galten vor einigen Jahren Therapieziele wie Psoriasis Area and Severity Index (PASI) 100 oder Dermatology Life Quality Index (DLQI) 0/1 noch als schwer erreichbar, sind sie bei der ...
Psoriasis – Update der Behandlungsziele
Ziel der Psoriasistherapie ist heute, dass die Haut nahezu erscheinungsfrei wird und der Patient eine normale Lebensqualität hat. Dank Biologika gelingt dies in vielen Fällen. Wann man ...
Biologika-Therapie: Pipeline und Klinik
Biologika bieten die Option, in die hinter der atopischen Dermatitis stehenden Immunprozesse gezielt einzugreifen. Dieser Weg wurde zuerst mit dem Anti-IL-4/IL-13-Antikörper Dupilumab ...