Sicca-Symptomatik: praktisches Vorgehen
Autoren:
Dr. med. Lisa Christ
PD Dr. med. Urs Steiner
Prof. Dr. med. Britta Maurer
Klinik für Rheumatologie und Immunologie,
Inselspital, Universitätsspital Bern
Korrespondierende Autorin:
Dr. med. Lisa Christ
E-Mail: lisa.christ@insel.ch
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Eine 30-jährige Frau mit Sicca-Beschwerden stellt sich in Ihrer Sprechstunde vor, mit der Frage nach dem Vorliegen einer Sjögren-Erkrankung. Auswärtig ist bereits eine Biopsie der Lippenspeicheldrüsen durchgeführt worden und der Befund wäre vereinbar mit einer Sjögren-Erkrankung. Ist die Diagnose nun gesichert? Wie gehen Sie vor? Der folgende Artikel gibt eine Übersicht über die Ursachen von Sicca-Symptomen und das diagnostische Vorgehen.
Keypoints
-
Ungefähr jeder 4. Mensch leidet an Sicca-Symptomen mit erheblicher Auswirkung auf die Lebensqualität.
-
Die Ursachen von Sicca-Symptomen sind vielfältig und beinhalten die Sjögren-Erkrankung.
-
Ein positiver Nachweis von anti-SSA-Autoantikörpern alleine ist für die Diagnosestellung einer Sjögren-Erkrankung nicht ausreichend.
Sicca-Symptome finden sich bei 20–30% der Bevölkerung.1,2 Nicht nur aufgrund der Häufigkeit, sondern auch wegen der Auswirkungen auf die Lebensqualität ist es wichtig, die Ursachen und diagnostischen Bausteine zur Abklärung von Sicca-Symptomen zu kennen. Eine Umfrage ergab, dass Betroffene mit moderat trockenem Auge 1,6 Jahre ihres Lebens opfern würden (wenn sie voraussichtlich noch 10 Jahre leben würden), um die Erkrankung loszuwerden. Der Wert lag bei 0,7 Jahren für eine invalidisierende Hüftfraktur.3 Dies unterstreicht die Relevanz der Sicca-Symptomatik für Betroffene.
Eine subjektive Sicca-Symptomatik wird von einer objektiven (Nachweis einer reduzierten Tränen-/Speichelproduktion) abgegrenzt. Interessanterweise findet sich eine schlechte Korrelation der subjektiven und objektiven Sicca-Symptomatik.4 Somit kann eine objektive Sicca-Symptomatik auch bei fehlender subjektiver Symptomatik vorliegen.
Es bietet sich an, standardisierte Fragen für die Anamneseerhebung anzuwenden.5 Diese sind in Tabelle 1 aufgeführt. Diese Fragen dienen dazu, eine gelegentliche auftretende Trockenheit von einer chronischen, die als Sicca-Syndrom bezeichnet wird, zu unterscheiden. Nur Letzteres ist abklärungsbedürftig.
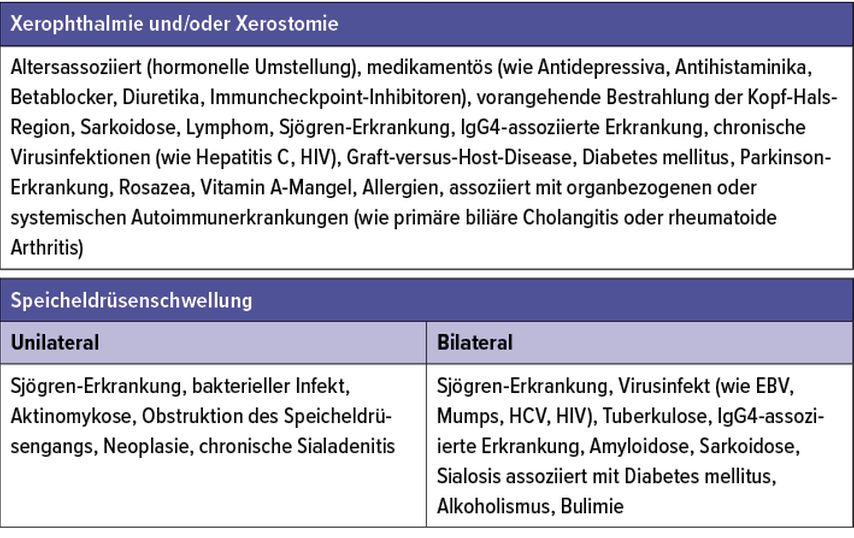
Häufige Ursachen einer Augentrockenheit sind Medikamente (wie Antidepressiva oder Diuretika), Umgebungsfaktoren (wie Klimaanlagen oder Luftverschmutzung) oder altersassoziierte Veränderungen (wie hormonelle Veränderungen oder das Vorliegen eines Ektropiums).
Systemerkrankungen, wie die Sjögren-Erkrankung oder andere Konnektivitiden, eine Sarkoidose oder Infektionen (wie Hepatitis C oder HIV) können ebenso mit einer Sicca-Symptomatik einhergehen.
Eine begleitende Schwellung der Speicheldrüsen kann weitere Hinweise auf die Ursache liefern. Bei der Sjögren-Erkrankung findet sich in 20–30% (Querschnittsstudien) eine in der Regel schmerzlose ein- oder beidseitige Schwellung der Speicheldrüsen. Infektiöse Ursachen (wie Mumps, EBV, HCV) oder andere Systemerkrankungen (wie Amyloidose oder Sarkoidose) können mit einer Speicheldrüsenschwellung einhergehen.6–9 Tabelle 2 listet mögliche Ursachen einer Augen-/Mundtrockenheit und Speicheldrüsenschwellung.
Zur Testung der Tränen- und Speichelproduktion stehen verschiedene Verfahren zur Auswahl. Beispielhaft werden in der Folge zwei Tests dargestellt. Im klinischen Alltag wird der Schirmer-Test häufig angewendet, um die Tränenproduktion zu messen. Hierbei wird ein Filterpapier in das laterale Drittel des Unterlids eingelegt und die Menge an Tränenproduktion abgelesen. Diese entspricht der Befeuchtung auf dem Filterpapier in mm über einen Zeitraum von 5 Minuten. Werte ab 5mm/5min gelten als Normalbefund. Der Saxon-Test kann zur Messung der Speichelmenge verwendet werden. Hierzu kaut der/die zu Untersuchende auf einer gefalteten Kompresse. Die Gewichtsdifferenz der Kompresse vor und nach 2 Minuten Kauen wird erfasst. Werte ab 2,75g/2min sind normwertig.8,10 Beide Tests sind einfach im klinischen Alltag durchzuführen und benötigen keine aufwendige Apparatur. Als weiterer Test wird unter anderem die nicht stimulierte Speichelflussrate angewendet, bei der der Patient über einen definierten Zeitraum Speichel in ein Teströhrchen spuckt. Zu beachten ist, dass vorheriges Rauchen, eine Flüssigkeitszufuhr oder die Applikation von Augentropfen die Diagnostik beeinflussen können. Daher sollte die Testung optimalerweise am Vormittag durchgeführt werden, ohne Nahrungszufuhr bzw. ohne Trinken über mindestens 90 Minuten vor der Testung.
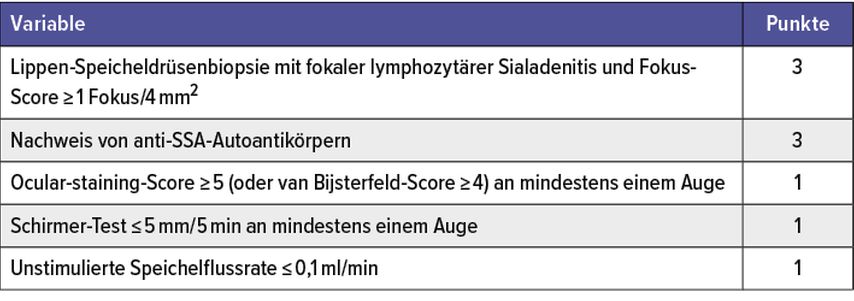
Neben der Erfassung der subjektiven und objektiven Sicca-Symptomatik sind wichtige Aspekte bei der Anamnese und im klinischen Status im Hinblick auf die breite Differenzialdiagnose zu berücksichtigen (Tab. 3).
Tab. 3: ACR/EULAR-Klassifikationskriterien für die primäre Sjögren-Erkrankung. Bei (i) Bejahung mindestens einer der Sicca-Fragen (Tabelle 1) oder mindestens einer positiven ESSDAI-Domäne,20 (ii) einer Punktzahl ≥4 und (iii) fehlenden Ausschlusskriterien sind die Kriterien erfüllt5
Ein weiterer diagnostischer Baustein ist die Labordiagnostik inklusive Bestimmung der charakteristischen antinukleären Antikörper (ANA). Hierbei sind eine ANA-, anti-SSA- (52/60kDa), -SSB-Autoantikörper- und Rheumafaktor-Testung neben einem Blutbild und Urinstatus sinnvoll. Zu berücksichtigen ist, dass sich bei ca. 20% der Normalbevölkerung ein erhöhter ANA-Titer nachweisen lässt und anti-SSA bei ca. 3% der Normalbevölkerung zu finden sind.10–14 Daher ist die Titerhöhe zu berücksichtigen, um die Relevanz des Befundes interpretieren zu können.
Die Sjögren-Erkrankung ist nach der rheumatoiden Arthritis die zweithäufigste Autoimmunerkrankung und tritt vorwiegend bei Frauen in der 5. oder 6. Lebensdekade auf. Es gibt jedoch auch juvenile Formen. Anti-SSA-Autoantikörper lassen sich bei ca. 60–80%, Rheumafaktoren bei ca. 30–60% nachweisen.8,10,13,14 Wenn der Rheumafaktor positiv ist, liegt häufig auch eine polyklonale Hypergammaglobulinämie für IgG vor.
Andere Autoimmunerkrankungen, wie rheumatoide Arthritis, systemischer Lupus erythematodes oder systemische Sklerose können mit der Sjögren-Erkrankung assoziiert auftreten. Ein Overlap-Syndrom besteht, wenn typische klinische Manifestationen und spezifische Autoantikörper für beide Entitäten oder eine positive Speicheldrüsenbiopsie vorliegen. Niedrigtitrige anti-SSA/B-Autoantikörper finden sich als «assoziierte» Antikörper häufig bei anderen Konnektivitiden. Bei anti-SSA-Autoantikörpern werden anti-Ro60 (60kDa) von anti-Ro52 (52kDa) unterschieden. Letztere findet man häufig bei Myositiden.
Zur Abgrenzung von Differenzialdiagnosen ist es sinnvoll, im Rahmen der Erstabklärung ergänzende Laborparameter zu bestimmen, wie eine Hepatitis- und HIV-Serologie, ein Differenzialblutbild oder eine Proteinelektrophorese mit Immunfixation und Bestimmung des Leichtkettenquotienten. Bei Männern mit Sicca-Syndrom und insbesondere bei Affektion der oberen Atemwege (Rhinosinusitis, Asthma bronchiale) sollte differenzialdiagnostisch an eine IgG4-vermittelte Erkrankung gedacht und eine Typisierung der IgG-Subklassen im Serum durchgeführt werden.
Gemäss Sherlock Holmes («A good detective never misses a clue») umfasst die Abklärung einer Sicca-Symptomatik neben der Sicca- und Labor-Diagnostik weitere Bausteine. Hierzu zählt die Bildgebung. Die Sonografie zur Darstellung der submandibulären Speicheldrüsen und der Glandula parotis ist hierbei hervorzuheben. Abhängig von der Parenchymdarstellung, die von normal bis zu einer diffusen Inhomogenität mit Nachweis von an-/hypoechogenen Zonen reichen kann, wird ein Score vergeben. Ein Score <2 ist in der Regel weniger suggestiv für eine Sjögren-Erkrankung. Es ist zu beachten, dass andere Erkrankungen, wie die Sarkoidose oder Amyloidose, sonografische Befunde ähnlich denen der Sjögren-Erkrankung hervorrufen können.10,15,16 Die Sialografie oder Szintigrafie werden in der Routinediagnostik in der Regel nicht mehr eingesetzt. Bei Vorliegen einer Sjögren-Erkrankung empfiehlt sich ergänzend eine Sonografie der Lymphknotenstationen, mindestens zervikal.
Zur differenzialdiagnostischen Abgrenzung, insbesondere bei fehlendem Nachweis von anti-SSA-Autoantikörpern, bieten sich die Speicheldrüsenbiopsie und -histologie als weiterer diagnostischer Schritt an. Typischerweise findet sich eine fokale lymphozytäre Sialadenitis. Zur Quantifizierung der Lymphozytenanreicherung dient der Fokus-Score: Eine Ansammlung von mindestens 50 Lymphozyten wird als 1 Fokus gewertet. In einem Areal von mindestens 8mm2 wird die Anzahl der Foci per 4mm2 angegeben. Ein Score ≥1 wird als positiv im Sinne einer Sjögren-Erkrankung gewertet. Es sollte beachtet werden, dass sich mit einer Sjögren-Erkrankung zu vereinbarende histologische Veränderungen bei ca. 15% der Normalbevölkerung nachweisen lassen.5,13,17 Neben diagnostischen Aspekten ermöglicht die histopathologische Untersuchung eine prognostische Aussage: Ein Fokus-Score ≥3 oder der Nachweis von Keimzentren sind mit einer Lymphomentwicklung assoziiert.18,19
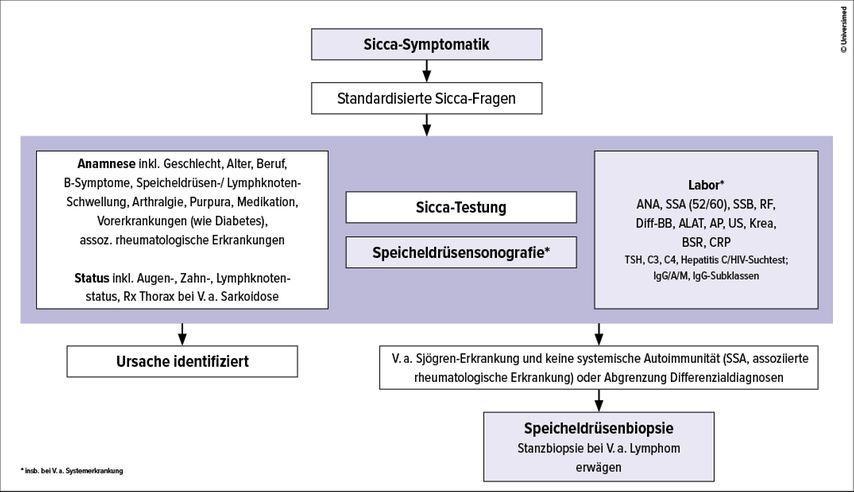
Die ACR/EULAR-Klassifikationskriterien für die Sjögren-Erkrankung von 2016 sind in Tabelle 3 aufgeführt.5 Im klinischen Alltag sollte die Diagnose einer Sjögren-Erkrankung unter Berücksichtigung oben genannter Aspekte erfolgen. Abbildung 1 zeigt einen Vorschlag zum diagnostischen Vorgehen bei Sicca-Symptomen im Alltag.
Abb. 1: Vorschlag zum Vorgehen bei Sicca-Symptomen (ANA = antinukleäre Antikörper, RF = Rheumafaktor, Rx = Röntgen, US = Urinstatus)
Zurückkommend zu dem eingangs geschilderten Fallbeispiel wissen Sie, dass histopathologische Veränderungen in der Lippenspeicheldrüsen-Biopsie wie der Fokus-Score mit einer Sjögren-Erkrankung vereinbar sind. Sie wissen aber auch, dass dieser Befund nicht spezifisch ist und sich auch in der Normalbevölkerung nachweisen lässt. Daher empfehlen Sie der Patientin, weitere diagnostische Bausteine wie eine Labordiagnostik oder Sonografie der Speicheldrüsen zu ergänzen, um das Vorliegen einer Sjögren-Erkrankung zu beurteilen.
Literatur:
1 Thomas E et al.: Sjogren’s syndrome: a community-based study of prevalence and impact. Br J Rheumatol 1998; 37(10): 1069-76 2 Schein OD et al.: Dry eye and dry mouth in the elderly: a population-based assessment. Arch Intern Med 1999; 159(12): 1359-63 3 Schiffman RM et al.: Utility assessment among patients with dry eye disease. Ophthalmology 2003; 110(7): 1412-9 4 Bezzina OM et al.: Subjective and objective measures of dryness symptoms in primary Sjogren’s syndrome: capturing the discrepancy. Arthritis Care Res 2017; 69(11): 1714-23 5 Shiboski CH et al.: 2016 American College of Rheumatology/European League Against Rheumatism classification criteria for primary Sjogren’s syndrome: a consensus and data-driven methodology involving three international patient cohorts. Arthritis Rheumatol 2017; 69(1): 35-45 6 Stefanski AL et al.: The diagnosis and treatment of Sjogren’s syndrome. Dtsch Arztebl Int 2017; 114(20): 354-61 7 Nocturne G, Mariette X: Advances in understanding the pathogenesis of primary Sjogren’s syndrome. Nat Rev Rheumatol 2013; 9(9): 544-56 8 Aeby MM et al.: Das primäre Sjögren-Syndrom – eine Systemerkrankung: Teil 1. Swiss medical forum – Schweizerisches Medizin-Forum 2017; 47: 1027-38 9 Mariette X, Criswell LS: Primary Sjogren’s syndrome. N Engl J Med 2018; 378(10): 931-39 10 Witte T: [Sjogren’s syndrome]. Z Rheumatol 2019; 78(6): 511-7 11 Satoh M et al.: Prevalence and sociodemographic correlates of antinuclear antibodies in the United States. Arthritis Rheum 2012; 64(7): 2319-27 12 Pisetsky DS et al.: ANA as an entry criterion for the classification of SLE. Autoimmun Rev 2019; 18(12): 102400 13 Brito-Zeron P et al.: Practical diagnostic tips for the Sjogren clinic: pearls, myths and mistakes. Clin Exp Rheumatol 2022; 40(12): 2413-27 14 Hayashi N et al.: Prevalence of disease-specific antinuclear antibodies in general population: estimates from annual physical examinations of residents of a small town over a 5-year period. Mod Rheumatol 2008; 18(2): 153-60 15 Cornec D et al.: Contribution of salivary gland ultrasonography to the diagnosis of Sjogren’s syndrome: toward new diagnostic criteria? Arthritis Rheum 2013; 65(1): 216-25 16 Jousse-Joulin S et al.: Video clip assessment of a salivary gland ultrasound scoring system in Sjogren’s syndrome using consensual definitions: an OMERACT ultrasound working group reliability exercise. Ann Rheum Dis 2019; 78(7): 967-73 17 Radfar L et al.: Prevalence and clinical significance of lymphocytic foci in minor salivary glands of healthy volunteers. Arthritis Rheum 2002; 47(5): 520-4 18 Sene D et al.: Ectopic germinal center-like structures in minor salivary gland biopsy tissue predict lymphoma occurrence in patients with primary Sjogren’s syndrome. Arthritis Rheumatol 2018; 70(9): 1481-8 19 Risselada AP et al.: The prognostic value of routinely performed minor salivary gland assessments in primary Sjogren’s syndrome. Ann Rheum Dis 2014; 73(8): 1537-40 20 Seror R et al.: EULAR Sjogren’s syndrome disease activity index: development of a consensus systemic disease activity index for primary Sjogren’s syndrome. Ann Rheum Dis 2010; 69(6): 1103-9
Das könnte Sie auch interessieren:
Biologikatherapien in der Schwangerschaft
«Biologika sind in der Schwangerschaft in Ordnung» – mit dieser klaren Aussage fasste Prof.Dr. med. Ian Giles, University College London, im Rahmen der RheumaPreg-2025- Konferenz in Wien ...
Spondyloarthritis: Schäden sind bei frühzeitiger Therapie reversibel
Das alte Konzept der nichtradiografischen axialen Spondyloarthritis und der radiografischen ankylosierenden Spondylitis wird zunehmend verlassen und in der Diagnose axiale ...
Schwierig zu behandelnde oder therapierefraktäre SpA
Die Behandlungsmöglichkeiten bei Spondyloarthritis haben sich mit Einführung der Biologika dramatisch verbessert. Das bedeutet allerdings nicht, dass alle Patient:innen in ausreichendem ...