Bildgebung bei Riesenzellarteriitis
Bericht:
Dr. med. Felicitas Witte
Wie stellt sich eine Riesenzellarteriitis in der Bildgebung dar und welche Untersuchung ist die beste? Diese Fragen klärt Prof. Daikeler aus Basel. Die Bildgebung sollte jedenfalls nicht den Beginn der Therapie verzögern.
Die Diagnose einer Riesenzellarteriitis lässt sich heutzutage ohne Bildgebung nicht mehr stellen. Sie steht aber vor mehreren Herausforderungen. Zum einen gibt es verschiedene pathophysiologische Korrelate, die sich in der Bildgebung in unterschiedlichem Ausmass zeigen: erstens die Entzündung mit verdickter Wand der Blutgefässe, zweitens die Fibrose und drittens Stenosen bzw. Verschlüsse, die sich im Laufe der Erkrankung bilden können. «Ein akut entzündetes Gefäss ohne verdickte Gefässwand sieht natürlich ganz anders aus als ein chronisch entzündetes mit hochgradiger Stenose», so Prof. Dr. med. Thomas Daikeler, Leitender Arzt in der Rheumatologie im Universitätsspital Basel.
Hinzu kommt, dass die Vaskulitis überall im Körper auftreten kann. Von den kleinsten Gefässen im Kopf bis zur Aorta können alle Gefässe betroffen sein. Mit den zur Verfügung stehenden bildgebenden Verfahren sei man wie Platon in dem berühmten Höhlengleichnis: «Wir sehen die Schatten und die Abbildungen, aber nie die Histologie», sagt Daikeler. «Wir müssen uns hüten, die Aufnahmen automatisch mit der Diagnose einer aktiven Vaskulitis gleichzusetzen.»
Daikeler berichtet von Ultraschallaufnahmen der Temporalarterie in einer Publikation von Ärzten aus Italien.1 In der ersten waren die Verdickung der Gefässwand und die Lumenverengung deutlich zu erkennen – die Histologie bestätigte eine Riesenzellarteriitis. In der anderen Aufnahme erschien die Wand der Temporalarterie nicht verdickt und das Lumen war nicht eingeengt. Der Patient hatte aber trotzdem eine Vaskulitis, nämlich der Gefässe in der Adventitia der Temporalarterie. Dies war erst in der Histologie zu erkennen.
So eine Vaskulitis der Adventitiagefässe findet sich manchmal auch im Rahmen einer Riesenzellarteriitis. «Bei der Interpretation der Aufnahmen man immer im Hintergrund haben, was sie aussagen können und was nicht», sagt Daikeler. Was die Bildgebung so kompliziert macht: Die verschiedenen bildgebenden Verfahren zeigen unterschiedliche Parameter. Es lässt sich die Morphologie der Gefässe darstellen – etwa im Ultraschall. Man kann Aussagen treffen zur metabolischen Aktivität in der Gefässwand, also sich ein Bild machen über die Entzündungsaktivität – z.B. in der PET-CT. Eine vermehrte Entzündung zeigt sich hier durch eine erhöhte Aufnahme von Glukose. Die Durchblutung in der Gefässwand lässt sich nach Kontrastmittelapplikation im MRI oder CT bestimmen.
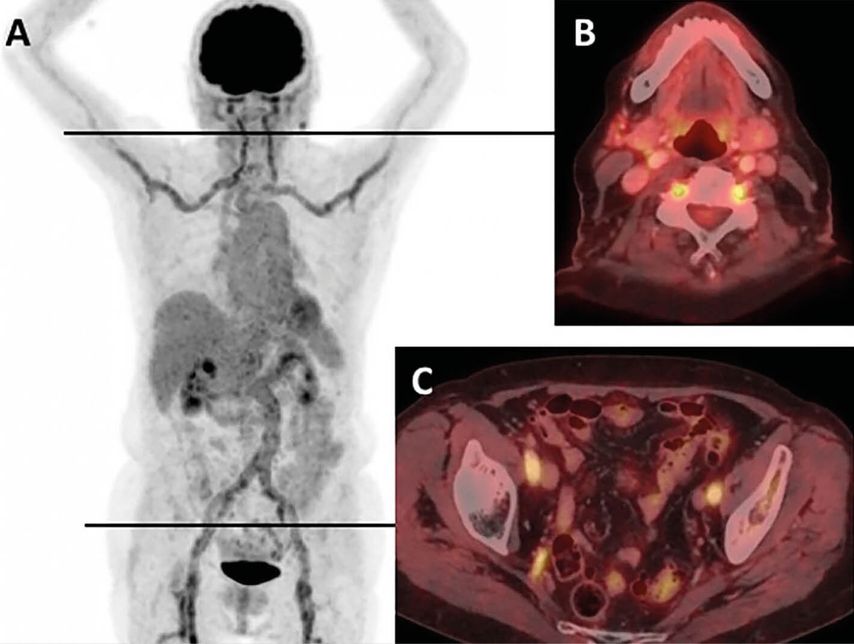
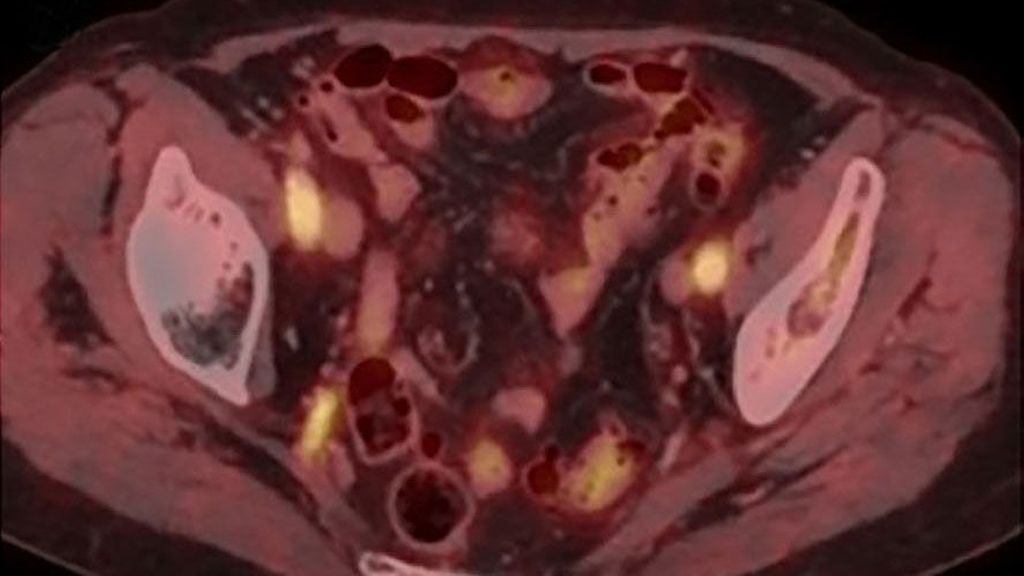
Abb. 1: Vermehrte Aufnahme von Fluorodeoxyglucose (FDG) in den grossen Arterien eines Patienten mit unbehandelter Riesenzellarteriitis (A). Fusionsbilder aus axialer PET/CT zeigen FDG-Anreicherungen in den Vertebralarterien (B) bzw. in den Arteriae iliacae internae und externae (C) (aus Berger CT et al., Swiss Med Wkly 2018; 148: w14661)6
Ultraschall sensitiver als Biopsie
Die Temporalarterie sei das einzige Gefäss, so Daikeler, wo man gleichzeitig Biopsie, Histologie und Bildgebung untersuchen könne. Eine Forschergruppe um Raashid Luqmani von der Universität Oxford verglich Ultraschall mit Biopsie im Rahmen eines Health Technology Assessments.2 In dieser sogenannten TABUL-Studie wurden 381 Patienten untersucht, die wegen des Verdachts auf Riesenzellarteriitis aufgenommen wurden. Bei allen Patienten wurde eine Behandlung mit Verdacht auf Riesenzellarteriitis gestartet und innerhalb von 10 Tagen wurden sowohl Ultraschall als auch Biopsie durchgeführt. Die Sensitivität der Biopsie betrug 39%, was deutlich geringer war als die des Ultraschalls (54%). «Ultraschall ist vermutlich sensitiver, weil wir einen viel grösseren Ausschnitt des Gefässes darstellen können als mit der Biopsie, wo wir nur einen 1–2cm langen Gefässstrang untersuchen können», so Daikeler.
Die Spezifität der Biopsie war mit 100% allerdings deutlich höher als die des Ultraschalls mit 81%. Wären alle Patienten nur mit dem Ultraschall gescreent worden und eine Biopsie wäre nur bei den negativen Patienten durchgeführt worden, hätte man 43% der Patienten eine Biopsie ersparen können. Auch ist der Ultraschall deutlich günstiger.
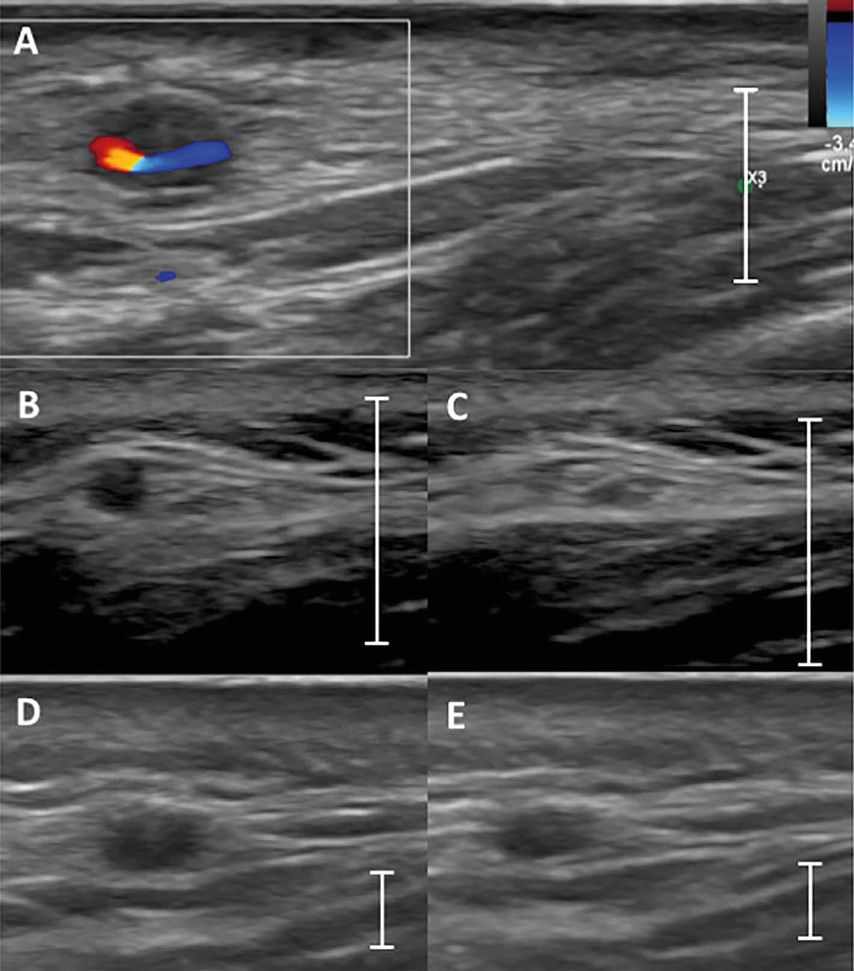
Abb. 2: Typische Zeichen einer Vaskulitis in den Temporalarterien im Ultraschall. (A): Beispiel für das Halo-Zeichen: Farbig dargestellt ist das noch durchgängige Volumen des Gefässes im Farbdoppler-Modus. Darum herum ist die hypoechogene Gefässwand zu erkennen. (B) und (C): nicht entzündete Temporalarterie. In (B) wird das Gefäss nicht komprimiert, in (C) wird das Gefäss komprimiert und die Gefässwand ist nicht mehr zu sehen (negatives Kompressionszeichen). (D) und (E): positives Kompressionszeichen in einer Temporalarterie mit Vaskulitis. In (D) wird das Gefäss nicht komprimiert, in (E) wird das Gefäss komprimiert und man sieht die Arterie immer noch. Die Linie zeigt eine Skala von einem Zentimeter an (aus Berger CT et al., Swiss Med Wkly 2018; 148: w14661)6
Ultraschall hat den Vorteil, dass er keine Strahlenbelastung verursacht, fast überall verfügbar und preiswert ist. Man kann damit eine Reihe von Gefässen beurteilen: die Temporalarterie, Vertebralarterien, die zum Kopf führenden Gefässe, die Beinarterien und bei schlanken Personen auch die Bauchgefässe. Es gibt bestimmte diagnostische Kriterien für eine Riesenzellarteriitis im Ultraschall:
-
Halo: im axialen Schnitt hofartige, konzentrische, deutlich echoarme Verdickung der Gefässwand, die am ehesten einem entzündlichen Wandödem entspricht; im Längsschnitt symmetrische, langstreckige Wandverdickung. Echoreichere und eher irreguläre Wandverdickungen weisen eher auf Arteriosklerose hin, vor allem bei extrakranieller Arteriosklerose im Bereich der Karotiden.
-
Stenosen und Verschlüsse: Die entzündliche Intimahyperplasie kann zur Obstruktion des Lumens führen, duplexsonografisch erkennbar als Flussbeschleunigung oder bei Verschlüssen als fehlendes Flusssignal in der farbkodierten Duplexsonografie.
-
Gefässwand verdickt, im Vergleich zur Arteriosklerose aber echoarm. Dies erscheint im Ultraschall oftmals polsterartig.
Im B-Bild-Modus erkennbares «Compression Sign»: Die Temporalarterie wird mit dem Schallkopf komprimiert. Verschwindet die Arterie nach Kompression pulslos, ist das ein Hinweis darauf, dass die Gefässwand nicht vaskulitisch verdickt ist. Ist die Gefässwand unter Kompression immer noch verdickt, spricht dies für eine Vaskulitis.
Schwierig ist mitunter die Unterscheidung zwischen vaskulitischen und arteriosklerotischen Veränderungen. Es gibt Bestrebungen, Grenzwerte für die Dicke von Intima und Media festzulegen, jeweils für Patienten mit Vaskulitis und ohne Vaskulititis. Dies soll die Differenzialdiagnose erleichtern. Es laufen prospektive Studien. «Etabliert sind die Grenzwerte aber noch nicht», sagt Daikeler. «Es gibt hier noch einige Hürden zu überwinden.» So befinden sich etwa die Grenzwerte im Submillimeterbereich. «Man kann sich gut vorstellen, dass es die Werte enorm beeinflussen kann, je nachdem an welcher Stelle des Gefässes man misst, ob man den Schallkopf genau senkrecht zum Gefäss hält.» Sollte es in Zukunft möglich sein, diese Messungen durchzuführen, könne man mit dem Ultraschall möglicherweise auch den Therapieverlauf kontrollieren.
Neben dem Ultraschall wird zur Diagnostik die PET-CT mit Fluordeoxyglucose (FDG) eingesetzt. Die Interpretation der PET-CT sei wegen des subjektiven Eindrucks allerdings nicht einfach, so Daikeler, weshalb versucht werde, den Uptake zu quantifizieren. Es gibt verschiedene Techniken. Ein semiquantitatives Vorgehen ist das folgende: Man vergleicht visuell den FDG-Uptake der Gefässwand mit dem der Leber. Wenn die Farbe in der Gefässwand genauso ist oder stärker als in der Leber, weist das auf eine Vaskulitis.
Für objektiver hält Daikeler die Methode, den Uptake in das Gefäss zu messen, den sogenannten «standard uptake value» (SUV). Diesen bestimmt man in der Gefässwand und vergleicht ihn dann mit dem SUV in der Leber. Dabei teilt man den SUV im Gefäss durch den SUV in der Leber. Als Cut-off gilt ein Quotient von 1. Alles, was darüber ist, ist verdächtig für eine Vaskulitis.
Allerdings zeigen sich Unterschiede in der Aussagekraft des SUV, je nachdem in welcher Körperregion man die Gefässe untersucht. So scheint der SUV am besten in der supraaortalen Körperregion zwischen entzündeten und nicht entzündeten Gefässen zu differenzieren. «Man sollte also als Erstes den SUV in den Aa. subclavia, carotis, axillaris und vertebralis anschauen», rät Daikeler. Patienten mit einem SUV-Quotienten von über 1 in diesen Gefässen werden nur selten fälschlicherweise so eingestuft, dass sie keine Vaskulitis haben. Je tiefer im Körper man ankommt, desto höher muss man den Cut-off des SUV-Quotienten setzen, nämlich bei etwa 1,3.
Verschiedene Verfahren ergänzen sich
Seit April 2020 wird die PET-CT von der Grundversicherung bei Verdacht auf Grossgefässvaskulitis und zum Therapiemonitoring bezahlt. Voraussetzung ist allerdings, dass die Untersuchung von einem Facharzt für Rheumatologie, Allergologie und klinische Immunologie, allgemeine innere Medizin, Angiologie oder Gefässchirurgie angeordnet wird.
Die MRT sei ähnlich nützlich wie die PET-CT, sagt Daikeler. Es gibt dazu aber weniger Studien, welche die Wertigkeit der MRT für die Grossgefässvaskulitis untersucht haben. In der MRT lässt sich die Dicke der Gefässwand messen und damit die Aktivität der Entzündung einschätzen. In der MR-Angiografie lässt sich allenfalls eine Gefässverengung erkennen, ebenfalls als Zeichen einer chronischen Entzündung. «Hier ist die MRT der PET-CT vermutlich überlegen, sofern die PET-CT ohne Kontrastmittel angefertigt wird», so Daikeler.
In der Praxis komme es immer wieder zu Situationen, sagt Daikeler, wo sich die Frage stelle, ob eine Bildgebung ausreiche, und zwar dann, wenn man klinisch eine Vaskulitis vermutet, aber der Befund negativ ist. Er und sein Team untersuchten vor einem Jahr, ob PET-CT und Ultraschall gleiche Ergebnisse liefern oder ob sich die Untersuchungen ergänzen.3 In die Studie wurden 102 Patienten eingeschlossen. 68 von ihnen hatten nachgewiesenermassen eine Riesenzellarteriitis, die übrigen 34 galten als Kontrollpatienten. Die beiden Techniken wiesen zwar generell mit vergleichbarer Genauigkeit aus, ob der Patient eine Riesenzellarteriitis hatte. Doch innerhalb einzelner Gefässregionen zeigten sich oft erhebliche Unterschiede und oft war das PET-CT negativ und der Ultraschall positiv und umgekehrt. Das Gleiche gilt, wenn man PET-CT und MRI vergleicht.4 «Wenn man sich unsicher ist, lohnt es sich, eine weitere Untersuchungstechnik zu probieren», so das Fazit von Daikeler.
Forscher versuchen, die Aktivität der Riesenzellarteriitis zu bestimmen. Dies kann sehr nützlich sein, um den Therapieerfolg zu beurteilen. Es gibt hier aber noch wenige Daten, sowohl für MRT als auch CT. Es scheint so zu sein, dass die durch die Riesenzellarteriitis bedingten Veränderungen noch lange Zeit in den Aufnahmen zu sehen sind. «Vermutlich brauchen wir genauere Messtechniken», sagt Daikeler, «und zwar quantifizierbare Kriterien, die auch geringe Änderungen in den Bildern darstellen, was dann auf eine Remission hinweisen könnte.»
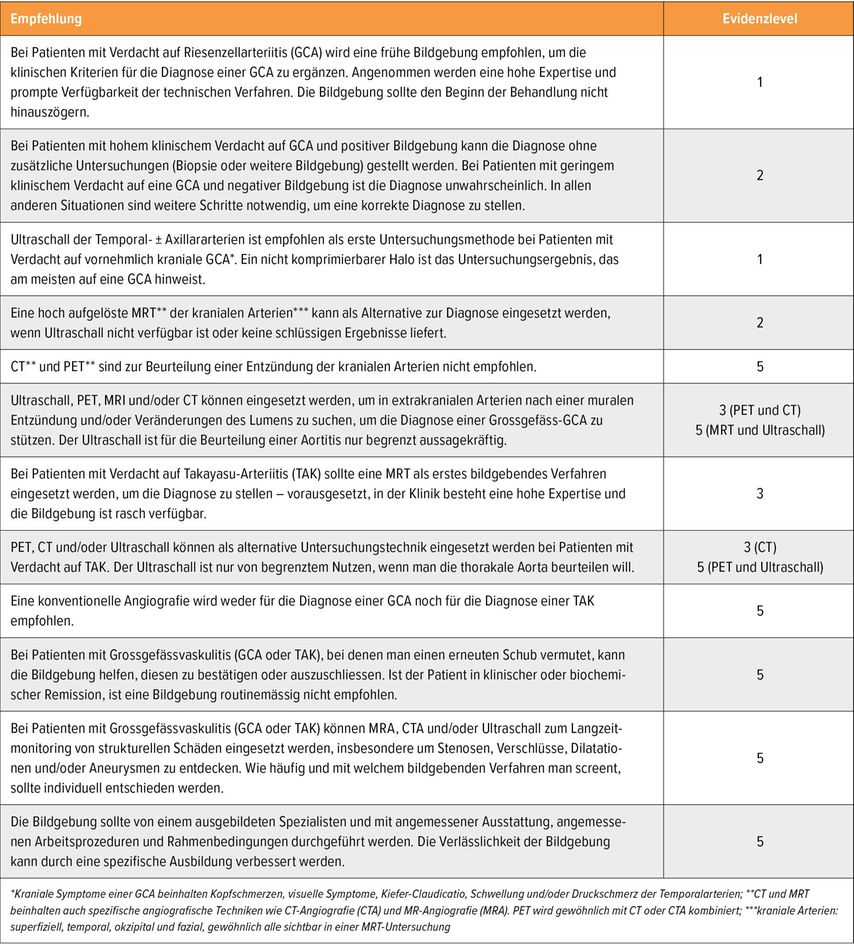
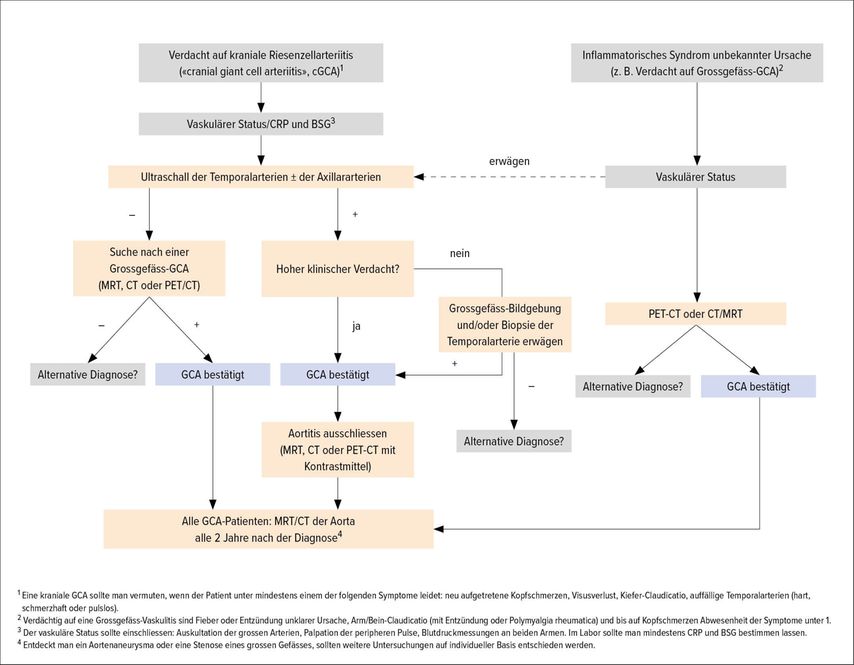
In Tabelle 1 sind die Empfehlungen der EULAR zur Bildgebung bei Grossgefässvaskulitiden dargestellt.5 «Es lohnt sich, das anzuschauen», sagt Daikeler. Er hat mit Mitarbeitern aus Basel einen Algorithmus zum Vorgehen im Alltag verfasst, damit Patienten so rasch wie möglich eine valide Diagnose bekommen (Abb. 3).6 Dieser Algorithmus beruht auf dem Prinzip des «Fast Track». Was essenziell ist: Die Patienten müssen rasch in eine Klinik kommen, wo es genügend Expertise gibt und wo die technischen Untersuchungsmöglichkeiten vorhanden sind. «Es ist nicht wichtig, ob MRT, CT oder PET-CT durchgeführt wird, sondern dass ein Verfahren gewählt wird, das in der Klinik etabliert ist und mit dem die Kollegen in der Klinik Erfahrung haben», sagt Daikeler.
Abb. 3: Strategie der Bildgebung bei Patienten mit Verdacht auf Riesenzellarteriitis im Universitätsspital Basel. Gemäss EULAR-Empfehlungen kann die Biopsie der Temporalarterie durch eine Bildgebung ersetzt werden. Die Art der Aufnahme sollte entsprechend der lokalen Expertise und der Verfügbarkeit gewählt werden6
Welche Bildgebung wann wo Sinn hat, dazu soll die neu etablierte Riesenzellarteriitis-Kohorte im Rahmen der Foundation Swiss Clinical Quality Management(SCQM) Erfahrungswerte sammeln. «Wir hoffen, dass wir damit rasch mehr Erkenntnisse gewinnen, von welcher diagnostischen Strategie der Patient am meisten profitiert», sagt Daikeler. «Es wäre gut, wenn wir so viele Patienten mit Riesenzellarteriitis wie möglich dort einschliessen könnten.»
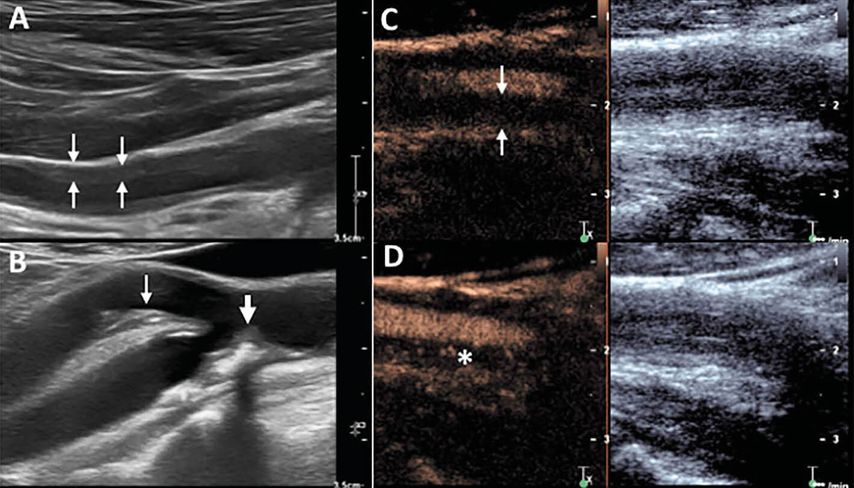
Abb. 4: Diagnostik der grossen Gefässe mit Farbduplex und kontrastverstärktem Ultraschall. (A): Vaskulitis einer Arterie in der Achsel. Zu erkennen ist im Farbduplex zwischen den Pfeilen die typische hypoechogene Wandverdickung. (B): Vergleich mit Arteriosklerose, hier zu sehen in den Karotiden. Es zeigen sich unregelmässig geformte, hypo- und hyperechogene Plaques mit Schallschatten in der A. carotis interna (dicker Pfeil) und der A. carotis externa (dünner Pfeil). (C) und (D): Truncus comunis der A. carotis bei einem Patienten mit Grossgefässvaskulitis. Man sieht die starke Vaskularisation der Gefässwand. Kleine Bläschen aus Kontrastmittel innerhalb der Gefässwand weisen auf eine Hyperämie/Vaskularisation hin. In (C) hat der Untersucher mit einem «flush» die Bläschen zerstört. Man sieht das vergrösserte Gefässvolumen ohne Kontrastmittelbläschen (Pfeile) innerhalb der verdickten Gefässwand. In (D) erscheinen die Bläschen wieder (*), was auf eine verstärkte Durchblutung hinweist (aus Berger CT et al., Swiss Med Wkly 2018; 148: w14661)6
Fazit
Ultraschall ist die Grundlage der Diagnostik. Ob bei Bedarf ergänzend MRT, CT oder PET-CT durchgeführt werden sollten, hängt von der Verfügbarkeit und der lokalen Expertise ab. Die Patienten müssen rasch in eine Klinik kommen, wo es genügend Expertise gibt und wo die technischen Untersuchungsmöglichkeiten vorhanden sind. Die Bildgebung sollte den Beginn der Therapie nicht verzögern.
Quelle:
Experiencia 2020, 15. Oktober 2020, online
Literatur:
1 Muratore F et al.: Comparison between colour duplex sonography findings and different histological patterns of temporal artery. Rheumatology 2013; 52: 2268-74 2 Luqmani R et al.: The Role of Ultrasound Compared to Biopsy of Temporal Arteries in the Diagnosis and Treatment of Giant Cell Arteritis (TABUL): a diagnostic accuracy and cost-effectiveness study. Health Technol Assess 2016; 20(90): 1-238 3 Imfeld S et al.: [18F]FDG positron emission tomography and ultrasound in the diagnosis of giant cell arteritis: congruent or complementary imaging methods? Rheumatology 2020; 59(4): 772-8 4 Quinn KA, Grayson PC: The role of vascular imaging to advance clinical care and research in large-vessel vasculitis. Curr Treatm Opt Rheumatol 2019; 5(1): 20-35 5 Dejaco C et al.: EULAR recommendations for the use of imaging in large vessel vasculitis in clinical practice. Ann Rheum Dis 2018; 77(5): 636-43 6 Berger CT et al.: The clinical benefit of imaging in the diagnosis and treatment of giant cell arteritis. Swiss Med Wkly 2018; 148: w14661
Das könnte Sie auch interessieren:
Biologikatherapien in der Schwangerschaft
«Biologika sind in der Schwangerschaft in Ordnung» – mit dieser klaren Aussage fasste Prof.Dr. med. Ian Giles, University College London, im Rahmen der RheumaPreg-2025- Konferenz in Wien ...
Spondyloarthritis: Schäden sind bei frühzeitiger Therapie reversibel
Das alte Konzept der nichtradiografischen axialen Spondyloarthritis und der radiografischen ankylosierenden Spondylitis wird zunehmend verlassen und in der Diagnose axiale ...
Schwierig zu behandelnde oder therapierefraktäre SpA
Die Behandlungsmöglichkeiten bei Spondyloarthritis haben sich mit Einführung der Biologika dramatisch verbessert. Das bedeutet allerdings nicht, dass alle Patient:innen in ausreichendem ...