Lungenkrebsscreening: erste Erfahrungen aus Zürich aus radiologischer Perspektive
Autor:
Dr. med. Jonas Kroschke, MBA
Institut für Diagnostische und Interventionelle Radiologie
UniversitätsSpital Zürich
E-Mail: jonas.kroschke@usz.ch
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Lungenkrebs ist weltweit und in der Schweiz eine der häufigsten krebsbedingten Todesursachen. Internationale Studien zeigen, dass Früherkennungsprogramme mittels Niedrigdosis-Computertomografie die Sterblichkeit bei Hochrisikopersonen senken. Erste Erfahrungen aus Zürich geben Einblick in Umsetzung, Chancen und Herausforderungen aus radiologischer Perspektive.
Keypoints
-
Niedrigdosis-CT-Screening senkt die Lungenkrebssterblichkeit bei Hochrisikopersonen – Pilotprojekte liefern wichtige Erkenntnisse zur Umsetzbarkeit.
-
Standardisierte Untersuchungsprotokolle und Risikostratifizierungssysteme wie Lung-RADS verbessern die Vergleichbarkeit und interdisziplinäre Kommunikation.
-
Interdisziplinäre Boards sind entscheidend für das Management suspekter Befunde.
-
KI und photonenzählende CT-Technik könnten das Screening künftig effizienter und sicherer machen.
Lungenkrebs ist weltweit die führende krebsbedingte Todesursache. Die Schweiz verzeichnet bei einer Inzidenz von rund 4900 Fällen ca. 3300 Todesfälle pro Jahr, womit Lungenkrebs auch hierzulande die häufigste Krebstodesursache darstellt (Krebsliga, 2024).1 Ein wesentlicher Grund für die schlechte Prognose ist eine verspätete Diagnosestellung: Während Lungenkrebspatient:innen in einem lokalisierten Stadium ein 5-Jahres-Überleben von ca. 64,7% zeigen, überleben nur 9,7% der Betroffenen mit bereits metastasiertem Krankheitsstadium länger als 5 Jahre.2
Studien aus den USA,3 Kanada4 oder den Niederlanden und Belgien5 konnten zeigen, dass die Durchführung eines Früherkennungsprogramms die Lungenkrebssterblichkeit bei Hochrisikopersonen signifikant senken kann.
In der Schweiz gibt es bisher kein nationales Screening, wohl aber Pilotprojekte wie in Lausanne oder das hier beschriebene, 2020 am Universitätsspital Zürich gestartete Programm. Das Ziel dieser Pilotprojekte ist es, Umsetzbarkeit, Akzeptanz und Auswirkungen auf Therapie und Überlebensrate unter den spezifischen Schweizer Rahmenbedingungen zu eruieren und somit die wissenschaftliche Grundlage für eine mögliche schweizweite Einführung eines Programms zu bieten.
Umsetzung in Zürich
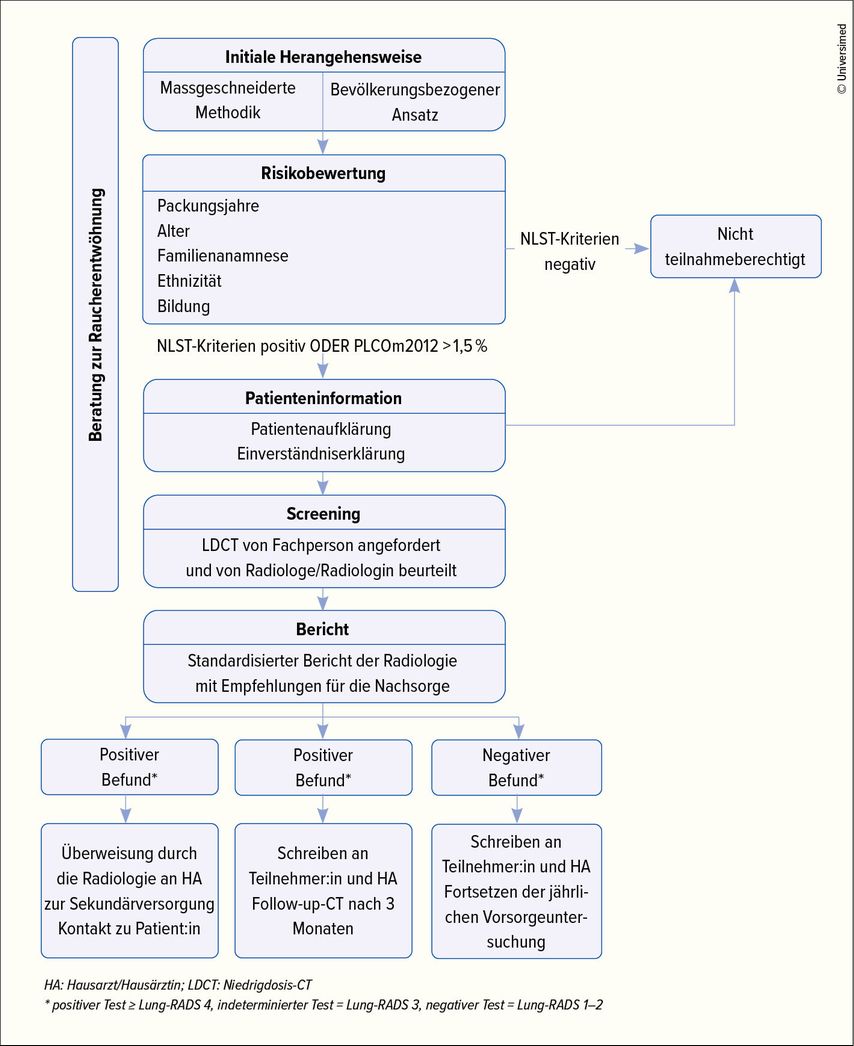
Die Struktur des Lungenkrebsfrüherkennungsprogramms in Zürich richtet sich nach internationalen Empfehlungen, die bereits in verschiedenen Programmen zur Anwendung kommen. Abbildung 1 stellt den Ablauf des Programms in Zürich dar. Die Rekrutierung erfolgt sowohl über ärztliche Zuweiser (Hausärzte, Pneumologen u.a.) als auch über die Möglichkeit der Selbstzuweisung von Interessierten, die durch Medienberichte oder Flyer in Wartezimmern auf das Programm aufmerksam geworden sind.
In einer Vorbesprechung wird geprüft, ob die potenziellen Teilnehmer:innen die Einschlusskriterien erfüllen bzw. Ausschlusskriterien vorhanden sind. Diese entsprechen den Kriterien der NLST-Studie aus den USA.6 Teilnahmeberechtigt sind 55- bis 74-Jährige mit >30 Packungsjahren, aktuell rauchend oder Ex-Raucher:innen (Aufgabe des Rauchens vor ≤15 Jahren). Ausgeschlossen werden Personen mit vorangegangenem Lungenkrebs, schwerwiegenden Komorbiditäten, Thorax-CT in den letzten 18 Monaten oder Symptomen wie Hämoptysen bzw. >7kg Gewichtsverlust/Jahr.
Im nächsten Schritt erfolgt die Niedrigdosis-CT des Thorax ohne Kontrastmittelgabe gemäss den Empfehlungen der europäischen Gesellschaft für thorakale Bildgebung (ESTI).7
Befundung und Management
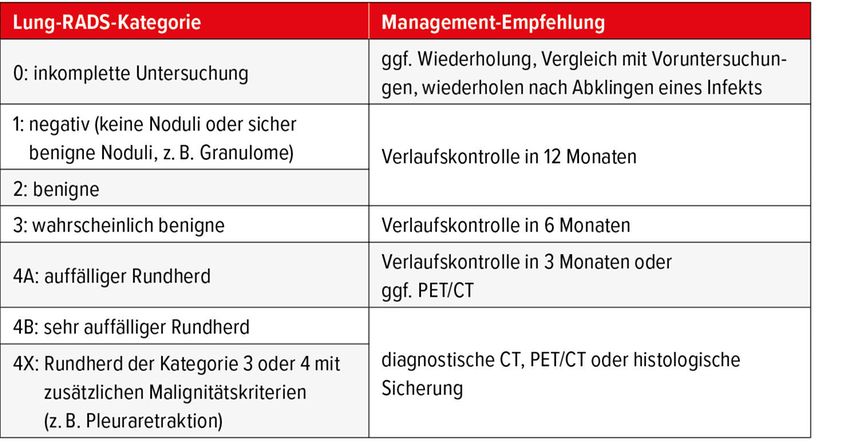
Bei der Auswertung der Bilder wird eine einheitliche Befundstruktur verwendet, welche die Vollständigkeit, Reproduzierbarkeit und interdisziplinäre Kommunikation verbessert und standardisiert. Der entscheidende Bestandteil des strukturierten Befunds ist die Risikoabschätzung hinsichtlich der Wahrscheinlichkeit für das Vorliegen eines Lungenkarzinoms. Unterschiedliche Verfahren können hier eingesetzt werden, die über die weitgehend bekannten Fleischner-Kriterien hinausgehen,8 da die Screening-Population ein anderes Risikoprofil aufweist als die allgemeine Bevölkerung. In Zürich wird das System des American College of Radiology verwendet, die Lung-RADS-Kriterien.9 Diese Kriterien richten sich ausschliesslich nach den bildmorphologischen Charakteristika der Lungenrundherde. Aus der jeweiligen Einteilung lassen sich weitere Handlungsempfehlungen ableiten, wie in Tabelle 1 dargestellt.
Für die praktische Umsetzung in Zürich wird – wie in Abbildung 1 dargestellt – zwischen negativen (Lung-RADS 1 und 2), indeterminierten (Lung-RADS 3) und positiven CT-Screening-Ergebnissen unterschieden. Bei negativen Befunden erfolgt die nächste Untersuchung im 1-jährigen Screening-Intervall. Indeterminierte Befunde werden zunächst im verkürzten Intervall von 6 Monaten mittels CT kontrolliert, sodass im Anschluss eine Herauf- oder Herabstufung erfolgen kann. Positive Befunde werden einer interdisziplinären Besprechung mit Beteilung von Fachpersonen aus Radiologie, Pneumologie und Thoraxchirurgie («lung nodule board») für die Festlegung des weiteren Procederes zugeführt.
Die Anwendung von Lung-RADS im Rahmen des Lungenkrebsscreenings bietet eine Reihe klarer Vorteile, ist jedoch auch mit gewissen Einschränkungen verbunden. Zu den Vorteilen zählt vor allem die Standardisierung: Befundung und Management folgen klaren Regeln, wodurch sich die interindividuelle Variabilität reduziert. Die klaren Lung-RADS-Empfehlungen für das weitere Vorgehen erleichtern zudem die strukturierte Datenerfassung für Forschung und Registerprojekte.
Auf der anderen Seite können die eher konservativen Nachsorgeempfehlungen bei bestimmten aggressiven Tumoren zu einer Verzögerung der Diagnose führen. Besonders bei nicht soliden oder partiell soliden Knoten besteht die Gefahr einer Unterschätzung des Risikos. Auch ist die Abgrenzung einzelner Kategorien in der Praxis nicht immer eindeutig. Hinzu kommt, dass Lung-RADS individuelle Patientenfaktoren wie Komorbiditäten (insbesondere das Vorliegen eines Lungenemphysems ist mit einem höheren Risiko für die Entwicklung eines Lungenkarzinoms assoziiert) oder besondere Risikokonstellationen (z.B. Ausmass des Raucherstatus) nur eingeschränkt berücksichtigt. Schliesslich fehlt bislang die Integration moderner Risikomodelle oder KI-basierter Entscheidungsunterstützung, die in Zukunft eine noch genauere Risikoeinschätzung ermöglichen könnten.
Inzidentelle Befunde – Chance oder Belastung?
Neben pulmonalen Rundherden deckt die Niedrigdosis-CT oft zusätzliche Befunde wie eine Koronarsklerose oder ein Lungenemphysem auf. In Zürich werden relevante Nebenbefunde mit dem Lung-RADS-«S»-Modifier erfasst (S steht hier für «significant finding»), sofern es sich um Befunde mit einer etwaigen therapeutischen Konsequenz handelt. Die Zahl der möglichen Nebenbefunde ist gross, da die CT des Thorax eine Vielzahl von Strukturen erfasst: Mediastinum, Gefässe, Lymphknoten, Pleura, Lungenparenchym, Atemwege, Thoraxwand, oberes Abdomen oder Skelett können Nebenbefunde enthalten. Die Beschreibung von Nebenbefunden steht jedoch aktuell noch in Diskussion und es bestehen noch keine klaren internationalen Handlungsempfehlungen, da nicht ausreichend wissenschaftliche Evidenz zum Nutzen zur Verfügung steht. Der Nachteil einer Überdiagnostik und möglicher unnötiger Zusatzuntersuchungen steht einem möglichen Nutzen entgegen.
Zukunftsperspektiven
Im Rahmen des Lungenkrebsfrüherkennungsprogramms in Zürich werden auch verschiedene technische Innovationen untersucht. Software-Innovationen wie Computer- und KI-gestützte Systeme zur verbesserten Detektion, Klassifikation und Verlaufsbeurteilung von Lungenrundherden werden ebenso eingesetzt wie Hardware-Innovationen wie die photonenzählende CT, welche insbesondere die Möglichkeit einer weiteren Strahlendosisreduktion beinhaltet. Langfristig könnte auf Basis der in Zürich und Lausanne erhobenen Daten und der weiteren Fortschritte auch eine Ausweitung des Früherkennungsprogramms auf nationaler Ebene in der Schweiz erfolgen.
Literatur:
1 Krebsliga Schweiz: Krebs in der Schweiz: wichtige Zahlen. https://www.krebsliga.ch/fileadmin/downloads/sheets/zahlen-krebs-in-der-schweiz.pdf ; zuletzt aufgerufen am 28.8.2025 2 National Cancer Institute: Cancer Stat Facts: Lung and Bronchus Cancer. https://seer.cancer.gov/statfacts/html/lungb.html ; zuletzt aufgerufen am 28.8.2025 3 Aberle DR et al.: Reduced lung-cancer mortality with low-dose computed tomographic screening. N Engl J Med 2011; 365: 395-409 4 McWilliams A et al.: Probability of cancer in pulmonary nodules detected on first screening CT. N Engl J Med 2013; 369: 910-9 5 de Koning HJ et al.: Reduced lung-cancer mortality with volume CT screening in a randomized trial. N Engl J Med 2020; 382: 503-13 6 Aberle DR: Implementing lung cancer screening: the US experience. Clin Radiol 2017; 72: 401-6 7 Snoeckx A et al.: Lung cancer screening with low-dose CT: definition of positive, indeterminate, and negative screen results. A nodule management recommendation from the European Society of Thoracic Imaging. Eur Radiol 2025; doi: 10.1007/s00330-025-11648-4 8 MacMahon H et al.: Guidelines for Management of Incidental Pulmonary Nodules Detected on CT Images: From the Fleischner Society 2017. Radiology 2017; 284: 228-43 9 McKee BJ et al.: Performance of ACR Lung-RADS in a clinical CT lung screening program. J Am Coll Radiol 2015; 12: 273-6 10 Jungblut L et al.: Swiss Pilot Low-Dose CT Lung Cancer Screening Study: first baseline screening results. J Clin Med 2023; 12: 5771
Das könnte Sie auch interessieren:
Inklusivere Ansätze in der Behandlung von Lungenerkrankungen
Warum Intersektionalität und Barrierefreiheit Merkmale klinischer Qualität sind: Der vorliegende Beitrag fasst zentrale Inhalte des Vortrags „Inklusivere Ansätze in der Behandlung von ...
Seltene pulmonale Mykosen: Reisemitbringsel oder doch schon heimisch?
Endemische systemische Mykosen werden überwiegend durch Schimmelpilze verursacht, die im menschlichen Organismus charakteristische Hefeformen annehmen. Klima- und Landnutzungswandel ...