Zielgerichtete Tumortherapien beim cholangiozellulären Karzinom
Autor:
Priv.-Doz. Dr. Hossein Taghizadeh, PhD, MSc
Onkologie – Abteilung für Innere Medizin I
Arbeitsgruppe Gastrointestinale Onkologie
Universitätsklinikum St. Pölten
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Das cholangiozelluläre Karzinom (CCA) ist eine aggressive Tumorentität mit begrenzter Prognose. Allerdings hat sich das CCA aufgrund von therapierbaren genetischen Veränderungen zu einer Art „Spielwiese“ für die Präzisionsonkologie entwickelt, besonders ab der palliativen Zweitlinie.
Keypoints
-
Die Immuntherapie hat Einzug in die Erstlinientherapie des fortgeschrittenen/metastasierten cholangiozellulären Karzinoms gehalten.
-
Die molekulare Analyse ist ein integraler Bestandteil des modernen therapeutischen Managements von cholangiozellulären Karzinomen und sollte vor Einleitung der Erstlinientherapie erfolgen!
-
Cholangiozelluläre Karzinome weisen mehrere gezielt therapierbare molekulare Aberrationen auf, die heutzutage ab der Zweitlinie zielgerichtet behandelt werden sollen.
-
Auf diese Genveränderungen mit ESMO ESCAT Level I soll getestet werden: FGFR2-Fusionen oder Rearrangements, NTRK-Fusionen, IDH1 (R132), BRAFV600E, HER2-Amplifikation und KRASG12C.
Das CCA gilt als „orphan disease“, allerdings ist die Inzidenz in den letzten Jahren steigend.1,2 Das CCA umfasst eine Gruppe morphologisch und molekular heterogener aggressiver Karzinome mit schlechter Prognose, die je nach anatomischem Ursprung in intrahepatisch, perihilär (Klatskin) und distal unterschieden werden.3 Alle drei Subtypen entstammen den Zellen des Gallengangsepithels, den Cholangiozyten. Das intrahepatische CCA ist in Österreich die häufigste Subentität.4 Laut den aktuellen EASL/ILCA-Richtlinien ist Österreich weltweit gesehen ein Hotspot-Land für das intrahepatische CCA.5
Die meisten Patient:innen werden im fortgeschrittenen Stadium der Erkrankung vorstellig, da das CCA in den frühen Stadien in der Regel asymptomatisch oder oligosymptomatisch ist.6 Trotz moderner diagnostischer Methoden und verbesserter Therapien ist die Prognose nach wie vor schlecht: Im fortgeschrittenen/metastasierten Stadium liegt das mediane Gesamtüberleben bei circa 13 Monaten und die 5-Jahres-Überlebensrate liegt bei unter 25% trotz modernster Therapien.7,8
Das CCA zeichnet sich derzeit durch eine dynamische Entwicklung im Bereich des therapeutischen Managements aus, vor allem im Bereich der zielgerichteten Therapien ab der palliativen Zweitlinie. In den letzten Jahren hat diese Entwicklung zu einigen Neuerungen geführt, die jedoch eine Herausforderung für die optimale Therapiewahl bedeuten.
Um den aktuellen Kenntnisstand zu bündeln und einen nationalen Konsens über die Therapien des CCA zu erzielen, fand 2022 im Rahmen des DGHO-Kongresses in Wien ein Treffen österreichischer Expert:innen statt. Die Ergebnisse dieses Treffens wurden in der Fachzeitschrift Frontiers in Oncology publiziert und bieten eine wertvolle Orientierungshilfe für die Behandlung des CCA in Österreich.9
Chemotherapie bildet die Basis inder ersten Linie
Das Rückgrat der palliativen Erstlinientherapie bildet die Chemotherapie mit Gemcitabin/Cisplatin gemäß der Phase-III-Studie ABC-02 für „platin-eligible“ Patient:innen und wird in Übereinstimmung mit den ESMO-Guidelines als Standardtherapie gesehen und empfohlen.10,11
Darüber hinaus belegten die zwei großen Phase-III-Studien TOPAZ-1 und KEYNOTE-966 den klinischen Nutzen der Kombination von Immuntherapie und Chemotherapie. TOPAZ-1 untersuchte den PD-L1-Inhibitor Durvalumab und KEYNOTE-966 den PD-1-Inhibitor Pembrolizumab. Somit sollte der Einsatz der Immuntherapie in der Erstlinienbehandlung erwogen werden.11–13
Unabhängig von der Wahl der Erstlinientherapie sollte bei fitten Patient:innen (ECOG 0–1) mit lokal fortgeschrittener Krankheit alle zwei Monate ein Re-Staging durchgeführt werden. Anschließend sollten diese Krankheitsfälle im interdisziplinären Tumorboard mit der Frage nach Resektabilität/Ablation diskutiert werden. Entscheidend ist, dass im Tumorboard neben der internistischen Onkologie auch die Disziplinen Radiologie, interventionelle Radiologie und die Chirurgie anwesend und mit dem Management von hepatobiliären Erkrankungen sehr vertraut sind.
Im metastasierten Setting reichen Re-Stagings alle zehn bis zwölf Wochen aus.
Zweitlinie: Bedarf an mehr zielgerichteter Therapie
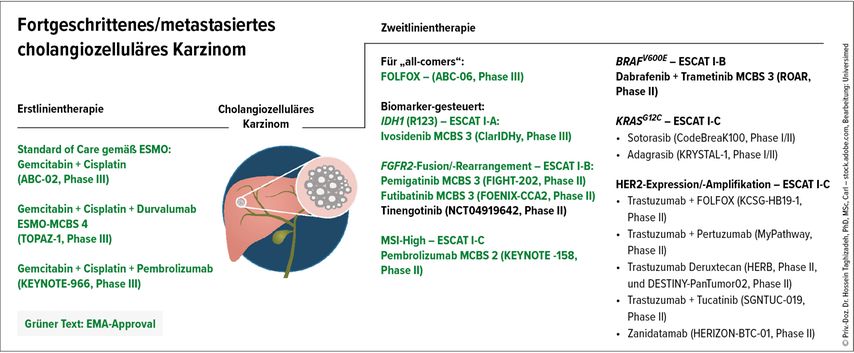
Für rund drei Viertel der Patient:innen gibt es gegenwärtig keine Möglichkeit der zielgerichteten Behandlung in der Zweitlinie, sodass eine Fluoropyrimidin-basierte Chemotherapie verwendet werden sollte.9,11
Zielgerichtete Zweitlinientherapie (molekular stratifiziert)
Der Ansatz einer molekulargesteuerten Therapie ist bei einem Viertel der Patient:innen möglich und ganz klar die bevorzugte Therapieoption. Es wird dringend empfohlen, die molekulare Analyse vor Beginn der Erstlinientherapie („upfront testing“) zu veranlassen.9,11
Der Testpanel sollte auf jeden Fall folgende Genveränderungen mit ESMO-ESCAT Level I beinhalten:
FGFR2-Fusionen oder -Rearrangements, NTRK-Fusionen, IDH1 (R132), BRAFV600E, HER2-Amplifikation und KRASG12C.9,11
Die FGFR2-Inhibitoren Pemigatinib und Futibatinib sind bei vorbehandelten Patient:innen mit FGFR2-Fusionen oder -Rearrangements zugelassen.14,15
Bei Patient:innen mit IDH1-Mutationen ist der zugelassene IDH1-Inhibitor Ivosidenib die Therapie der Wahl.16
Die einarmige Phase-II-Basket-Studie ROAR zeigte einen klinischen Nutzen für Dabrafenib plus Trametinib bei BRAFV600E-mutiertem CCA.17
Patient:innen mit NTRK-positivem CCA können mit den NTRK-Inhibitoren Larotrectinib oder Entrectinib behandelt werden.18 Bei Patient:innen mit KRASG12C-Mutation kann Sotorasib oder Adagrasib verwendet werden.19
Für HER2-Amplifikationen empfiehlt sich eine Anti-HER2-gesteuerte Therapie.20 Abbildung 1 bildet die Empfehlungen anschaulich ab.
Zusammenfassung
Der Einsatz von Immuntherapie bereits in der Erstlinienbehandlung einerseits und die Applikation von zielgerichteten Therapien auf der Basis des individuellen molekularen Profils andererseits haben die Behandlungsoptionen des CCA erheblich erweitert und bereichert. Es ist anzunehmen, dass die Komplexität des therapeutischen Managements von CCA in den nächsten Jahren mit der Entwicklung von neuen molekulargesteuerten Therapien weiter zunehmen wird.
Literatur:
1 Andersen JB: Molecular pathogenesis of intrahepatic cholangiocarcinoma. J Hepatobiliary Pancreat Sci 2015; 22(2): 101-13 2 Qurashi M et al.: Epidemiology of cholangiocarcinoma. Eur J Surg Oncol 2023: 107064 3 Banales JM et al.: Cholangiocarcinoma 2020: the next horizon in mechanisms and management. Nat Rev Gastroenterol Hepatol 2020; 17(9): 557-88 4 Capuozzo M et al.: Intrahepatic cholangiocarcinoma biomarkers: towards early detection and personalized pharmacological treatments. Mol Cell Probes 2024; 73: 101951 5 EASL-ILCA Clinical Practice Guidelines on the management of intrahepatic cholangiocarcinoma. J Hepatol 2023; 79(1): 181-208 6 Banales JM et al.: Expert consensus document: Cholangiocarcinoma: current knowledge and future perspectives consensus statement from the European Network for the Study of Cholangiocarcinoma (ENS-CCA). Nat Rev Gastroenterol Hepatol 2016; 13(5): 261-80 7 Lindner PM et al.: The impact of changed strategies for patients with cholangiocarcinoma in this millenium. HPB Surg 2015; 2015: 736049 8 Rimini M et al.: Durvalumab plus gemcitabine and cisplatin in advanced biliary tract cancer: an early exploratory analysis of real-world data. Liver Int 2023; 43(8): 1803-12 9 Taghizadeh H et al.: Systemic treatment of patients with locally advanced or metastatic cholangiocarcinoma - an Austrian expert consensus statement. Front Oncol 2023; 13: 1225154 10 Valle J et al.: Cisplatin plus gemcitabine versus gemcitabine for biliary tract cancer. NEngl J Med 2010; 362(14): 1273-81 11 Vogel A et al.: Biliary tract cancer: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up. Ann Oncol 2023; 34(2): 127-40 12 Oh DY et al.: Plain language summary of the TOPAZ-1 study: durvalumab and chemotherapy for advanced biliary tract cancer. Future Oncol 2023; 19(34): 2277-89 13 Kelley RK et al.: Pembrolizumab in combination with gemcitabine and cisplatin compared with gemcitabine and cisplatin alone for patients with advanced biliary tract cancer (KEYNOTE-966): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet 2023; 401(10391): 1853-65 14 Abou-Alfa GK et al.: Pemigatinib for previously treated, locally advanced or metastatic cholangiocarcinoma: a multicentre, open-label, phase 2 study. Lancet Oncol 2020; 21(5): 671-8415 Goyal L et al.: Futibatinib for FGFR2-rearranged intrahepatic cholangiocarcinoma. NEngl J Med 2023; 388(3): 228-39 16 Abou-Alfa GK et al.: Ivosidenib in IDH1-mutant, chemotherapy-refractory cholangiocarcinoma (ClarIDHy): a multicentre, randomised, double-blind, placebo-controlled, phase 3 study. Lancet Oncol 2020; 21(6): 796-807 17 Subbiah V et al.: Dabrafenib plus trametinib in patients with BRAF(V600E)-mutated biliary tract cancer (ROAR): a phase 2, open-label, single-arm, multicentre basket trial. Lancet Oncol 2020; 21(9): 1234-43 18 Mie T et al.: Current status of targeted therapy for biliary tract cancer in the era of precision medicine. Cancers 2024; 16(5): 879 19 Jeong SY et al.: The efficacy of immune checkpoint inhibitors in biliary tract cancer with KRAS mutation. Therap Adv Gastroenterol 2023; 16: 17562848231170484 20 Ayasun RM et al.: The role of HER2 status in the biliary tract cancers. Cancers (Basel) 2023; 15(9): 2628
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...