Zielgerichtete Therapie: Welche Daten sind „practice-changing“?
Autorin:
Priv.-Doz. OÄ Dr. Kathrin Strasser-Weippl, MBA
1. Medizinische Abteilung, Zentrum für Onkologie und Hämatologie, Klinik Ottakring, Wien
In San Antonio wurden 2024 viele wichtige, diskussionswürdige und praxisrelevante Studienergebnisse präsentiert. Insbesondere zum HER2+ und tripelpositiven Mammakarzinom (TPBC) gibt es Daten, von denen einige relevant für die klinische Praxis sind.
In der offenen Phase-II-Studie TOUCH wurde der Zusatz entweder des CDK4/6-Inhibitors Palbociclib (Palbo) mit Letrozol oder der Chemotherapie Paclitaxel (T) zu Trastuzumab (H) und Pertuzumab (P) bei postmenopausalen Patient:innen mit frühem HR+ HER2+ Mammakarzinom (TPBC) evaluiert. Der Chemotherapie-freie Arm (Palbociclib+endokrine Therapie [ET]+Trastuzumab+Pertuzumab) wurde dabei als potenzielle Deeskalationstherapie konzipiert.
Als primärer Endpunkt war die Rate der pathologischen Komplettremissionen (pCR) definiert. Basierend auf der Hypothese, dass der RBsig-Status mit der Therapie interagieren könnte, wurde dahingehend eine genetische Analyse durchgeführt und eine Stratifikation nach RBsighigh vs. RBsiglow vorgenommen. Es konnte diesbezüglich jedoch keine Interaktion festgestellt werden.
Beim Patient:innenkollektiv handelt es sich nicht um die Gruppen mit dem niedrigsten Risiko – zu den Einschlusskriterien zählten Tumoren >1cm, cN 0–1. Auch die Dauer der NAT von nur 16 Wochen war sehr kurz. Die NAT könnte sicher für einen längeren Zeitraum verabreicht werden und eine pCR-Rate von 33% wäre nicht zufriedenstellend. Die pCR-Raten von 32,9% vs. 33,3% im Arm ohne Chemotherapie (CTx) vs. Kontrollarm waren jedoch vergleichbar und diese Gleichwertigkeit konnte auch in den Subgruppen nachgewiesen werden. Der Zusatz von Palbo zur dualen Anti-HER2-Therapie ist also sehr effektiv.
Im CTx-haltigen Arm wurde zudem eine Abbruchrate von 16% verzeichnet, wohingegen im Palbo-haltigen Arm keine einzige Person die Therapie abgebrochen hat, was auf die hohe Therapieadhärenz der Patient:innen zur nicht-CTx-haltigen NAT hinweist.1
Zusatz von CDK4/6-Inhibition als Erhaltungstherapie bei TPBC
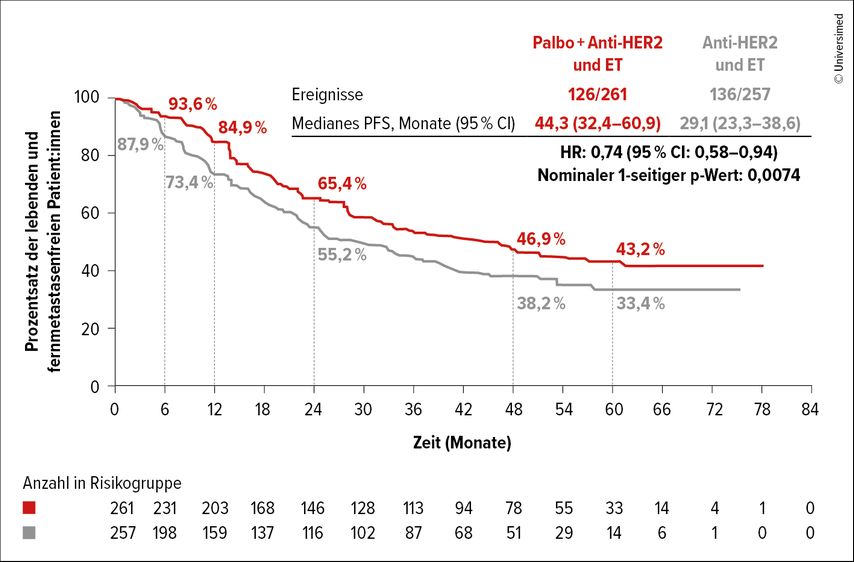
In der Phase-III-Studie PATINA wurde der Zusatz von Palbo zur ET und H+P als Erhaltungstherapie bei HR+ HER2– Patient:innen (n=518) in der Erstlinie untersucht. Als wesentliches Einschlusskriterium durften nur jene an der Studie teilnehmen, die nach der Induktionstherapie zumindest eine „stable disease“ hatten, „early progressors“ waren daher von vornherein ausgeschlossen. Das durch Prüfärzt:innen beurteilte progressionsfreie Überleben (PFS) war der primäre Endpunkt, es war im Palbo-haltigen Arm signifikant länger als im Kontrollarm. Es betrug nach einem medianen Follow-up (mFU) von 53 Monaten 44,3 vs. 29,1 Monate, was einer Differenz von 15 Monaten gleichkommt (HR: 0,74; nominaler 1-seitiger p-Wert=0,0074; Abb.1).
Abb. 1: PATINA – primärer Endpunkt: progressionsfreies Überleben (PFS, beurteilt durch den/die Prüfarzt/-ärztin; modifiziert nach Metzger O et al.)2
Unter der ET haben noch weitere Patient:innen ein Ansprechen gezeigt, was auf das Erreichen eines noch tieferen Ansprechens durch die Zugabe von Palbo hinweist. Die Autor:innen sehen diese Strategie als neuen „standard of care“ (SOC) bei HR+ HER2– Patient:innen.2
T-DXd beim metastasierten HER2-low/-ultralow-Brustkrebs
In die offene, multizentrische Phase-III-Studie DESTINY-Breast06 konnten vortherapierte Patient:innen mit metastasiertem HR+ HER2-low- (n=713) oder HER2-ultralow-BC (MBC) (n=153) eingeschlossen werden, bei denen die ET (≥2 Linien) ausgeschöpft war. Auch eingeschlossen wurden Patient:innen, die innerhalb von sechs Monaten nach Start der Erstlinientherapie mit ET+CDK4/6-Inhibitor im MBC-Setting eine Progredienz zeigten, und jene, die innerhalb von 24 Monaten unter einer adjuvanten ET ein Rezidiv entwickelt hatten.
Die Randomisation erfolgte im 1:1-Design zum ADC (Antikörper-Wirkstoff-Konjugat) Trastuzumab Deruxtecan (T-DXd) bzw. zu CTx nach Wahl der Prüfärzt:innen (Capecitabin, Nab-Paclitaxel oder Paclitaxel). 59% der Patient:innen erhielten Capecitabin3 – so, wie das in der klinischen Praxis auch gehandhabt wird. Insgesamt handelte es sich oft um ein „risikobehaftetes“ Patient:innenkollektiv: 31% hatten eine primäre endokrine Resistenz, 85% hatten viszerale Metastasen und von ihnen 67% Lebermetastasen.
Der absolute PFS-Benefit unter T-DXd war höher, wenn die Patient:innen primär endokrin resistent waren, und geringer, wenn sie lange auf ET angesprochen hatten, was daran liegt, dass das PFS im Standardarm in den drei Gruppen entsprechend länger wurde. Insgesamt führte aber T-DXd vs. CTx unabhängig von der Zeit bis zur Progression unter der Erstlinientherapie mit ET+CDK4/6-Inhibitor oder von der Art der endokrinen Resistenz zu einer Verlängerung des PFS. Der PFS-Unterschied zugunsten von T-DXd blieb auch nach der zweiten Progression aufrecht. Darüber hinaus profitierten die Patient:innen unabhängig von ihrer „disease burden“ (<3 vs. ≥3 lokale/metastatische Lokalisationen zu Baseline) von T-DXd gleichermaßen.3
Antikörper Margetuximabbei HER2+ frühem Brustkrebs
Trastuzumab wirkt teilweise über immunologische Mechanismen, einschließlich der ADCC („antibody-dependent cellular cytotoxicity“). Margetuximab ist ein Anti-HER2-Antikörper mit einer modifizierten Fc-Region, die dazu konzipiert ist, die ADCC zu erhöhen. In der Phase-III-Studie SOPHIA mit 536 vorbehandelten (≥2 Anti-HER2-Therapien) HER2+ MBC-Patient:innen wurde unter Margetuximab+CTx vs. Trastuzumab+CTx eine moderate Verlängerung des PFS und des Gesamtüberlebens verzeichnet (mPFS: 5,8 vs. 4,9 Monate; HR: 0,76; p=0,03; mOS: 21,6 vs. 19,8 Monate; HR: 0,89; p=0,33).4 Dazu ist bekannt, dass es Polymorphismen im CD16a-F-Allel gibt und CD16a-F-Allel-Träger:innen unter Margetuximab einen ausgeprägteren Benefit generieren.5
Basierend auf der Hypothese, dass Margetuximab im HER2+ EBC-Setting bei CD16a-F-Allel-Träger:innen noch effektiver sein würde, wurde die Substanz in der Phase-II-Studie MARGOT für zwölf Wochen in Kombination mit Paclitaxel und Pertuzumab (TMP) vs. THP als neoadjuvante Erstlinienstrategie untersucht.6 Interessant war, dass die NAT nur für zwölf Wochen verabreicht wurde. Die Randomisierung erfolgte im 2:1-Schema.
Die Patient:innen hatten EBC im Stadium II–III und wiesen einen CD16A-FF- oder -VV-Genotyp auf. Der Hormonrezeptor-Status spielte keine Rolle. Als primärer Endpunkt war die pCR-Rate (ypT0/TisN0) definiert. Dabei wurde unter TMP vs. THP nur ein numerischer Unterschied im Ausmaß von 10% verzeichnet (56% vs. 46%), dieser war jedoch nicht statistisch signifikant (p=0,25). Bei Stratifikation nach dem Hormonrezeptor-Status zeigte sich, dass bei HR+ Patient:innen unter TMP vs. THP eine um 20% höhere pCR-Rate erzielt wurde (54% vs. 36%), aber auch dieser Unterschied war nicht statistisch signifikant, sodass die Studie letztendlich negativ ausfiel. Auch die vermuteten Effekte von Margetuximab bei CD16A-F-Allel-Träger:innen konnten nicht verifiziert werden.6
HER2+ BC – chinesische Substanzen
Am SABCS 2024 wurden auch einige chinesische Studien zu Anti-HER2-Substanzen als Alternativen zu den europäischen Standards präsentiert.
In einer davon – der Phase-III-Studie PHILA – wurde der Tyrosinkinase-Inhibitor Pyrotinib vs. Placebo (PBO) jeweils in Kombination mit H+Docetaxel (HT) bei zuvor unbehandelten HER2+ MBC-Patient:innen untersucht.7 Bereits in einer Interimsanalyse wurde eine signifikante PFS-Verlängerung durch den Zusatz von Pyrotinib zu HT vs. PBO+HT nachgewiesen.8
Am SABCS 2024 wurden die finalen PFS-Ergebnisse präsentiert. Dabei konnte die Aufrechterhaltung des PFS-Benefits unter Pyrotinib bestätigt werden – das mPFS vs. Kontrollarm war mit 22,1 gegenüber 10,5 Monaten mehr als verdoppelt (HR: 0,44; 1-seitiger p-Wert <0,0001). Auch das mOS war im Pyrotinib-haltigen vs. Kontrollarm signifikant länger (HR: 0,64; 1-seitiger p-Wert=0,0038). Auch das Profil der Nebenwirkungen (AE) war gut managebar.7
FASCINATE-N ist eine weitere chinesische Studie, in der im offenen, dreiarmigen Design ein neues, gegen HER2 gerichtetes ADC (SHR-A1811) im HER2+ EBC-Setting (Stadien II–III) als NAT untersucht wurde. Die Patient:innen (n=265) wurden im 1:1:1-Schema zu Arm A (SHR-A1811 als Monotherapie), Arm B (SHR-A1811 in Kombination mit Pyrotinib) bzw. Arm C (SHR-A1811 in Kombination mit einer CTx [Carboplatin+nab-Paclitaxel]+H+P) für je 24 Wochen randomisiert.
Primärer Endpunkt war die pCR-Rate. Allerdings wurden keine signifikanten Unterschiede in den pCR-Raten nachgewiesen, vielmehr waren diese zwischen den Armen vergleichbar (63% vs. 62% vs. 66%). Immerhin war die ADC-Monotherapie gleich effektiv wie die CTx-haltige NAT und ging mit einer ähnlich hohen Rate an AE der Grade 3/4 einher wie das CTx-haltige Regime, wenngleich das Toxizitätsprofil geringfügig unterschiedlich war.9
Ob SHR-A1811 möglicherweise T-DXd im neoadjuvanten Setting ersetzen könnte, werden die Ergebnisse der zurzeit laufenden Studie DESTINY-Breast11 (NCT05113251) zeigen. In dieser dreiarmigen Phase-III-Studie wird T-DXd als Monotherapie (Arm A) vs. T-DXd, gefolgt von T+H+P (Arm B) vs. Doxorubicin+Cyclophosphamid, gefolgt von T+H+P (Arm C) bei HER2+ Hochrisiko-EBC-Patient:innen untersucht.10
IO als Zusatz zur CTx und H+Pin der Erstlinie bei HER2+ MBC
In der doppelblinden Phase-III-Studie NRG-BR00411 wurde geprüft, ob der Zusatz des Checkpoint-Inhibitors (CPI) Atezolizumab (Atezo) vs. PBO zusätzlich zu Docetaxel+H+P (dem SOC) zu einer Verlängerung von PFS und OS führt. Das Patient:innenkollektiv war relativ unselektioniert. Die meisten Studienteilnehmer:innen waren PD-L1-negativ. Zwar wurde unter der Zugabe von Atezo vs. PBO ein numerisch längeres PFS im Ausmaß von 38,1 Monaten vs. 22,2 verzeichnet, dieses war aber nicht statistisch signifikant und die Patient:innen konnten diesbezüglich keinen echten Vorteil erleben:Nachdem unter Atezo viele AE höherer Grade, mehr therapieassoziierte AE und sogar sechs Todesfälle dokumentiert worden waren, wurde die Studie frühzeitig abgebrochen. Dass die Patient:innen mindestens 30 Monate überlebt haben müssen, um von der Therapie zu profitieren, zeigt zudem, dass dies kein Konzept für die klinische Praxis darstellen kann.11
Im Gegensatz dazu fiel die offene, dreiarmige IIT-(„investigator-initiated trial“) Phase-II-Studie NeoHIP zu Pembrolizumab (Pembro) im neoadjuvanten Setting positiv aus: Mit dem Ziel der Steigerung der pCR-Rate wurden im Arm A (Kontrollgruppe) T+H+P, im Arm B T+H+P+Pembro und im Arm C T+H+Pembro jeweils für vier Zyklen verabreicht. Arm C wurde bald abgebrochen. Die Studienteilnehmer:innen mussten ein HER2+ EBC in den Stadien II–III aufweisen und therapienaiv sein.
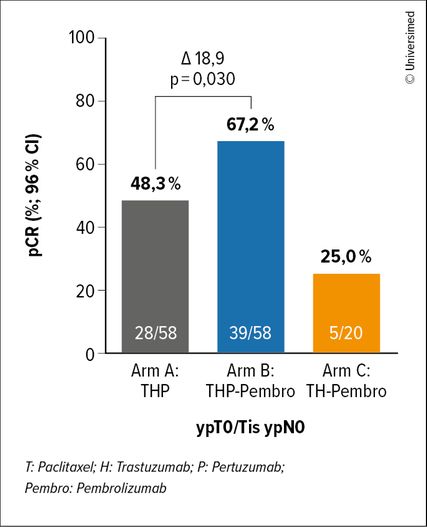
Abb. 2: Rate der pathologischen Komplettremission (pCR) in der Studie neoHIP (modifiziert nach McArthur H et al.)13
Tatsächlich war die pCR-Rate mit 67,2% im Pembro-haltigen Arm vs. 48,3% im Kontrollarm signifikant höher (p=0,0300; Differenz: 18,9%; Abb. 2). Es wurden keine therapieassoziierten Todesfälle verzeichnet und die AE der Grade 3/4 waren zwischen den Armen vergleichbar.13
Es wurden schon einige Studien zum Zusatz einer Immun- zur zielgerichteten Therapie durchgeführt wie beispielsweise ATHENE (ABCSG-52). In dieser Phase-II-Studie hat sich der Zusatz von Atezo zu H+P (zwei Zyklen), gefolgt von vier Zyklen Atezo+H+P+Epirubicin als erfolgreiche Deeskalationsstrategie erwiesen.14
OlympiA: Langzeit-FU-Daten bestätigen Olaparib-Benefit
In der Studie OlympiA waren HR+ HER2– Patient:innen oder Patient:innen mit tripelnegativem BC (TNBC; n=1836) im Stadium II oder III und dem Nachweis einer BRCA1/2-Mutation in der Keimbahn zur Erhaltung mit Olaparib bzw. PBO für ein Jahr als adjuvante Therapie randomisiert worden.15
Am SABCS 2024 wurden die Langzeitergebnisse für das OS, das Überleben frei von invasiver Krankheit (IDFS) und das fernmetastasenfreie (DDFS) Überleben präsentiert. Dabei bestätigte sich das Anhalten des initial beobachteten signifikanten Benefits durch Olaparib in allen erwähnten Endpunkten.15
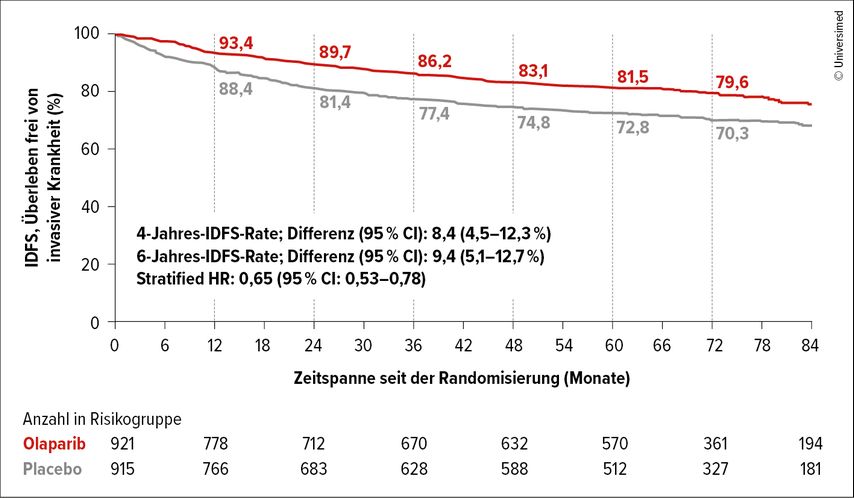
Die 6-Jahres-IDFS-Rate (primärer Endpunkt) betrug 79,6% vs. 70,3%, was einer Differenz von 9,4% zugunsten von Olaparib gleichkommt (stratifizierte HR: 0,65; Abb.3). Dieser Benefit konnte auch in allen Subgruppen nachgewiesen werden. Bei Analyse nach dem Hormonrezeptor-Status zeigte sich bei den TNBC-Patient:innen ein durchgehender Benefit. Bei den HR+ Patient:innen – wenn diese auch eine kleinere Gruppe waren – gehen die Kurven am Schluss zusammen, was die Frage aufwirft, ob sie Olaparib nicht für eine längere Zeit erhalten sollten, da es sich um jenes Kollektiv handelt, das in der Regel später rezidiviert.
Abb. 3: Studie OlympiA: Langzeitanalyse des Überlebens frei von invasiver Krankheit (IDFS; modifiziert nach Garber J et al.)16
Die entsprechenden Ergebnisse für das DDFS beliefen sich nach sechs Jahren auf 83,5% vs. 75,7% (stratifizierte HR: 0,65) und für das OS auf 87,5% vs. 83,2% (stratifizierte HR: 0,72).16 Bei so einem langen FU mit einer neuen Substanz stellt sich die Frage, ob es „versteckte“ AE gibt, die bislang nicht beachtet wurden – dies wurde ebenfalls analysiert, aber weder hämatologische Malignome noch andere Primärtumoren und auch keine Todesfälle ohne vorangehendes IDFS-Ereignis wurden verzeichnet.16
Literatur:
1 Malorni L et al.: SABCS 2024; Abstr. #RF1-02 2 Metzger O et al.: SABCS 2024; Abstr. #GS2-12 3 Bardia A et al.: SABCS 20924; Abstr. #LB1-04 4 Rugo HS et al.: Efficacy of margetuximab vs trastuzumab in patients with pretreated ERBB2-positive advanced breast cancer: a phase 3 randomized clinical trial. Jama Oncol 2021; 7(4): 573-84 5 Rugo HS et al.: Margetuximab versus trastuzumab in patients with previously treated HER2-positive advanced breast cancer (SOPHIA): final overall survival results from a randomized phase 3 trial. J Clin Oncol 2023; 41(2): 198-205 6 Waks AG et al.: SABCS 2024; Abstr. #LB1-02 7 Xu B et al.: SABCS 2024; Abstr. #GS1-03 8 Ma F et al.: BMJ 2023; 383: e076065 9 Li J-J et al.: SABCS 2024; Abstr. #GS1-04 10 Habeck N et al.: SABCS 2021; Abstr. #OT-12-04 11 Valero V et al.: SABCS 2024; Abstr. #RF3-04 12 Swain SM et al.: Pertuzumab, trastuzumab, and docetaxel in HER2-positive metastatic breast cancer. N Engl J Med 2015; 372(8): 724-34 13 McArthur H et al.: SABCS 2024; Abstr. #RF3-05 14 Rinnerthaler G et al.: Nature Cancer 2025; online unter https://www.nature.com/articles/s43018-024-00890-2 15 Tutt A et al.: Adjuvant olaparib for patients with BRCA1- or BRCA2-mutated breast cancer. N Engl J Med 2021; 384(25): 2394-405 16 Garber J et al.: SABCS 2024; Abstr. #GS1-09
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...