Wie sich die Therapielandschaft beim metastasierten Prostatakarzinom erweitert
Autorin:
Dr. med. Stefanie Fischer
Klinik für Medizinische Onkologie und Hämatologie
Kantonsspital St. Gallen
E-Mail: stefanie.fischer@kssg.ch
Die letzten Jahre haben viele Neuerungen in der Behandlung des metastasierten Prostatakarzinoms gebracht. Die wichtigsten Entwicklungen und neuesten Studiendaten lesen Sie hier.
Keypoints
-
Patienten mit lokalisiertem, «high risk» oder nodal-positivem Prostatakarzinom profitieren von zwei Jahren Abirateron begleitend zur Kombination aus lokaler Radiotherapie plus ADT.
-
Die Intensivierung ADT plus Chemotherapie oder neuer Hormontherapie ist ein Standard beim mHSPC. Für ausgewählte Hochrisikopatienten kommt sogar eine Triplett-Therapie infrage.
-
Die Radionuklid-Therapie mit Lutetium-PSMA ist eine neue Therapieoption bei Patienten mit CRPC.
-
Patienten mit CRPC sollten auf Defekte in DNA-Reparaturgenen und Mikrosatelliteninstabilität getestet werden, um eine zielgerichtete Behandlung mit PARP-Inhibitoren oder Immuncheckpoint-Inhibitoren durchführen zu können.
Die Therapielandschaft des fortgeschrittenen Prostatakarzinoms hat sich in den letzten Jahren grundlegend geändert. Chemotherapie oder die neuen antihormonell wirksamen Medikamente (NHA) wie Abirateron oder Enzalutamid kommen mittlerweile routinemässig früher zum Einsatz: bereits zum Beginn der Androgendeprivationstherapie (ADT) beim metastasierten hormonsensitiven Prostatakarzinom (mHSPC). Molekular zielgerichtete Strategien und die Radionuklidtherapie mit Lutetium-PSMA kommen neu beim kastrationsresistenten Prostatakarzinom (CRPC) zur Anwendung.
Hormonsensitives Prostatakarzinom
Die Reduktion des Testosterons auf Kastrationsniveau mittels ADT war über lange Zeit die einzige Behandlung für Patienten mit mHSPC. 2015 wurden die Resultate der CHAARTED-Studie1 veröffentlicht, die einen signifikanten Überlebensvorteil für die Gabe von sechs Zyklen Docetaxel begleitend zum Start der ADT zeigten. Seitdem sind viele weitere Studien publiziert worden, die alle den Überlebensvorteil der Therapieintensivierung bestätigt haben:
-
STAMPEDE ebenfalls für Chemotherapie2 und Abirateron3,
-
LATITUDE für Abirateron4,
-
ENZAMET5 und ARCHES für Enzalutamid6,7,
-
TITAN für Apalutamid8.
Initiale Hinweise, dass eine Intensivierung nur für Patienten mit «High volume»- bzw. «High risk»-Kriterien einen Vorteil bezüglich des Gesamtüberlebens (OS) haben könnte, liessen sich im Weiteren nicht mehr bestätigen.9,10 Entsprechend ist die Behandlung aus ADT plus einem Medikament zur Intensivierung mittlerweile ein Standard für praktisch alle Patienten mit mHSPC. Ausgenommen sind allenfalls Patienten mit schwersten Komorbiditäten, bei denen das Prostatakarzinom nicht als prognostisch führend angesehen wird.
Triplett-Therapie
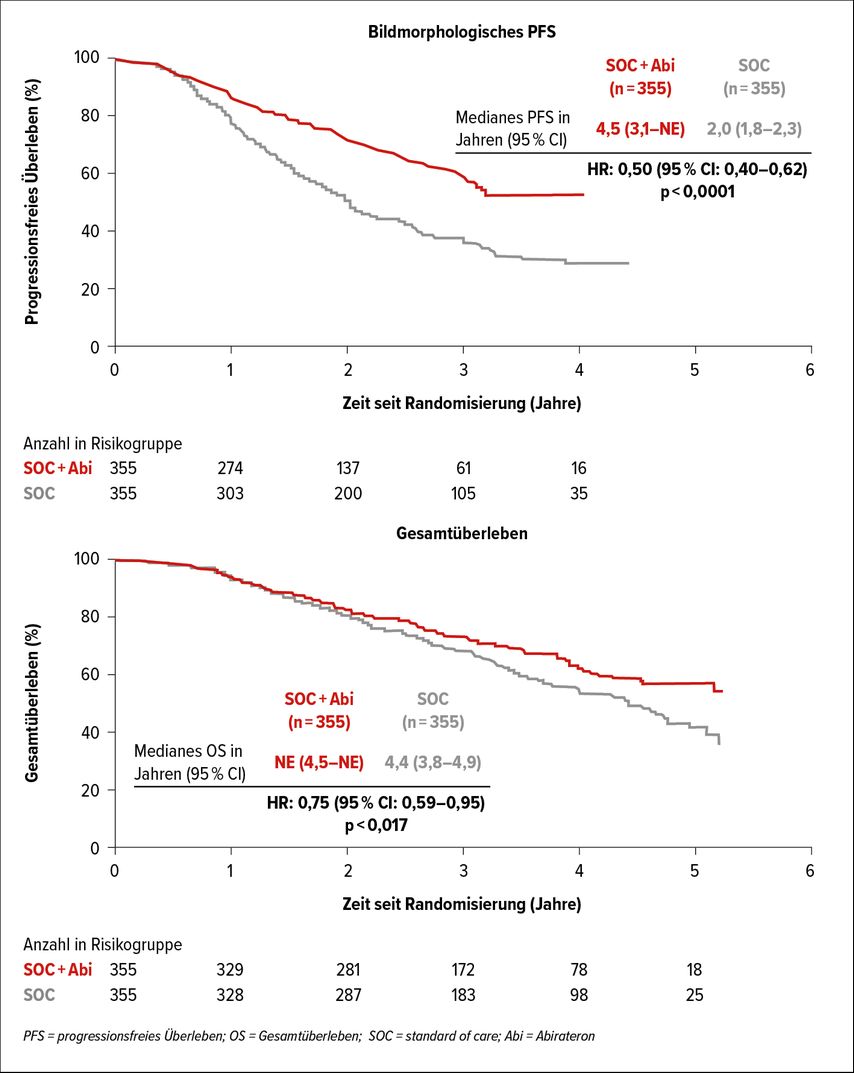
Am Jahreskongress der European Society for Medical Oncology (ESMO) 2021 wurden Daten der PEACE-1-Studie vorgestellt.11 Diese verglich bei Patienten mit mHSPC die Behandlung aus ADT plus sechs Zyklen Docetaxel mit einer Triplett- Therapie, bei der Patienten zusätzlich noch Abirateron erhielten. Bei einem um 2,5 Jahre verlängerten progressionsfreien Überleben (PFS) zeigte sich auch eine signifikante Verlängerung des Gesamtüberlebens für die Dreierkombination (Abb. 1).
Abb. 1: Resultate der PEACE-1-Studie zur Triplett-Therapie mit ADT + Chemotherapie + Abirateron (modifiziert nach Fizazi K et al.)11
In der Aufschlüsselung nach Volumen konnte dieser Vorteil bisher nur bei den Patienten mit «High volume»-Kriterien gemäss CHAARTED-Definition (viszerale Metastasen oder mindestens vier Knochenmetastasen, davon mindestens eine extraaxial) gesehen werden. Bei einer etwas höheren Rate von Lebertoxizität und Hypertonie, wie durch eine Behandlung mit Abirateron zu erwarten, zeigte sich ansonsten keine wesentlich vermehrte Toxizität.
Bereits 2019 vorgestellte Daten aus einer Subgruppenanalyse der ENZAMET-Studie12 hatten allerdings in einer Interimsanalyse keinen Überlebensvorteil gezeigt für ein Triplett aus ADT, Chemotherapie und Enzalutamid im Vergleich zu ADT und Enzalutamid allein. Für ausgewählte Patienten mit Hochrisikoprofil kann eine derartige Intensivierung sicher erwogen werden, ob sich das Triplett in Zukunft für die Mehrheit der Patienten etablieren wird, bleibt noch abzuwarten.
Weitere noch laufende Studien wie z.B. ARASENS, deren Resultate bald erwartet werden und welche die Ergänzung von ADT, Chemotherapie und Darolutamid untersucht, können weitere Aufschlüsse geben.
Lokalisiertes Stadium
Ebenfalls zeichnet sich eine Neuerung in der Behandlung des Hochrisiko-lokalisierten Prostatakarzinoms ab. Am ESMO-Kongress 2021 wurden neue Daten der Multiarmstudie STAMPEDE präsentiert.13 Diese Studie schliesst eine gemischte Population von Patienten ein. Sowohl Patienten mit Hochrisiko-lokalisiertem als auch nodal-positivem oder metastasiertem Prostatakarzinom, ebenso Patienten mit Rezidiv nach Lokaltherapie sind erlaubt.
Der Vorteil von Abirateron begleitend zur ADT wurde für die Gesamtpopulation bereits 2017 gezeigt und publiziert.3 Hingegen widmete sich die aktuelle Analyse der Frage, ob explizit auch Patienten mit lokalisiertem Prostatakarzinom, für die eine radikale lokale Radiotherapie geplant ist, von zwei Jahren adjuvanter Therapie mit Abirateron begleitend zu drei Jahren ADT profitieren. Als Hochrisikokriterien galten ein positiver Lymphknotenstatus (im Becken) oder mindestens zwei der folgenden Kriterien: T3 oder T4, ein PSA von mindestens 40ng/ml und ein Gleason-Score von 8 oder höher.
Zwei Jahre Abirateron zusätzlich führten zu einem signifikanten Vorteil bzgl. des metastasenfreien Überlebens und des Gesamtüberlebens mit einer Verbesserung der OS-Rate von 77 auf 86% nach sechs Jahren. Eine Konklusion in Bezug auf Patienten mit einem Rezidiv nach vorheriger Lokaltherapie ist bislang jedoch nicht möglich. Diese waren mit einem Anteil an der Studienpopulation von nur 3% deutlich unterrepräsentiert.
Kastrationsresistentes Prostatakarzinom
Beim kastrationsresistenten Prostatakarzinom hat sich die Radionuklid-Therapie mit 177Lutetium-PSMA als neue Option etabliert. Hierbei handelt es sich um einen Beta-Strahler, der PSMA («prostate specific membrane antigen») auf der Oberfläche von Prostatakarzinomzellen bindet und somit gezielt an Tumorzellen hochenergetische Strahlung abgibt. PSMA ist eine transmembranäre Carboxypeptidase und liegt beim Prostatakarzinom hochexprimiert vor, wohingegen es auf übrigen Körperzellen nur sehr limitiert vorkommt, z.B. auf Zellen der Speicheldrüsen.
Am Meeting der American Society of Clinical Oncology (ASCO) 2021 wurden Phase-III-Daten der VISION-Studie vorgestellt.14 Diese verglich maximal sechs Zyklen 177Lutetium-PSMA-Therapie plus «standard of care» (SOC) mit alleinigem SOC bei Patienten, welche zuvor entsprechende bildgebende Kriterien bzgl. PSMA-Positivität erfüllen mussten.
Bei der Interpretation der Studiendaten ist es wichtig anzumerken, dass Patienten eingeschlossen wurden, welche zuvor mindestens eine Linie taxanhaltiger Chemotherapie und ein NHA erhalten hatten. Der erlaubte SOC im Kontrollarm schloss andere Chemotherapien, Immuntherapie und Radium-223 aus, sodass Patienten im Kontrollarm letztlich meist nur mit Steroiden, lokaler Radiotherapie oder dem jeweils anderen NHA behandelt werden konnten. Das Ansprechen auf Enzalutamid und besonders Abirateron nach vorherigem Versagen des jeweils anderen NHA ist bekanntermassen jedoch äusserst begrenzt.15–17
Die VISION-Studie zeigte eine signifikante Verlängerung von PFS und OS für die Kombination mit der 177Lutetium-PSMA-Therapie. Nachteilig an der Behandlung ist, dass Patienten aus Strahlenschutzgründen nach jedem Behandlungszyklus für einige Tage stationär bleiben müssen. Im Übrigen ist die Therapie jedoch sehr gut verträglich mit Hämatotoxizität, leichter Fatigue und Mundtrockenheit als den häufigsten Nebenwirkungen. Ein Cross-over war in der VISION-Studie nicht erlaubt, es erhielt auch nur ca. 1% der Patienten im Kontrollarm subsequenziell eine 177Lutetium-PSMA-Behandlung.
Trotz der Kritik am Kontrollarm der VISION-Studie bleibt festzuhalten, dass die 177Lutetium-PSMA-Therapie eine interessante und gut verträgliche neue Option beim CRPC darstellt, die bei zunehmend flächendeckender Verfügbarkeit ihren Weg in die klinische Routine gefunden hat.
PARP-Inhibitoren
In der CRPC-Therapie gewinnen molekular zielgerichtete Strategien zunehmend an Bedeutung. Defekte in DNA-Reparaturgenen kommen bei ca. 20 bis 30% der Patienten mit fortgeschrittenem Prostatakarzinom vor und bilden ein biologisches Rational für eine Therapie mit PARP (Poly(ADP-Ribose)-Polymerasen-Inhibitoren.
Die Phase-III-Studie PROFOUND18 randomisierte Patienten mit Vorliegen von mindestens einer Alteration in einem DNA- Reparaturgen und Progress nach Therapie mit einem NHA zu Olaparib oder dem jeweils anderen NHA. Ein Cross-over war erlaubt. Patienten wurden nach Art des genetischen Defektes in zwei Kohorten unterteilt: In Kohorte A wurden nur Patienten mit Mutationen in BRCA1, BRCA2 und ATM eingeschlossen, in Kohorte B Patienten mit allen anderen Alterationen, u.a. in PALB2 und CHEK1/2.
Ein signifikanter Vorteil von Olaparib in Bezug auf das OS konnte nur für Kohorte A gezeigt werden. Somit bleibt festzuhalten, dass primär Patienten mit BRCA-Alterationen für eine PARP-Inhibitor-Therapie qualifizieren. Bei ATM-Mutationen ist die Datenlage weniger klar und für alle anderen Alterationen besteht aktuell weiterhin noch grössere Unsicherheit bzgl. der Wirksamkeit.
Immuncheckpoint-Inhibitoren
Nicht nur für die Anwendung von PARP-Inhibitoren ist eine molekulargenetische Untersuchung beim CRPC wichtig, auch für den Einsatz von Immuncheckpoint-Inhibitoren ist sie von Bedeutung. Zwar erbrachte der Einsatz von Anti-PD-1- («programmed cell death protein 1»)-Antikörpern wie Pembrolizumab als Monotherapie beim mCRPC eher enttäuschende Resultate mit Ansprechraten von nur um 5%.19 Jedoch wurde für Patienten mit einer hohen Mikrosatelliteninstabilität ein lang andauerndes Ansprechen in über 40% der Fälle beschrieben.20
Ausblick
Weitere immuntherapeutische Strategien beim CRPC werden aktuell noch intensiv in Studien untersucht, so z.B. der Einsatz von BiTEs («bi-specific T-cell engagers») und Kombinationstherapien aus Checkpoint-Inhibitoren plus Tyrosinkinaseinhibitoren,21 Chemotherapie oder Radiotherapie.
Inwiefern hierdurch grössere Erfolge erzielt werden können und die Immuntherapie in Zukunft einen höheren Stellenwert auch beim CRPC erlangen wird, bleibt aktuell noch abzuwarten.
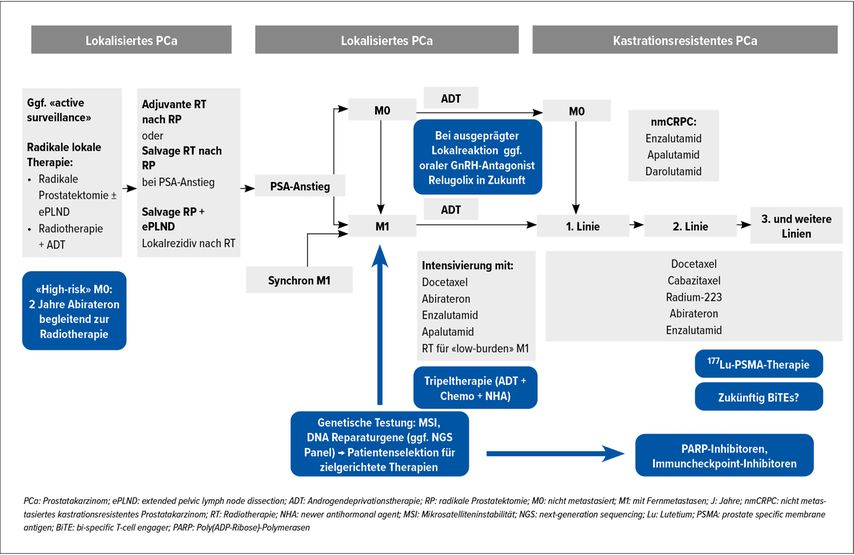
Abb. 2: Übersicht über die Therapielandschaft mit den neueren Entwicklungen (farblich hervorgehoben)
Literatur:
1 Sweeney CJ et al.: Chemohormonal therapy in metastatic hormone-sensitive prostate cancer. N Engl J Med 2015; 373(8): 737-46 2 James ND et al.: Addition of docetaxel, zoledronic acid, or both to first-line long-term hormone therapy in prostate cancer (STAMPEDE): survival results from an adaptive, multiarm, multistage, platform randomised controlled trial. Lancet 2016; 387(10024): 1163-77 3 James ND et al.: Abiraterone for prostate cancer not previously treated with hormone therapy. N Engl J Med 2017; 377(4): 338-51 4 Fizazi K et al.: Abiraterone acetate plus prednisone in patients with newly diagnosed high-risk metastatic castration-sensitive prostate cancer (LATITUDE): final overall survival analysis of a randomised, double-blind, phase 3 trial. Lancet Oncol 2019; 20(5): 686-700 5 Davis ID et al.: Enzalutamide with standard first-line therapy in metastatic prostate cancer. N Engl J Med 2019; 381(2): 121-31 6 Armstrong AJ et al.: ARCHES: a randomized, phase iii study of androgen deprivation therapy with enzalutamide or placebo in men with metastatic hormone-sensitive prostate cancer. J Clin Oncol 2019; 37(32): 2974-86 7 Armstrong AJ et al.: Final overall survival analysis from ARCHES: A phase III, randomized, double-blind, placebo (PBO)-controlled study of enzalutamide (ENZA) + androgen deprivation therapy (ADT) in men with metastatic hormone-sensitive prostate cancer (mHSPC). ESMO 2021; Abstr. #LBA25 8 Chi KN et al.: Apalutamide for metastatic, castration-sensitive prostate cancer. N Engl J Med 2019; 381(1): 13-24 9 Hoyle AP et al.: Abiraterone in “high-” and “low-risk” metastatic hormone-sensitive prostate cancer. Eur Urol 2019; 76(6): 719-28 10 Clarke NW et al.: Addition of docetaxel to hormonal therapy in low- and high-burden metastatic hormone sensitive prostate cancer: long-term survival results from the STAMPEDE trial. Ann Oncol 2019; 30(12): 1992-2003 11 Fizazi K et al.: A phase 3 trial with a 2x2 factorial design in men with de novo metastatic castration-sensitive prostate cancer (mCSPC): overall survival with abiraterone acetate plus prednisone in PEACE-1. ESMO 2021; Abstr. #LBA5_PR 12 Sweeney C et al.: Overall survival (OS) results of a phase III randomized trial of standard-of-care therapy with or without enzalutamide for metastatic hormone-sensitive prostate cancer (mHSPC): ENZAMET (ANZUP 1304), an ANZUP-led international cooperative group trial. J Clin Oncol 2019; 37(18_suppl): LBA2–LBA2 13 Attard G et al.: Abiraterone acetate plus prednisolone (AAP) with or without enzalutamide (ENZ) added to androgen deprivation therapy (ADT) compared to ADT alone for men with high-risk non-metastatic (M0) prostate cancer (PCa): Combined analysis from two comparisons in the STAMPEDE platform protocol. ESMO 2021; Abstr. #LBA4_PR 14 Sartor O et al.: Lutetium-177–PSMA-617 for metastatic castration-resistant prostate cancer. N Engl J Med 2021; 385(12): 1091-103 15 de Wit R et al.: Cabazitaxel versus abiraterone or enzalutamide in metastatic prostate cancer. N Engl J Med 2019; 381(26): 2506-18 16 Khalaf DJ et al.: Optimal sequencing of enzalutamide and abiraterone acetate plus prednisone in metastatic castration-resistant prostate cancer: a multicentre, randomised, open-label, phase 2, crossover trial. Lancet Oncol 2019; 20(12): 1730-9 17 Attard G et al.: Abiraterone alone or in combination with enzalutamide in metastatic castration-resistant prostate cancer with rising prostate-specific antigen during enzalutamide treatment. J Clin Oncol 2018; 36(25): 2639-46 18 Hussain M et al.: Survival with olaparib in metastatic castration-resistant prostate cancer. N Engl J Med 2020; 383(24): 2345-57 19 Antonarakis ES et al.: Pembrolizumab for treatment-refractory metastatic castration-resistant prostate cancer: multicohort, open-label phase II KEYNOTE-199 study. J Clin Oncol 2020; 38(5): 395-405 20 Abida W et al.: Analysis of the prevalence of microsatellite instability in prostate cancer and response to immune checkpoint blockade. JAMA Oncol 2019; 5(4): 471 21 Agarwal N et al. :Cabozantinib (C) in combination with atezolizumab (A) in patients (pts) with metastatic castration-resistant prostate cancer (mCRPC): results of expanded cohort 6 of the COSMIC-021 study. ESMO 2021; Abstr. #LBA24
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...