.jpg)
Viele neue Daten zum multiplen Myelom
Autor:
Univ.-Prof. Dr. Heinz Ludwig
Wilhelminenkrebsforschungsinstitut
c/o 1. Medizinische Abteilung
Zentrum für Onkologie, Hämatologie und Palliativmedizin
Klinik Ottakring, Wien
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Das Meeting der American Society of Hematology (ASH) wurde 2021 als HybridVeranstaltung in Atlanta abgehalten. Obwohl dadurch weniger Teilnehmende vor Ort anzutreffen waren, ist die Zahl der Beiträge zum Thema multiples Myelom weiter gestiegen. Zahlreiche wichtige Erkenntnisse und Daten wurden gewonnen und geteilt. Im Folgenden kann daher nur eine begrenzte Anzahl von subjektiv ausgewählten Themen vorgestellt werden.
Genetische Risikoklassifizierung: FISH oder WGS?
Marietta Truger vom Münchner Leukämielabor (MLL) verglich bei 100 Patienten mit MM FISH(„fluorescent in situ hybdrization“)-Analysen mit „whole genome sequencing“ (WGS).1 Sie fand dabei signifikante Vorteile für WGS, welches in Zukunft als bevorzugte Methode angesehen werden wird, weil im Vergleich zu FISH zusätzliche Veränderungen nachgewiesen werden können. Dazu gehören unter anderem biallelische Veränderungen (z.B. del17p und TP53-Mutation), Rearrangements mit heterogenen Bruchpunkten sowie Rearrangements mit seltenen Translokationspartnern, der Nachweis komplexer genetischer Veränderungen und die Detektion von „targetable“ Läsionen wie z.B. BRAFV600E-Mutationen oder der biallelische Verlust von 16p, welcher auch mit dem Verlust der therapeutischen Zielstruktur „B-cell maturation antigen“ (BCMA) verbunden ist.
Die FISH ist bei Patienten mit geringer Knochenmark-Plasmazellinfiltration (<10%) sowie beim Nachweis von kleinen (<15%) Subklonen und der Identifizierung von hyperploiden Chromosomensätzen allerdings dem WGS überlegen.
Covid-19-Impfungen bei MM-Patienten weniger wirksam
Nathanael Fillmore berichtete über die stark reduzierte Effizienz von Covid-19-Impfungen zur Verhinderung von labormäßig bestätigten Durchbruchinfektionen bei Patienten mit MM.2 Nach einer Impfdosis fand sich eine geringe Effizienz (9,7%), die durch eine weitere Dosis auf 12,8% angehoben wurde, aber noch immer weit unter der bei Normalpersonen beobachteten Effizienz von 58% angesiedelt ist. Daten über die Effizienz von drei Impfungen liegen noch nicht vor. Im Gegensatz dazu ist die Impfstoffeffizienz bei Patienten mit monoklonaler Gammopathie unklarer Signifikanz (MGUS) deutlich höher, liegt aber dennoch unter jener der Normalbevölkerung. Durchbruchsinfektionen wurden häufiger bei Patienten, die mit Daratumumab-basierter Therapie (9,1%) oder mit Proteasominhibitoren (6,5%) behandelt wurden, beobachtet.
Neues bei Patienten, die für eine Transplantation geeignet sind
Isatuximab-VRd ist VRd überlegen
Die wichtigste diesbezügliche Studie wurde von Hartmut Goldschmidt präsentiert, der über die Ergebnisse des Vergleichs von Isatuximab-VRd mit VRd (Bortezomib, Lenalidomid, Dexamethason) alleine berichtete.3 Als primäres Studienziel wurde die MRDneg-Rate (Minimale- Resterkrankung-negativ-Rate) nach der Induktion, die aus drei Zyklen VRd mit oder ohne Isatuximab bestand, definiert.3 Nach erfolgter Transplantation wurden die Patienten in eine Erhaltungstherapie mit Lenalidomid mit oder ohne Isatuximab randomisiert.
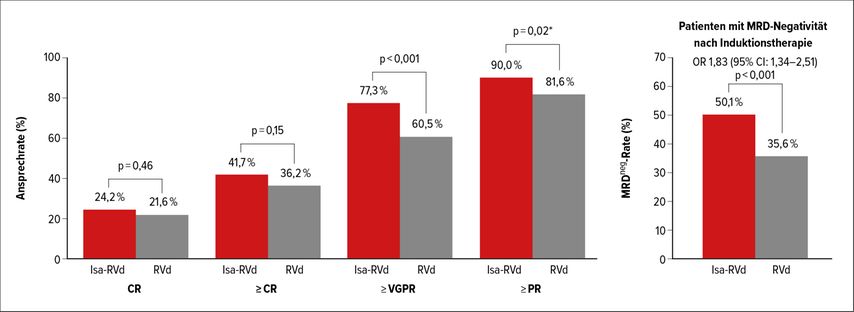
Die Ergebnisse zeigten eine signifikante Überlegenheit der Antikörper-VRd-Kombination im Vergleich zu VRd alleine. Nach Beendigung der Induktionstherapie lag die MRDneg-Rate im experimentellen Therapiearm bei 50,1% im Vergleich zu 35,6% in der Kontrollgruppe (Abb. 1). Der Vorteil der Kombinationstherapie wurde auch bei Patienten mit zytogenetischen Risikofaktoren beobachtet. Grad-3/4 -Nebenwirkungen waren mit Ausnahme einer höheren Frequenz von Leukopenie und Neutropenie mit jenen unter VRd vergleichbar. Isatuximab-bedingte Grad-3/4-Infusionsreaktionen wurden bei 1,3% der Patienten beobachtet.
Abb. 1: Ansprechraten und MRDneg-Rate nach 3 Zyklen Induktionstherapie mit VRd mit und ohne Isatuximab. (Modifiziert nach Goldschmidt et al.)3
Phase-II-Studie zu Ixazomib-Rd
Aurore Perrot berichtete über die Ergebnisse der IFM-2018-01-Studie, in der Ixazomib-Rd als Induktion und Konsolidierungsbehandlung gefolgt von Lenalidomid-Erhaltungstherapie bei Standardrisikopatienten überprüft wurde.4 In diese Phase-II-Studie wurden 45 Patienten einbezogen. Nach sechs Zyklen Induktion wurden die Patienten transplantiert; danach erhielten sie vier Konsolidierungszyklen gefolgt von einer Lenalidomid-Erhaltungstherapie.
Im Laufe der Behandlung kam es erwartungsgemäß zu einer Verbesserung der Ansprechtiefe. Nach einem Jahr Erhaltungstherapie lag die sCR(„stringent complete response“)-Rate bei 54% und die Rate an ≥VGPR(„very good partial remission“) bei 92,8%. Ein MRDneg-Status wurde bei 39,5% (10–6) bzw. 51,4% (10–5) beobachtet. Die Rate des progressionsfreien Überlebens (PFS) lag nach 2 Jahren bei 93,3%, zu diesem Zeitpunkt waren alle Patienten am Leben. Insgesamt ist diese Therapiekombination sehr gut verträglich, die MRDneg-Rate liegt aber deutlich unter den mit Dara-VRd und Dara-KRd erzielten Ergebnissen.
OPTIMUM-Studie bei Patienten mit „Ultra high risk“-MM
Martin Kaiser präsentierte die OPTIMUM-Studie bei Patienten mit „Ultrahigh risk“-MM.5 Die Ergebnisse dieser Phase-II-Studie wurden mit einer sogenannten digitalisierten Vergleichsgruppe, welche aus Patienten bestand, die zuvor in der MYELOMA-XI-Studie behandelt wurden, verglichen. Zur Definition von „ultra high risk“ wurden sowohl Genexpressionsdaten (SKY 95) als auch FISH-Daten herangezogen.
Die Patienten im explorativen Arm erhielten als Induktion sechs Zyklen Daratumumab(Dara)-CyclophosphamidVRd, danach erhielten sie eine Transplantation gefolgt von einer Konsolidierung mit sechs Zyklen Dara-VRd, gefolgt von zwölf Zyklen Dara-VR. Als Erhaltungstherapie wurden Daratumumab und Lenalidomid verabreicht. Die als Vergleichsgruppe herangezogenen „gematchten“ Patienten aus der MYELOMA-XI-Studie erhielten als Induktionstherapie entweder K(Carfilzomib)CRd oder CRd. Danach erfolgte eine Transplantation gefolgt von einer Revlimid-Erhaltungstherapie.
Im Vergleich zur digitalisierten Kontrollgruppe konnte mit der intensiven und längeren Therapie in der OPTIMUM-Studie ein signifikant längeres PFS erreicht werden. Nach der Induktionstherapie lag die MRDneg-Rate bei 41% und nach der Transplantation bei 64%. Unter Dara-KCRd wurden signifikant häufiger Grad- 3/4-Thrombopenie (18,3% vs. 7,4%) und gastrointestinale Toxizität (15,7% vs. 2,4%) beobachtet.
MRD-Ergebnisse von CASSIOPEIA
Weiters wurden Updates der wichtigen Phase-III-Studien CASSIOPEIA und GRIFFIN sowie der Phase-II-Studien präsentiert. Hervé Avet-Loiseau berichtete über die MRD-Ergebnisse der erstgenannten Studie.6 Bemerkenswert sind die deutlich höheren MRDneg-Raten mit Dara-V(Bortezomib)-T(Thalidomid)-d vs. VTd, wobei der Unterschied mit der Therapiedauer zunehmend größer wurde (nach Induktion: 9,2 vs. 5,4%, nach Konsolidierung: 33,7% vs. 19,9%). Patienten mit lange andauerndem MRDneg-Status wiesen den größten PFS-Vorteil auf. Von besonderem Interesse ist auch das kürzere PFS bei initial MRDpos-Patienten, die unter weiterer Therapie MRDneg wurden, im Vergleich zu bereits initial MRDneg Patienten (HR: 0,55; CI: 0,35–0,78). Dies bedeutet, dass die Erkrankung bei Patienten, die erst durch prolongierte Behandlung bzw. Behandlungsintensivierung ein tiefes Ansprechen erreichen, a priori ungünstiger verläuft.
VRd ± Darawährend Induktion und Konsolidierung gefolgt von R-Erhaltungstherapie +/- Dara
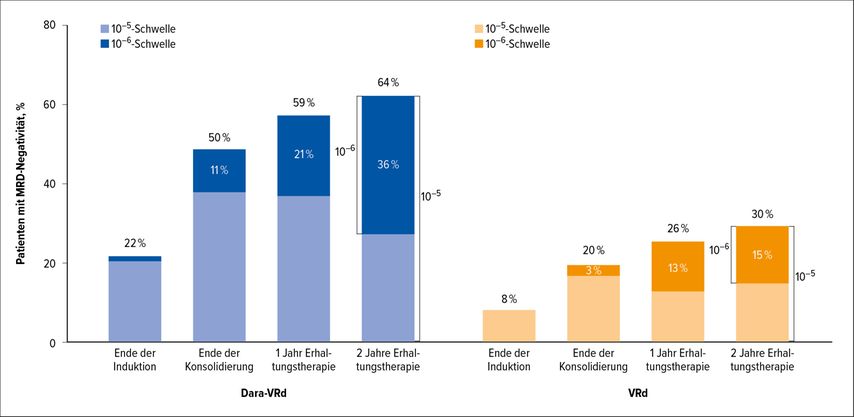
In der GRIFFIN-Studie wurden 207 Patienten randomisiert und mit VRd ± Daratumumab in der Induktion und Konsolidierung nach der autologen Stammzelltransplantation (ASCT) behandelt. Angeschlossen wurden 25 Zyklen Dara-R oder R-Erhaltungstherapie. Jacob Laubach berichtete über die eindeutige Überlegenheit der CD38-VRd-Kombination verglichen mit VRd alleine.7 Nach Beendigung der Erhaltungstherapie wurde eine Verdoppelung der MRDneg-Rate von 30% auf 64% beobachtet (Abb. 2). Der Erfolg der Daratumumab-Kombination war bei SD(stabile Erkrankung)-Risikopatienten besonders ausgeprägt (HR: 6,47; CI: 2,87–14,60), aber auch bei Hochrisikopatienten (HR: 2,52, CI: 1,01–6,32) zu beobachten. Die PFS-Rate lag nach drei Jahren in der Dara-VRdGruppe bei 88,9% und in der VRd-Gruppe bei 81,2% (HR: 0,46, CI: 0,21–1,01). Es wird wohl eine längere Nachbeobachtungszeit als die derzeit 38,6 Monate erforderlich sein, um, wenn überhaupt, eine Verlängerung des Gesamtüberlebens (OS) durch die Zugabe des CD38-Antikörpers nachweisen zu können.
Abb. 2: GRIFFIN-Studie. MRDneg-Rate im Verlauf der Induktions- und Konsolidierungsbehandlung mit Dara-VRd oder VRd, gefolgt von Daratumumab-Lenalidomid oder Lenalidomid-Erhaltungstherapie (25 Zyklen). (Modifiziert nach Laubach et al.)7
MRD-adaptierte Therapiestrategie inder MASTER-Studie
In der MASTER-Studie wurde eine MRD-adaptierte Therapiestrategie verfolgt, wobei die Behandlung nach Erreichen eines MRDneg-Status beendet wurde.8 Die MRD-Bestimmung erfolgte nach der Induktion mit Dara-KRd, nach der angeschlossenen ASCT sowie nach der Konsolidierung mit Dara-KRd. In dem beim ASH-Kongress vorgestellten Update zeigten sich keine Unterschiede in den MRD(10–5)-Raten zwischen Patienten mit Standard-, Hoch- und ultrahohem Risiko (≥2 Hochrisiko-Befunde). Bei Zugrundenahme eines höheren Cut-Offs (10–6) zeigte sich allerdings bei den Patienten mit ≥2 zytogenetischen Risikofaktoren eine niedrigere MRDneg-Rate. Außerdem wurde bei diesen Patienten ein kürzeres PFS und trendweise auch ein kürzeres OS beobachtet.
Erstlinientherapie bei Patienten, die nicht für eine Transplantation geeignet sind
Hier gab es nur Updates. Bemerkenswert sind die Ergebnisse der MAIA-Studie, in der bekanntlich Dara-Rd gegen Rd alleine verglichen wurde. Nach einem sehr langen Follow-up von 56,2 Monaten zeigt sich die deutliche Überlegenheit der Dara-Rd-Therapie mit einer 5-Jahres-OS-Rate von 66% im Vergleich zu 53,1% mit Rd alleine (HR:0,68, p=0,0013).9 Diese Ergebnisse, ergänzt mit den bereits früher publizierten Daten der ALCYONE-Studie (Dara-VMP vs. VMP), machen deutlich, dass eine antikörperbasierte Therapie in der Erstlinienbehandlung allen anderen Konzepten überlegen ist und mittlerweile als Standardtherapie anzusehen ist.
Neues in der Behandlung von Patienten mit rrMM
Iberdomid
Sagar Lonial präsentierte interessante Ergebnisse einer Dosisexpansions-Studie, wobei im Phase-II-Teil der Studie zwei Kohorten mit Iberdomid (1,6mg oral, täglich, Tag 1–21) und Dexamethason behandelt wurden.10 Die erste Kohorte inkludierte 107 Patienten mit einer medianen Anzahl von sechs Vortherapien und die zweite Kohorte Patienten mit rrMM und 3 oder mehr Vortherapien, die zuvor auch eine Behandlung mit BCMA-abgezielter Therapie erhalten hatten. 97,2% der ersten und 80% der zweiten Gruppe waren „triple class“ refraktär.
Die Gesamtansprechrate lag bei 26,2% in der ersten bzw. bei 25% in der zweiten Gruppe, analog dazu fand sich eine Krankheitskontrollrate bei 79,4% bzw. 75% der Patienten. Das relativ kurze PFS und OS von 3 bzw. 10,7 Monaten der ersten Gruppe muss wohl im Lichte der ungünstigen Prognose (25% extramedulläre Manifestationen) interpretiert werden. Die Therapietoleranz war zufriedenstellend, die häufigsten Vorkommnisse von Grad-3/4-Toxizität betrafen hämatologische Parameter und Infektionen (27,1%).
Belantamab-Mafodotin
Eine frühere Phase-II-Studie mit Belantamab-Monotherapie bei umfangreich vorbehandelten Patienten (≥3 Vortherapien) ergab eine Ansprechrate von 32% und eine mediane Dauer des Ansprechens von 11 Monaten bei einem Gesamtüberleben von 13,7 Monaten. Ein wesentliches Problem der Therapie mit Belantamab besteht in der Augentoxizität, welche vorwiegend auf Mikrokristallbildung in der Cornea zurückzuführen ist. Allerdings kann diese Nebenwirkung durch Dosisadaption bzw. Veränderung des Therapieintervalls zufriedenstellend gemanagt werden.
Natalie Callander stellte Belantamab in Kombination mit Relatlimab (einem monoklonalen Antikörper, welcher als T-Zell-Kostimulator fungiert) bei Patienten mit rrMM vor.11 Relatlimab aktiviert T-Zellen und deren Interaktion mit Antikörper-präsentierenden Zellen, was im Endeffekt zu einer verstärkten Effektor-T-Zellen-Aktivität führt. Mit dieser Kombination konnte bei einer kleinen Patientenkohorte von 25 Patienten eine Ansprechrate von 82% erreicht werden, wobei 57% der Responder eine ≥VGPR erzielten.
Bispezifische Antikörper
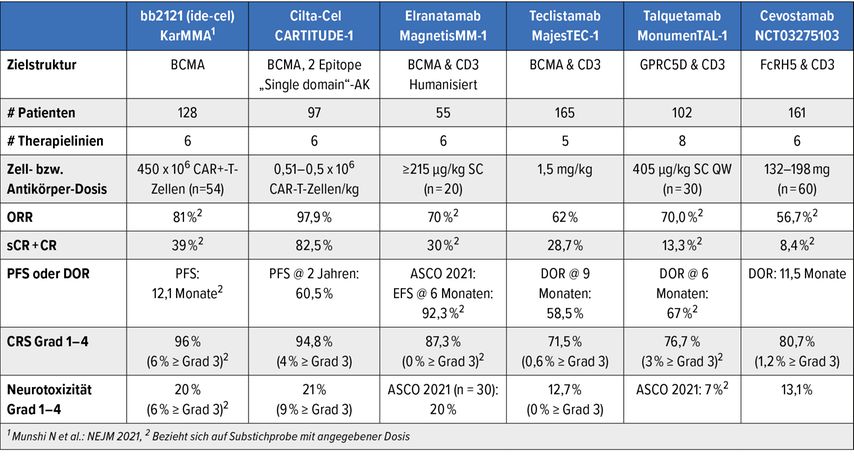
Großes Interesse gilt den Ergebnissen, die mit bispezifischen T-Zell-„Engagers“ (BiTEs) erreicht werden können (Tab. 1). Diese BiTEs lenken T-Zellen zu spezifischen Zellmembranstrukturen, wodurch diese aktiviert werden und ihre zytolytische Wirkung entfalten können. Teclistamab z.B. bindet BCMA und CD3 und bewirkt hohe Ansprechraten (Gesamtansprechrate, ORR=62%) als Monotherapie. Dies ist auch für die österreichische Therapieszene relevant, da diese Substanz in Kürze im Rahmen eines „named patient programs“ zur Verfügung stehen sollte.
Tab. 1: Vergleich der mit CAR-T-Zellen und BiTEs erzielten Behandlungsergebnisse. Bei mehreren Substichproben mit verschiedenen Dosisverabreichungen wird diejenige mit dem besseren Behandlungserfolg angegeben
Talquetamab bindet GPRC5D/CD3 („G-protein-coupled receptor family C group 5 member D“), was die Möglichkeit eines Einsatzes nach Vortherapie mit BCMA-gerichteter Behandlung (BiTEs bzw. chimerische Antigen-Rezeptor[CAR]-T-Zellen) sowie einer Kombination mit BCMA-BiTEs eröffnet. In einer Phase-I/II-Studie (MonumenTAL-1) wurde in der niedrigeren Dosierung (405μg/kg) eine Ansprechrate von 70,0% (≥VGPR: 53,3%) erzielt.12 Cevostamab bindet an FcRH5 und CD3, was ebenfalls die oben beschriebenen Vorteile birgt, und zeigte in ersten Phase-II-Studien eine Ansprechrate von 56,7%. Ein Problem der BiTEs liegt im Nebenwirkungsspektrum. So kann es zum Zytokinfreisetzungssyndrom (CRS) sowie zu spezieller Neurotoxizität kommen. Das CRS lässt sich mit Anti-Interleukin-6-Medikation (Tocilizumab) relativ erfolgreich mitigieren. Bei der Neurotoxizität handelt es sich vorwiegend um Grad-1- und Grad-2-Toxizität; schwere Ausprägungen wurden nur in Einzelfällen beobachtet.
CAR-T-Zellen
Ein Update der CARTITUDE-1-Studie bestätigte die hervorragende Wirkung des CAR-T-Zell-Produkts Ciltacabtagene autoleucel (Cilta-cel), dessen Rezeptor aus zwei gegen BCMA gerichteten „Single-domain“- Antikörpern besteht.13 Die vorgestellten Ergebnisse beruhen auf 97 Patienten mit einer medianen Anzahl von sechs Vortherapien. Nach der Verabreichung der Therapie konnten eine Gesamtansprechrate von 97,9% und eine sCR-Rate von 82,5% erzielt werden. Die PFS-Rate liegt nach 2 Jahren bei 60,5% und die OS-Rate bei 74,0%. Bei Patienten mit einem ≥12 Monate persistierenden MRDneg-Status wurden eine 2-Jahres-PFS-Rate und OS-Rate von jeweils 100% beobachtet. Aufgrund dieser Befunde werden CAR-T-Zell-Therapien derzeit in anderen Indikationen wie z.B. bei Patienten mit Amyloidose, in früheren Therapielinien inklusive Erstlinientherapie, aber auch als einmalige Erhaltungstherapie im Vergleich zu einer kontinuierlichen Rd-Erhaltungstherapie und zum Teil im tagesklinischen Setting evaluiert.
Für das zweite CAR-T-Zell-Produkt Idecabtagene vicleucel (ide-cel, bb2121), welches in den USA bereitszugelassen ist, wurden prognostische Faktoren für das Erreichen einer CR von Nina Shah vorgestellt.14 Bekanntlich haben frühere Auswertungen eine CR/sCR-Rate von 33%, eine mediane Ansprechdauer von 21,5 Monaten und ein OS von 24,8 Monaten bei Patienten mit ≥4 Vortherapielinien ergeben. In der aktuellen Präsentation konnten folgende Faktoren identifiziert werden, die mit einem sehr guten Ansprechen (CR/sCR) korrelieren:
-
Anzahl von Vektorkopien in den CAR-T- Zellen,
-
zirkulierendes BCMA,
-
IgG-Subtyp und
-
die „international normalized ratio“ (INR).
Die größte Wahrscheinlichkeit für ein tiefes Ansprechen fand sich bei Patienten mit niedriger Tumorlast und geringen sBCMA-Konzentrationen.
Ein wichtiges Thema ist die Persistenz von CAR-T-Zellen. Eine chinesische Gruppe hat CAR-T-Zellen mit einem humanen BCMA-Rezeptor hergestellt, um damit allfällige Immunreaktionen gegen das Konstrukt zu reduzieren und somit die Halbwertszeit zu verlängern.15 Tatsächlich konnten nach 6 Monaten noch bei 88,5% der Patienten zirkulierende CAR-T-Zellen nachgewiesen werden. Eine ähnlich lange Persistenz wurde allerdings auch mit dem Ide-cel(bb2121)-Präparat erzielt, unter welchem nach 6 Monaten ebenfalls bei 81% und nach 12 Monaten bei 60% der Patienten CAR-T-Zellen detektiert werden konnten. Andere Versuche zielen darauf ab, die Expression von BCMA auf Myelomzellen zu erhöhen. Nach dreimaliger oraler Verabreichung eines Gamma-Sekretase-Inhibitors konnte die BCMA-Rezeptordichte auf Myelomzellen im Median um das 12-fache erhöht werden. Inwieweit dies die Wirksamkeit der Anti-BCMA-CAR-T-Zell-Therapie beeinflusst, muss allerdings noch überprüft werden.
Hoffnungsträger CAEL-101-Antikörper bei Amyloidose
Die bisherigen Bemühungen, die Amyloid-Ablagerungen mittels des monoklonalen Antikörpers (im Speziellen mit NEOD001) aufzulösen, gingen bisher nicht auf. Nun gibt es einen weiteren Hoffnungsträger, nämlich den Antikörper CAEL-101, der an ein Neoepitop, welches bei der Aggregation der Leichtketten entsteht, bindet und die Aggregate möglicherweise auflöst.
Dieser Antikörper wurde in Kombination mit der Standard-Amyloidose-Therapie (CyBorD oder Dara-CyBorD) eingesetzt.16 Nach einer im Median ein Jahr dauernden Behandlung konnte bei 7 von 20 Patienten ein kardiales Ansprechen und bei 8 von 9 Patienten ein Nierenansprechen beobachtet werden. Somit besteht die Hoffnung, dass mit diesem Antikörper die Auflösung von Amyloid-Depots verbessert werden kann.
Kurz gesagt …
Der ASH-Kongress 2021 setzt eindrucksvoll den Siegeszugimmunbasierter Therapien fort. Monoklonale CD38-Antikörper haben sich als Standard in der Erstlinientherapie etabliert. BiTEs und zelluläre Therapien führen zu beachtlichen Erfolgen bei vorbehandelten Patienten und werden nun in früheren Behandlungslinien geprüft, wo sie wahrscheinlich in Kürze als wertvolle Kombinationspartner oder sogar als Monotherapie etabliert werden dürften.
Literatur:
1 Truger M et al.: ASH 2021; Abstr. #397 2 Fillmore N et al.: ASH 2021; Abstr. #400 3 Goldschmidt H et al.: ASH 2021; Abstr. #463 4 Perrot A et al.: ASH 2021; Abstr. #464 5 Kaiser M et al.: ASH 2021; Abstr. #465 6 Avet-Loiseau H et al.: ASH 2021; Abstr. #82 7 Laubach J et al.: ASH 2021; Abstr. #79 8 Costa L et al.: ASH 2021; Abstr. #481 9 Fonseca R et al.: ASH 2021; Abstr. #118 10 Lonial S et al.: ASH 2021; Abstr. #162 11 Callander N et al.: ASH 2021; Abstr. #897 12 Krishnan A et al.: ASH 2021; Abstr. #158 13 Martin T et al.: ASH 2021; Abstr. #549 14 Shah N et al.: ASH 2021; Abstr. #1739 15 Li C et al.: ASH 2021; Abstr. #547 16 Valent J et al.: ASH 2021; Abstr. #2724
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...