Update zur postoperativen Strahlentherapie beim Mammakarzinom
Autoren:
Prof. Dr. med. Gabriela Studer
Chefärztin Radio-Onkologie LUKS Luzern und Radio-Onkologie am Zuger Kantonsspital
Luzerner Kantonsspital
Prof. Dr. med. Christoph Glanzmann
Konsiliararzt, Radio-Onkologie LUKS
und Radio-Onkologie am Zuger Kantonsspital
Luzerner Kantonsspital
Korrespondenz:
E-Mail: gabriela.studer@luks.ch
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die postoperative Bestrahlung (pRT) mit oder ohne Lymphabflusswege (LAW) nach brusterhaltender Operation oder gegebenfalls nach Mastektomie ist ein langjähriger Standard in der Therapie des Mammakarzinoms, unter anderem mit einer positiven Auswirkung auf das Gesamtüberleben (OS). Im Folgenden soll ein Überblick über den aktuellen Stand der Behandlung gegeben werden.
Keypoints
Basierend auf den Erkenntnissen prospektiv-randomisierter Studien mit 5 bis >10 Jahren Verlaufsbeobachtungszeit können folgende Fakten festgehalten werden:
-
Für sorgfältig selektierte Patientinnen mit Tumoren in Frühstadien ist die stark hypofraktionierte Teilbrustbestrahlung (z.B. 26Gy appliziert in 5 Fraktionen in einer Woche) möglich/indiziert – die Resultate sind vergleichbar mit denen nach WBRT.
-
Bei fortgeschritteneren Stadien ohne Indikation für eine Lymphabflussbestrahlung erzielt die Ganzbrust-RT gemäss der FAST-FORWARD-Studie mit 5 Fraktionen appliziert in einer Woche (UK-Standard) die gleichen Resultate wie nach bislang geltendem Standard mit 40Gy in 15 Fraktionen +/– Boost (START-B-Studie).
-
Bei gegebener Indikation für eine zusätzliche Lymphabflussbestrahlung ist das Vorgehen gemäss der START-B-Studie mit 15 Fraktionen appliziert in 3 Wochen indiziert (Standard in UK/CA/USA) – bei gegebener Indikation ist eine integrierte Boostbestrahlung möglich/indiziert.
Über die vergangenen zwei bis drei Jahrzehnte konnten die Tumorkontrollraten von Brustkrebspatientinnen zunehmend verbessert werden. Diese Entwicklung ist Fortschritten in der System- und operativen Therapie bzw. den diagnostischen Disziplinen zu verdanken, die unter anderem zu verbesserten Indikationsstellungen, Dosierungen und Kombinationsbehandlungen geführt haben.
Neue Diagnostik und Kenntnisse der Tumorausbreitung ermöglichen eine genauere Abgrenzung der Zielgewebe. Mit neuen Bestrahlungstechniken kann selbst bei beweglichen Zielen sehr genau und fokussiert bestrahlt werden, das heisst mit geringerer Belastung der gesunden Nachbargewebe. Zusammen mit Fortschritten in der klinischen Radiobiologie wurde in den letzten Jahren auch die Bestrahlungsdosierung differenzierter/tumorspezifischer und damit effektiver und verträglicher.
Der Benefit der pRT ist die Reduktion der lokoregionären Rezidivrate auf circa ein Drittel und je nach Risikosituation auch eine nachweisbare Verlängerung des Gesamtüberlebens (OS).1 Bei sehr vielen befallenen Lymphknoten (LK) in Kombination mit sonstigen das Fernmetastasenrisiko erhöhenden Faktoren wird zwar eine ausgeprägte Reduktion des absoluten lokoregionären Risikos erzielt, die Verlängerung des OS ist jedoch geringer. Bei wenigen befallenen LK und geringem Fernmetastasenrisiko ist die Reduktion des absoluten Risikos lokoregional geringer, der positive Effekt auf das OS jedoch relativ grösser.
Fraktionierungsarten der Strahlentherapie
Die pRT der Brust/Brustwand kann standard- oder hypofraktioniert werden.
Standardfraktionierung:
Einzeldosen von etwa 1,80–2,0Gy/Tag (appliziert innerhalb weniger Minuten) an 5 Tagen/Woche. Kurative Gesamtdosen beinhalten ca. 30–40 Fraktionen, appliziert in ca. 6–8 Wochen.
Hypofraktionierung:
>2,4Gy/Fraktion/Tag, meist an 5 Tagen/Woche, bei starken Hypofraktionierungen (hRT) auch an nur ca. 2–3 Tagen/Woche; Gesamtdauer ca. 1–4 Wochen, abhängig von der Gesamtdosis – jedenfalls so, dass der ungünstige Einfluss des Zeitfaktors auf die Tumorkontrolle stark reduziert bis eliminiert wird.
Die meist tumoreffektivere Hypofraktionierung wurde durch die innovative modulierte Bestrahlungstechnik (intensitätsmodulierte Radiotherapie [IMRT], «volumetric intensity modulated arc therapy» [VMAT], «stereotacitc body radiation therapy» [SBRT], «radiosurgery» [RS]) zusammen mit der verbesserten Diagnostik und Präzision einer bildgesteuerten Zielerfassung ermöglicht. Damit wird eine weitgehende Limitierung der Herddosis auf den Herd mit steilem Dosisabfall in Bezug auf die gesunde Umgebung erreicht.
Die hohe Effektivität der Hypofraktionierung im Tumorgewebe (hohe Einzeldosis, kürzere Gesamtbehandlungszeit mit Reduktion bis Vermeidung einer akzelerierten Repopulation von Tumorstammzellen) macht eine niedrigere Gesamtdosis ausreichend. Mit dem steilen Dosisabfall in das gesunde Nachbargewebe und der geringeren Gesamtdosis wird der Nachteil zu hoher Einzeldosen im gesunden Gewebe vermieden.2
Zudem sind auch die Kenntnisse über die Fraktionierungsempfindlichkeit verschiedener Gewebe und Zellen gewachsen. Jahrzehntelange Erfahrungen mit Hypofraktionierung (Kohorten-, Serien-, prospektiv-randomisierte Studien mit Einschluss mehrerer tausend Patientinnen und Langzeitbeobachtungen ≥10 Jahre) zeigten in den untersuchten Indikationen zumindest eine gleiche Effektivität und Toleranz wie bei der Standardfraktionierung.3
Mit den neuen Techniken konnten die Indikationen für eine hypofraktionierte RT stark ausgeweitet werden. Viele kurative Bestrahlungen konnten dadurch von ca. 30–40 Fraktionen innert 6 Wochen auf etwa 5–20 Fraktionen innerhalb von 1–4 Wochen verkürzt werden.
Bedeutung dieser Entwicklungen für die Konzepte zur Bestrahlung der Brust
Ganzbrust-RT (WBRT)
In der postoperativen RT der Thoraxwand oder nach Tumorexzision bei Mammakarzinom wurde die Hypofraktionierung Jahrzehnte vor den bekannten englischen START-Trials4 in einigen Zentren als Standard eingesetzt.5 Es entwickelte sich eine Kontroverse zwischen Vertretern unterschiedlich hoher Einzeldosen.
Zunehmende Beobachtungen von Spätveränderungen gesunder Gewebe Monate bis Jahre nach Bestrahlung, wachsende Erkenntnisse zu Dosis-Wirkungs-Beziehungen, wie der höheren Fraktionierungsempfindlichkeit vieler gesunder und spät reagierender Gewebe, und die seinerzeit beschränkte Möglichkeit zur Fokussierung tumorizider Dosen auf den Tumorherd etablierten niedrige Einzeldosen um 1,8–2,0Gy 5x/Woche als meisteingesetzten Standard («Standardfraktionierung»).
Einzelne Zentren erkannten im Rahmen der Praxisvariation, dass man bei ausreichender Reduktion der Gesamtdosis auch mit höheren Einzeldosen bei etlichen Indikationen vergleichbare Ergebnisse erzielen konnte – so auch bei Brustkrebs.
Retrospektiv wurde auch erkannt, dass es bei Hypofraktionierung mit hohen Raten an Spättoxizität falsch war, davon auszugehen, dass bei gleicher Dosis/Woche (z.B. 3F/Woche oder 2F/Woche etc.) die gleiche Gesamtdosis wie bei Standardfraktionierung appliziert werden kann und dass das Volumen hoher belasteter Normalgewebe nicht so gering wie möglich gehalten werden muss.
Die 5- und 10-Jahres-Resultate der START-Trials (publiziert 2008 und 2013)4 führten aufgrund der überlegenen Resultate des START-B-Trials zum neuen Standard der postoperativen Ganzbrust-RT: 40Gy appliziert in 15 Fraktionen in 3 Wochen («milde» Hypofraktionierung [mhRT]). Die Akzeptanz dieses Regimes war v.a. im deutschsprachigen Raum bis vor Kurzem sehr limitiert. Mittlerweile sind die Daten jedoch nicht mehr zu ignorieren, das unterlegene normofraktionierte Schema mit 50Gy in 25 Fraktionen gilt mittlerweile, zehn Jahre nach Publikation der Zehn-Jahres-Resultate, als obsolet.
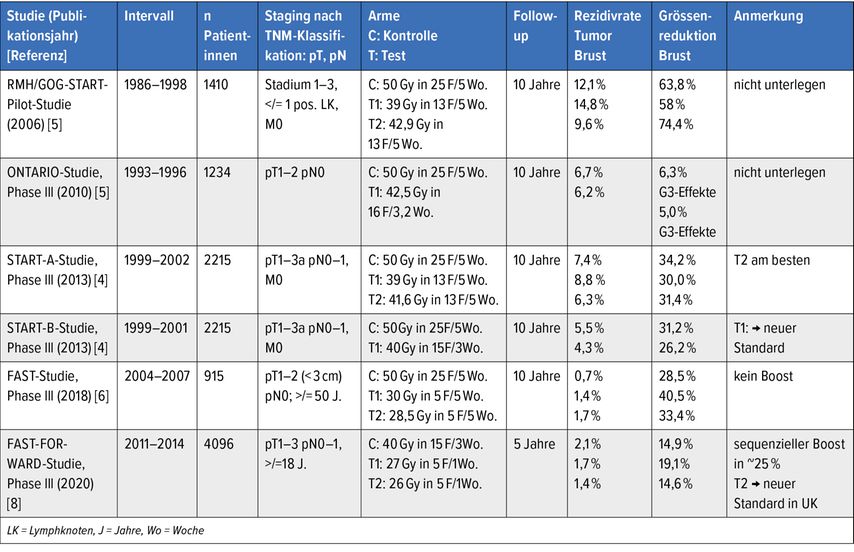
2018 bzw. 2020 folgten die Publikationen der englischen prospektiv randomisierten Protokolle der FAST- bzw. FAST-FORWARD-Studien: ultra-hypofraktionierte Ganzbrust-RT (uhWBRT) mit 5 Fraktionen appliziert in einer Woche.6–8 Die FAST-FORWARD-Studie inkludierte >4000 Patientinnen über einen Zeitraum von ca. 2,5 Jahren (2011–2014) (Tab. 1).
2015 wurde zusätzlich die Mitbestrahlung der LAW in dieses Protokoll inkludiert und ab 2017 auf Patientinnen mit Indikation für LAW beschränkt. Die Resultate sind noch ausstehend, bislang gibt es keine Negativberichte. Die Akzeptanz dieses 5F-uhWBRT-Protokolls ist wiederum im deutschsprachigen Raum äusserst limitiert, in Grossbritannien schon Standard,9 in Kanada und den USA akzeptiert und im Einsatz.
uhRT der Teilbrust
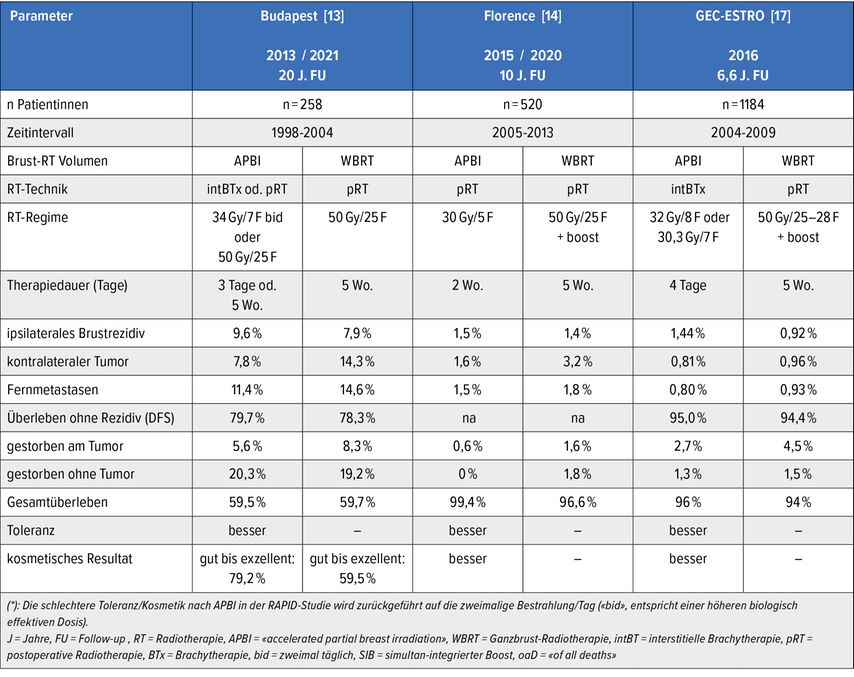
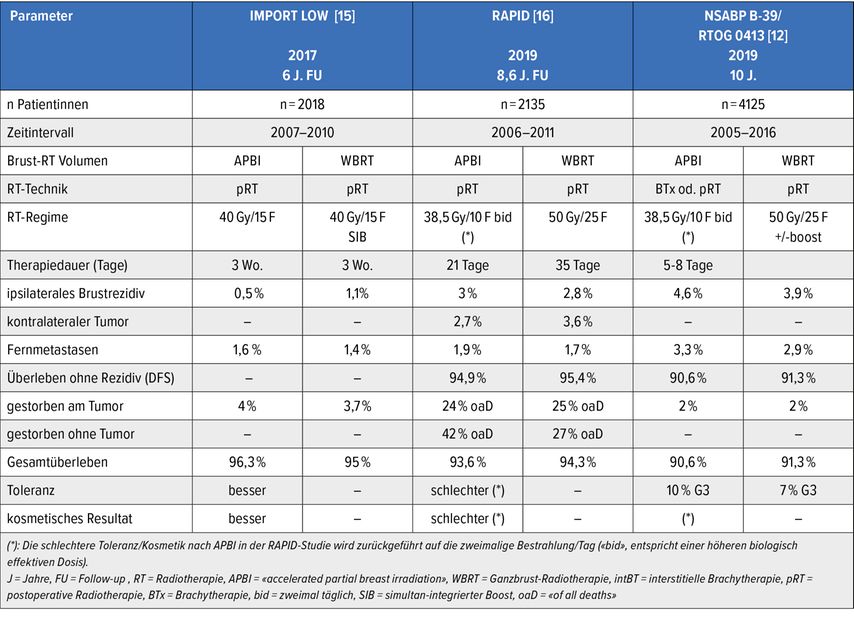
Bislang sind Daten von sechs prospektiv randomisierten Studien mit einer Verlaufsbeobachtung von >/= 5 Jahren publiziert,die die akzelerierte Teilbrust- mit der normofraktionierten Ganzbrust-RT verglichen haben (Tab. 2).10–17 Es zeigte sich bei tiefen absoluten Rezidivraten eine ca. 1% geringere Tumorkontrollrate in der betroffenen Brust, bei jedoch teils etwas höherem Gesamtüberleben für die APBI(«accelerated partial breast irradiation»)-Tests. Die Therapietoleranz sowie die kosmetischen Resultate sind nach APBI überlegen.
Zur NSABP-B-39-Studie ist anzumerken, dass hier deutlich fortgeschrittenere Stadien zugelassen waren als in den internationalen Consensus-Guidelines empfohlen, was die Unterlegenheit des APBI-Tests in dieser Studie erklären dürfte (so zum Beispiel multifokale Tumoren, alle Histologien, bis zu drei positive Lymphknoten oder sehr junges Alter >18 J.)].9,12
Tab. 2: Sechs prospektive randomisierte Studien mit mind. fünf Jahren Verlaufsbeobachtung, die APBI («accelerated partial breast irradiation») mit GBRT (Ganzbrust-Radiotherapie) 50Gy +/– Boost vergleichen
Tab. 2: (Fortsetzung): Sechs prospektive randomisierte Studien mit mind. fünf Jahren Verlaufsbeobachtung, die APBI («accelerated partial breast irradiation») mit GBRT (Ganzbrust-Radiotherapie) 50Gy +/- Boost vergleichen
Dennoch ist die Akzeptanz im deutschsprachigen Raum seit Jahren äusserst limitiert, trotz Consensus-Statements grosser Fachgesellschaften im Jahr 2016.10,18
Vorteile der Hypofraktionierung
Die strahlenbiologisch hohe bzw. höhere Effektivität der Hypofraktionierung im Tumorgewebe macht wie erwähnt eine niedrigere Gesamtdosis ausreichend – die so reduzierte Dosisexposition der Normalgewebe manifestiert sich in einer deutlich höheren Akuttoleranz, einer partiell besseren Spättoleranz (z.B. START-B-Studie, APBI) sowie in kaum mehr beobachtbaren aktinischen Pneumonitiden als subakute Nebenwirkung nach Brustbestrahlung – hier gilt: «when less is more».2,19
Für Patientinnen bedeutet die hRT substanziell weniger Behandlungssitzungen und kürzere Gesamtbehandlungszeiten. Dies erhöht auch die betriebswirtschaftliche Effizienz: Mehr Patientinnen können pro Zeitintervall mit der gegebenen Linearbeschleuniger-Zeit bzw. den gegebenen personellen Ressourcen behandelt werden.
Eine kürzere Therapiegesamtdauer geht einher mit einem geringeren Schweregrad aktinischer Lymphopenien (weniger Fraktionen entsprechen weniger Blutexposition).20,21 Die schon lange bekannte Assoziation zwischen schwerer aktinischer Lymphopenie und reduziertem OS nach Bestrahlung solider Tumoren wird durch die kurzen hRT-Schemata günstig beeinflusst.22 Für die Teilbrust-RT ist zudem von einem reduzierten Risiko für die Induktion sekundärer Tumoren auszugehen.23
Am Luzerner Kantonsspital wurden seit 2017 mehr als 300 Patientinnen mit APBI behandelt. 99% Brustkontrolle, keine nennenswerten Spät-Nebenwirkungen (G2,3), sehr hohe Akuttoleranz (G0–1), sehr hohe Patientinnenzufriedenheit (PROM), sehr gute Kosmesis und keine unbefriedigende Beurteilung bei 100% der Patientinnen.
Das 3-wöchige START-B-Regime wurde seit 2016 bei mehr als 500 Patientinnen unter Verwendung einer integrierten Dosis-Aufsättigung («Boost») bzw. inklusive Lymphabflussbestrahlung eingesetzt. Beobachtet wurden eine sehr hohe Akuttoleranz, bislang keine G3-Spätreaktionen und exzellente PROM.
Seit 2020 erfolgte bei bislang >250 Patientinnen (mit fortgeschritteneren Stadien als indizierend für APBI, ohne Indikation für eine LAW) die 1-wöchige RT der Ganzbrust (+/– sequentieller Boost) gemäss der FAST-FORWARD-Studie. Es zeigten sich eine sehr hohe Akuttoleranz, bislang keine G3-Späteffekte, bislang keine Brustrezidive und exzellente PROM.
Aufgrund der reduzierten Dosisexposition der Lunge wurden nach APBI und ultra-hypofraktionierter Radiotherapie (uhRT) keine Pneumonitiden mehr beobachtet. Nach Normofraktionierung liegen die Werte heutzutage im einstelligen Prozentbereich.
Offene Fragen
Einige der offenen Fragen betreffen u.a. die Integration der Lymphabflusswege in die uhRT (Fortsetzungsstudie der FAST-FORWARD-Studie) bzw. der Boost-Integration in die uhWBRT. Des Weiteren beinhalten bisherige limitierte Daten zur präoperativen Radiatio interessante Aspekte.
So sich der Überlebensvorteil der TARGIT-A-Studie (intraoperatives RT-Stratum) bestätigt, dürfte auch hier eine weitere Entwicklung zu erwarten sein. Das Feld der molekularpathologischen und Biomarker-Differenzierung der Tumorstadien zur Modulierung der Radiotherapie (Volumina, Dosierung, Indikationsstellung) ist gross, die bisherigen Fortschritte in Bezug auf die Radiotherapie sind aber noch sehr limitiert.
Literatur:
1 Darby S et al.: Effect of radiotherapy after breast-conserving surgery on 10-year recurrence and 15-year breast cancer death: meta-analysis of individual patient data for 10,801 women in 17 randomised trials. Lancet 2011; 378(9804): 1707-16 2 Studer G, Glanzmann C: Radiation Oncology - Recent Status. Praxis 2021; 110(13): 733-42 3 Fowler JF: 21 years of biologically effective dose. Br J Radiol 2010; 83: 554-68 4 Haviland JS et al.: The UK Standardisation of Breast Radiotherapy (START) trials of radiotherapy hypofractionation for treatment of early breast cancer: 10-year follow-up results of two randomised con-trolled trials. Lancet Oncol 2013; 14(11): 1086-94 5 Studer G et al.: Hypofractionated radiation therapy following breast conserving surgery for breast carcinoma. Schweiz Krebsbull 2015; 2: 138-41 6 Brunt AM et al.: FAST phase III RCT of radiotherapy hypofractionation for treatment of early breast cancer: 10-year results (CRUKE/04/015). Int J Radiat Oncol Biol Phys 2018; 102: 1603-4 7 Brunt AM et al.: Ten-year results of FAST: a randomized controlled trial of 5-fraction whole-breast radiotherapy for early breast cancer. J Clin Oncol 2020; 38(28): 3261-72 8 Brunt AM et al.: Hypofractionated breast radiotherapy for 1 week versus 3 weeks (FAST-Forward): 5-year efficacy and late normal tissue effects results from a multicentre, non-inferiority, randomized, phase 3 trial. Lancet 2020; 395(10237): 1613-26 9 Yarnold JR et al.: From 25 fractions to five: how hypofractionation has revolutionised adjuvant breast radiotherapy. J Clin Oncol 2022; 34(5): 332-9 10 Correa C et al.: Accelerated partial breast irradiation: executive summary for the update of an AS-TRO Evidence-Based Consensus Statement. Pract Radiat Oncol 2017; 7(2): 73-9 11 Studer G et al.: Radiotherapie bei brusterhaltender Lokalbehandlung des Mammakarzinomes: Teilbrust- statt Ganzbrust-Bestrahlung? Luzerner Arzt 2017; 108: 33-8 12 Frank A et al.: Long-term primary results of accelerated partial breast irradiation after breast-conserving surgery for early-stage breast cancer: a randomised, phase 3, equivalence trial. Lancet 2019; 394(10215): 2155-64 13 Polgár C et al.: Breast-conserving surgery followed by partial or whole breast irradiation: twenty-year results of a phase 3 clinical study. Int J Radiat Oncol Biol Phys 2021; 109(4): 998-1006 14 Meattini I et al.: Partial-breast irradiation compared with whole-breast irradiation for early breast cancer: long-term results of the randomized phase III APBI-IMRT-Florence trial. J Clin Oncol 2020; 38(35): 4175-83 15 Coles CE et al.: Partial-breast radiotherapy after breast conservation surgery for patients with early breast cancer (UK IMPORT LOW trial): 5-year results from a multicentre, randomised, controlled, phase 3, non-inferiority trial. Lancet 2017; 390(10099): 1048-60 16 Whelan TJ et al.: External beam accelerated partial breast irradiation versus whole breast irradiation after breast conserving surgery in women with ductal carcinoma in situ and node-negative breast cancer (RAPID): a randomised controlled trial. Lancet 2019; 394(10215): 2165-172 17 Schäfer R et al.: Quality-of-life results for accelerated partial breast irradia-tion with interstitial brachytherapy versus whole-breast irradiation in early breast cancer after breast con-serving surgery (GEC-ESTRO): 5-year results of a randomised, phase 3 trial. Lancet Oncol 2018; 19(6): 834-44 18Tann AW et al.: Accelerated partial breast irradiation: Past, present, and future. World J Clin Oncol 2016; 7(5): 370-9 19 Aitken K, Mukherjee S: When less is more: the rising tide of hypofractionation. Clin Oncol (R Coll Radiol) 2022; 34(5): 277-79 20 Zhao Q et al.: Treatment-duration is related to changes in peripheral lymphocyte counts during definitive radiotherapy for unresectable stage III NSCLC. Radiation Oncology 2019; 14: #86 21 Cai X et al.: The impact of the effective dose to immune cells on lymphopenia and survival of esophageal cancer after chemoradiotherapy. Radiother Oncol 2020; 146: 180-6 22 Damen PJJ et al.: The influence of severe radiation-induced lymphopenia on overall survival in solid tumors: a systematic review and meta-analysis. Int J Radiat Oncol Biol Phys 2021; 111(4): 936-48 23 Hoekstra N et al.: Long-term risks of secondary cancer for various whole and partial breast irradiation techniques. Radiother Oncol 2018; 128(3): 428-33
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...