Update zum metastasierten Mammakarzinom
Autor:
PD Dr. med. Marcus Vetter
Klinik für Onkologie, Hämatologie und Immuntherapie, Medizinische Universitätsklinik
Kantonsspital Baselland
E-Mail: marcus.vetter@ksbl.ch
Am 6. und 7. Mai 2022 fand in Luzern der Kongress der SAMO (Swiss Academy of Multidisciplinary Oncology) zum Mammakarzinom statt. Der folgende Artikel gibt einen Überblick über das fortgeschrittene Mammakarzinom. Der Leser erhält eine Einführung sowie klinische Daten zu verschiedenen Subgruppen des Mammakarzinoms.
Rund 5% aller Brustkrebspatientinnen werden primär mit einem metastasierten Mammakarzinom diagnostiziert. Die 5-Jahres-Überlebensrate bei metastasiertem Mammakarzinom liegt je nach Subtyp zwischen 20% und 30%.
In der Schweiz erkranken rund 6000 Frauen pro Jahr an einem Mammakarzinom und 1200 Frauen sterben daran. Europaweit kommt es zu 138000 Todesfällen.
Faktoren der Metastasierung
Beim Risiko der Metastasierung, einschliesslich Hirnmetastasen, gibt es bestimmte Subtypen des Mammakarzinoms zu unterscheiden. Dazu gehört das tripelnegative Mammakarzinom (TNBC) und das HER2-positive Mammakarzinom.
Einzelne Faktoren für ein erhöhtes Risiko einer Metastasierung sind vor allem das initiale Stadium (Lymphknoten >3), das Grading (G3) und eine hohe Proliferation (KI67). Heutzutage kann anhand einer genetischen Signatur des primären Tumors das Risiko für ein Rezidiv und eine Metastasierung prognostiziert werden. Entsprechend sollte bereits in der adjuvanten Situation die Therapie auf das Risiko zugeschnitten sein.
Vereinzelt gibt es Fallbeschreibungen und kleinere Fallserien, die eine recht gute Prognose bei oligometastatischer Erkrankung zeigen. Allerdings gibt es hierzu noch kaum randomisierte Daten. Als offene Fragen für die Diagnostik und Therapie des metastasierten Mammakarzinoms bleiben: Erforschung der Resistenzmechanismen und Behandlung, Hirnmetastasen, Lebensqualitätsfragen und Art des Follow-up im adjuvanten Setting.1
Subtyp und Prognose
Bei der Prognose des Mammakarzinoms spielt der intrinsische Subtyp ebenfalls eine wichtige Rolle. Durch neue Therapien haben sich die prognostizierten Überlebenszeiten mittlerweile in vielen Fällen verlängert. Bestes Beispiel dafür sind Behandlungsmöglichkeiten beim HER2-positiven Mammakarzinom.
Klassischerweise unterscheidet man folgende biologische Subtypen:
-
Luminal A (niedrige Proliferation, hohe Hormonrezeptoren)
-
Luminal B (hohe Proliferation, teils niedrige Hormonrezeptoren)
-
Tripelnegatives Mammakarzinom (fehlende Hormonrezeptoren, fehlende HER2-Überexpression)
-
Luminal HER2-positiv (Hormonrezeptor-positiv, HER2-positiv)
Die luminalen Brustkrebserkrankungen haben nach wie vor eine der besten Prognosen. Die schlechteste Prognose zeigt weiterhin das tripelnegative Mammakarzinom mit einem Rezidivrisiko von bis zu 30% auch unter Therapie. In den letzten Jahren hat sich jedoch eine deutliche Prognoseverbesserung einschliesslich der Therapieansätze mit Immuntherapie und Antibody-Drug-Konjugaten (ADC) ergeben.2
Behandlung des tripelnegativen Mammakarzinoms
Basierend auf den aktuellen Empfehlungen der ESMO(European Society for Medical Oncology)- und NCCN(National Comprehensive Cancer Network)-Guidelines ist es essenziell, beim tripelnegativen Mammakarzinom Therapie-entscheidende Biomarker zu bestimmen. Dazu gehören der PD-L1-Status und der BRCA-Status. Entscheidend ist auch, wie lange die letzte adjuvante Therapie zurückliegt.
Für die PD-L1-positiven Tumoren sollte eine Chemo-Immuntherapie gewählt werden, z.B. mit Atezolizumab oder Pembrolizumab. Bei Patientinnen, die eine Keimbahnmutation für BRCA1 oder BRCA2 haben, sollte auf eine Platin-basierte Chemotherapie bzw. einen PARP-Inhibitor zurückgegriffen werden. Olaparib oder Talazoparib sollten bei Patientinnen mit BRCA-Keimbahnmutationen eingesetzt werden.
Für alle Patientinnen mit einem Tumor ohne PD-L1-Positivität oder BRCA-Mutation wird in der Regel eine Chemotherapie gewählt. Hier sind die wichtigsten Substanzen Paclitaxel, Epirubicin/Doxorubicin, Gemcitabin, Carboplatin, Capecitabin oder Eribulin. Bei Progression ist der Standard das ADC Sacituzumab Govitecan.3
Das Prinzip von neuen Therapien beim TNBC liegt in verschiedenen Angriffspunkten. Am erfolgversprechendsten erscheinen Immuntherapien und HRD(homologe Rekombinationsdefizienz)-gerichtete Therapie. In Erprobung sind momentan des Weiteren verschiedene Tumorvakzinierungsmethoden sowie verschiedene Chemotherapien und Medikamente, die das Immunsystem manipulieren.4
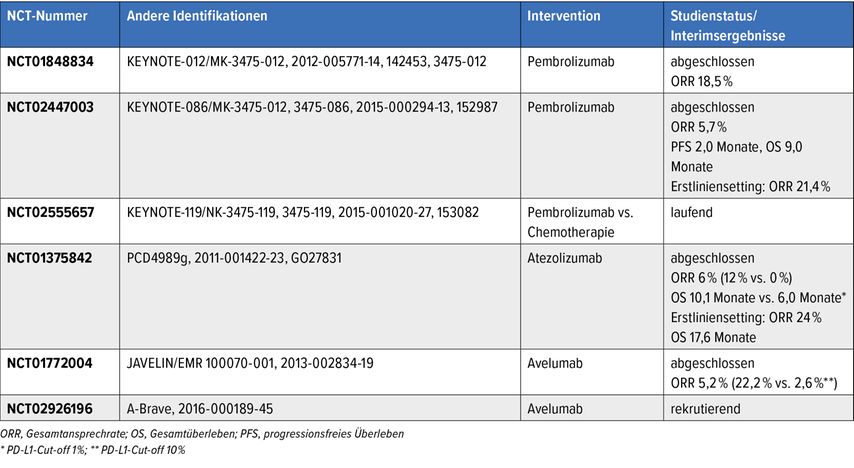
Das Mammakarzinom hat jedoch generell eine niedrige Mutationslast im Vergleich z.B. zum Nierenzellkarzinom, Melanom oder Bronchuskarzinom.5 Daher scheint es sinnvoll, «kalte» Tumoren in «heisse» Tumoren zu überführen. Zum Beispiel haben Immunstimulanzien, Radiotherapie oder Chemotherapie6 bzw. generell Monotherapien in Kombination mit Immuncheckpoint-Inhibitoren beim tripelnegativen Mammakarzinom eine Ansprechrate von rund 20% (Tab. 1).
Tab. 1: Monotherapie mit Checkpoint-Inhibitor beim tripelnegativen Mammakarzinom: die wichtigsten Studien mit verschiedenen Checkpoint-Inhibitoren als Monotherapie beim tripelnegativen Mammakarzinom zusammengefasst. Modifiziert nach Al-Ramadi BK et al. 20216
Einen entscheidenden Fortschritt bezüglich Ansprechrate beim tripelnegativen Mammakarzinom brachte die Phase-III-Studie IMpassion130, in der Nab-Paclitaxel mit Atezolizumab gegenüber Placebo bei PD-L1-positiven Patientinnen untersucht wurde (definiert als PD-L1 im Immuninfiltrat ≥1%, untersucht mit dem VENTANA-SP-142-Antikörper in der Immunhistochemie).
In der Studie konnte für die Kombination von Nab-Paclitaxel und Atezolizumab bei Patientinnen mit PD-L1-Positivität ein signifikanter Überlebensvorteil gezeigt werden (15,5 Monate vs. 25 Monate). In der Folge wurde die Behandlung als neuer Standard definiert.
Eine weitere Studie (KEYNOTE-355) untersuchte die Hinzunahme von Pembrolizumab zur Standardchemotherapie. Diese Studie war ebenfalls eine Phase-III-Studie mit Placebokontrolle. Und auch in dieser Studie zeigt die Hinzunahme eines Immuncheckpoint-Inhibitors zur Standardchemotherapie (Nab-Paclitaxel, Paclitaxel, Carboplatin, Gemzar) einen Vorteil bezüglich Gesamtüberleben in der Gruppe mit CPS-Score ≥10.7
Bei den Immuncheckpoint-Inhibitoren muss selbstverständlich auch an das Nebenwirkungsprofil gedacht werden. Insgesamt überwiegt jedoch der gesamte Überlebensvorteil die schweren Nebenwirkungen (Grad-III-Toxizität bei rund 10%).
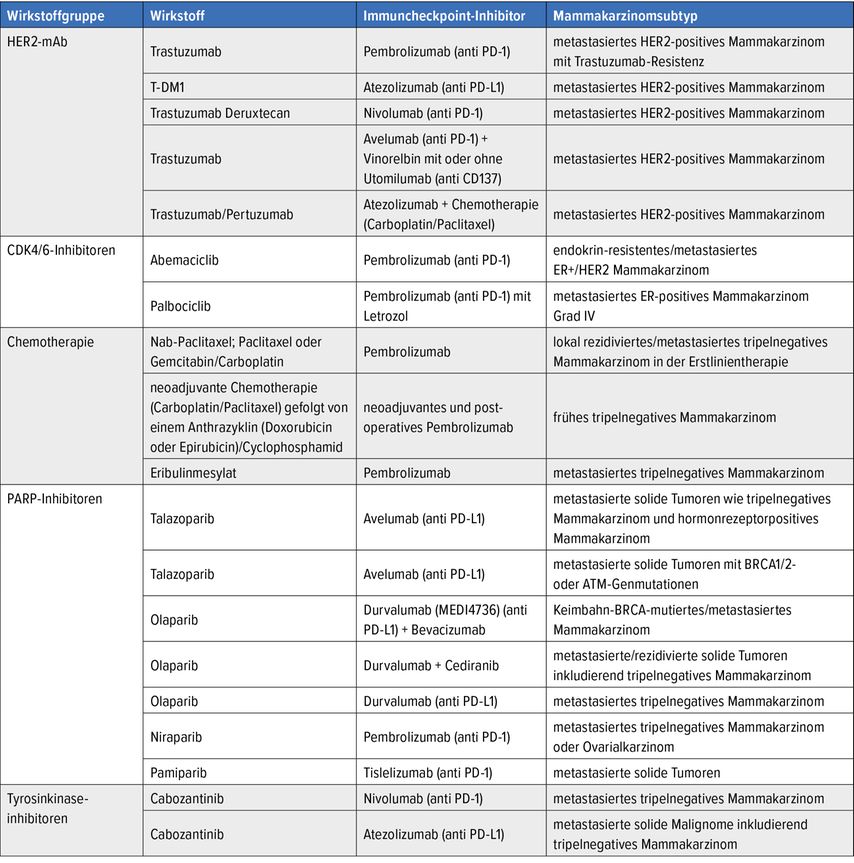
Aktuell wird vor allem die Kombinationstherapie untersucht, vermutlich wird in der Zukunft auch eine Immuntherapie in Kombination mit weiteren Immunstimulanzien oder auch Chemotherapie appliziert werden. Tabelle 2 gibt hierzu einen Ausblick.
Tab. 2: Zukunftsausblick auf die Immuntherapie beim Brustkrebs: die wichtigsten Studien, welche die Kombinationstherapie von Immuncheckpoint-Inhibitor und Targettherapie oder auch Chemotherapie beim Mammakarzinom untersuchen, zusammengefasst
Eine weitere vielversprechende Therapieoption beim Mammakarzinom ist das zielgerichtete «Angreifen» der HRD. An der HRD sind multiple Proteine beteiligt, die die DNA in Krebszellen, aber auch gesunden Zellen reparieren. Wenn diese ausgeschaltet werden, kann die Krebszelle sich nicht mehr teilen und vermehren.
Paradebeispiel für die HRD-Behandlung sind die PARP-Inhibitoren. Neben den Patientinnen mit klassischen BRCA-Mutationen kommen auch andere HRD-definierende Mutationen zum Tragen, welche letztendlich therapeutisch angegriffen werden können. Beim tripelnegativen Mammakarzinom haben bis zu 50% der Tumoren einen HRD-Typ und können theoretisch auf eine entsprechende Therapie ansprechen.
Unterschieden werden muss nach hereditären Mutationen, aber auch nach Mutationen, die nur im Tumor vorkommen, und epigenetischen Phänomenen im Tumor. Bei rund 5% der HRD ist der Ursprung nicht zu erkennen.8
Eine Studie von Gruber et al. zeigt, dass PARP-Inhibitoren z.B. auch bei nicht typischen BRCA-Mutationen wirksam sein können. Bei den in dieser Studie untersuchten Patientinnen handelt es sich vor allem um Patientinnen mit Pankreas-, Uterus- und Mammakarzinom.
Die klassischen PARP-Inhibitoren wie Olaparib und Talazoparib sind mittlerweile in vielen Ländern für die Behandlung von Patientinnen mit Keimbahnmutationen bei BRCA1 und BRCA2 und metastasiertem Brustkrebs zugelassen. Die Substanzen zeigten einen besseren Effekt gegenüber der Standardchemotherapie hinsichtlich des progressionsfreien Überlebens.9,10
Die neuesten Entwicklungen für das tripelnegative Mammakarzinom umfassen die ADC. Hier ist vor allem Sacituzumab Govitecan zu erwähnen. Dieses ADC richtet sich gegen TROP-2 («epithelial glycoprotein 1», «gastrointestinal antigen 733-1»), welches auf vielen soliden Tumoren exprimiert ist. Als Chemotherapeutikum wird SN-38 eingesetzt. SN-38 ist ein Topoisomerase-Inhibitor und der aktive Metabolit des Irinotecans.
In der ASCENT-Studie wurde ein deutlicher Überlebensvorteil gegenüber «Physician’s Choice»-Chemotherapie gezeigt (12,1 vs. 6,7 Monate; p<0,0001). Damit wurde dieses Medikament zum neuen Standard in der Zweitlinientherapie für das tripelnegative Mammakarzinom. Interessanterweise zeigen auch Patientinnen mit niedrig exprimierendem TROP-2-positivem Mammakarzinom einen klaren Vorteil.
Insgesamt kam es in den letzten Jahren zu einem deutlichen Fortschritt in der Forschung zum tripelnegativen Mammakarzinom. Einige neue Substanzen, insbesondere im Bereich von Immuntherapie, PARP-Inhibitoren und ADC, wurden mittlerweile zugelassen und haben die Prognose deutlich verbessert. Es sind jedoch weitere Anstrengungen notwendig, um allen Patientinnen die optimale kurative Therapie anbieten zu können. Davon sind wir noch weit entfernt.
Behandlung des HER2-positiven Mammakarzinoms
Die Behandlungsoptionen beim HER2-positiven Mammakarzinom haben sich in den letzten Jahren dramatisch verbessert. Weiterhin bleibt der primäre Standard in der Erstlinientherapie das «CLEOPATRA»-Regime, bei dem ein Taxan mit Trastuzumab und Pertuzumab kombiniert wird. Im Langzeit-Follow-up zeigen sich hier dramatische Verlängerungen des Gesamtüberlebens unter Hinzunahme von Pertuzumab.11 Der neue Zweitlinienstandard ist Trastuzumab Deruxtecan, welches gegenüber Trastuzumab Emtansin einen deutlichen Vorteil aufwies.12
Bisher ungelöste Probleme bleiben weiterhin Mechanismen der Resistenz, Hirnmetastasen, Toxizitäts- und Lebensqualitätsfragen. In Zukunft werden vermutlich noch mehr zielgerichtete Therapien zum Einsatz kommen, auch im frühen Stadium.
Die aktuellen ESMO-Guidelines empfehlen in der ersten Behandlungslinie beim hormonrezeptorpositiven Mammakarzinom und bei fehlender Indikation zur Chemotherapie eine Therapie mit Trastuzumab +/– Pertuzumab und endokriner Therapie (Level-2B-Evidenz). Bei Chemotherapieindikation wird weiterhin das «CLEOPATRA»-Schema empfohlen.
Bei Patientinnen mit hormonrezeptornegativer systemischer Erkrankung werden ebenfalls die HER2-gerichteten Antikörper ohne weitere Chemotherapie empfohlen. Bei Indikation für die Chemotherapie wird auch hier weiterhin das «CLEOPATRA»-Schema empfohlen.
In der Zweitlinientherapie sollte unterschieden werden, ob Hirnmetastasen vorhanden sind oder nicht. Bei lokaler Behandlungsmöglichkeit sollten Hirnmetastasen immer lokal mit Resektion und/oder Radiotherapie behandelt werden. Wenn eine lokale Intervention nicht indiziert ist, ist das Standardregime mittlerweile Tucatinib, Trastuzumab und Capecitabin oder Trastuzumab Deruxtecan. Bei fehlenden Hirnmetastasen oder unklarem Status ist in der Zweitlinientherapie weiterhin Trastuzumab Deruxtecan oder Trastuzumab Emtansin empfohlen.13
Die Behandlungsoptionen beim HER2-positiven Mammakarzinom sind heute vielfältig. Die wichtigsten Angriffspunkte bezüglich des HER2-Targets sind:14
-
Inhibition der Rezeptordimerisation
-
Einbinden von ADC
-
Direkte Inhibition der «Downstream»-Signale einschliesslich EGFR-Inhibition
-
PIK3CA-Inhibition
-
Zellzyklusinhibition
In der HER2CLIMB-Studie wurde das Kleinmolekül Tucatinib untersucht. Tucatinib ist ein Multikinase-Inhibitor, wirksam z.B. gegen HER2, EGFR, HER4, KIT, FLOT 4ER TK, CK, EPHA 2 und EPHA 1. In präklinischen Studien konnte gezeigt werden, dass Tucatinib vor allem über HER2 inhibiert und deutlich geringer über EGFR. In der Studie wurde das Regime Trastuzumab/Capecitabin/Tucatinib im Vergleich zu Trastuzumab/Capecitabin/Placebo untersucht. Insgesamt wurden rund 600 Patientinnen in die Studie eingeschlossen.15
Das Gesamtüberleben war für die Studiengruppe signifikant länger (24 Monate 44,9 vs. 26,6; p=0,005). Auf Basis dieser Studie wurde das Medikament als neue Standardtherapie ab der dritten Therapielinie bzw. bei Hirnmetastasen eingestuft, da Tucatinib auch einen eindeutigen klaren Benefit bei Patientinnen mit Hirnmetastasen zeigte. Bezüglich der Verträglichkeit sind vor allem gastrointestinale Toxizität Grad I und II zu nennen, hier vor allem Diarrhö und Nausea. Die Nebenwirkungen waren jedoch mit einer Dosisreduktion gut beherrschbar.
Eine weitere doch sehr gute Innovation und mittlerweile in der Klinik zugelassen ist die Behandlung mit Trastuzumab Deruxtecan. Bei deutlich vorbehandelten Patientinnen mit metastasiertem HER2-positivem Mammakarzinom zeigte die Substanz eine sehr hohe Ansprechrate und eine deutlich erhöhte PFS-Rate von rund 16 Monaten (DESTINY-Breast001-Studie).16 Mittlerweile wurde das Medikament auch mit Trastuzumab Emtansin in der Zweitlinientherapie verglichen. Auch hier zeigte sich ein deutlicher Vorteil für das neue ADC.
In der Regel ist das Medikament gut verträglich. Die wichtigste Nebenwirkung ist gastrointestinale Toxizität. Sehr selten kam es zu interstitiellen Lungenerkrankungen, in ganz wenigen Fällen sogar zu assoziierten Todesfällen. Daher sind die Sensibilität und das Management dieser schweren Toxizität sehr wichtig. Rechtzeitige Interventionen mit Steroiden sind erforderlich.
Zusammenfassung und Diskussion
Die Behandlungsoptionen für das metastasierte Mammakarzinom haben sich in den letzten Jahren deutlich verbessert. Zudem kam es basierend auf verschiedenen Studien zu einer deutlichen Prognoseverbesserung einschliesslich des Gesamtüberlebens.
Für das tripelnegative Mammakarzinom bestehen als wichtigste Therapieoptionen die PARP-Inhibitoren, Immuncheckpoint-Inhibitoren und die ADC.
Für das HER2-positive Mammakarzinom ist in der ersten Behandlungslinie immer noch das «CLEOPATRA»-Schema der Standard. In der Zweitlinientherapie hat mittlerweile ein neueres ADC, nämlich Trastuzumab Deruxtecan, einen deutlichen Benefit gegenüber Trastuzumab Emtansin aufgezeigt.
Zudem gibt es speziell für Patientinnen mit Hirnmetastasen ein neues kleines Molekül, Tucatinib, welches ebenso eine deutliche Verbesserung der Progressionsfreiheit und des Gesamtüberlebens aufwies.
Insgesamt sind die Aussichten beim metastasierten Mammakarzinom gut. Sicherlich gibt es weiterhin Optimierungsbedarf bei der Frage der Resistenzentwicklung und neuen Behandlungsoptionen.
Literatur:
1 Gennari A et al.: Annals Oncol 2021; 32(12): 1475-95 2 Kenneke H et al.: J Clin Oncol 2010; 28(20): 3271-7 3 ESMO Metastatic Breast Cancer Living Guidelines: Triple-negative Breast Cancer. Online unter https://www.esmo.org/living-guidelines/esmo-metastatic-breast-cancer-living-guidelines/triple-negative-breast-cancer . Abgerufen am 18.8.2022 4 Cao Y et al.: Pharmaceutics 2021; 13(12): 2003 5 Wang X, Li M: BMC Immunol 2019; 11; 20(1): 4 6 Tolba MF et al.: Front Oncol 2021; 11: 752689 7 Cortés J et al.: Lancet 2021; 398(10294): 24-5 8 Gruber JJ et al.: ASCO 2019; Abstr. #3006 9 Robson M et al.: N Engl J Med 2017; 377: 523-33 10 Litton JK et al.: N Engl J Med 2018; 379: 753-63 11 Swain SM et al.: N Engl J Med 2015; 372: 724-34 12 Cortés J et al.: N Engl J Med 2022; 386: 1143-54 13 Gennari A et al.: Ann Oncol 2021; 32(12): 1475-95 14 Oh DY, Bang YJ: Nat Rev Clin Oncol 2020; 17(1): 33-48 15 Murthy RK et al.: N Engl J Med 2020; 382: 597-609 16 Modi S et al.: N Engl J Med 2020; 382: 610-21
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...