Update zur CAR-T-Zell-Therapie – ein Zwischenstand
Bericht: Dr. Norbert Hasenöhrl
Review:
Univ.-Prof. Dr. Marion Subklewe
Medizinische Klinik und Poliklinik III
(Hämatologie und Onkologie)
Klinikum der Universität München
Genzentrum München
Ludwig-Maximilians-Universität München
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die Münchner Hämatologin Univ.-Prof. Dr. Marion Subklewe berichtete auf der DGHO-Jahrestagung über den aktuellen Stand der Therapie mit „Chimäre Antigen-Rezeptor“(CAR)-T-Zellen und auch über die Hindernisse, die dieser Behandlung derzeit noch im Weg stehen.
Das Erfahrungsspektrum mit CAR-T-Zellen ist in unseren Kliniken immer noch begrenzt, obwohl der erste Vorschlag für dieses Konzept von Zelig Eshar bereits 1987 publiziert wurde, erläuterte Prof. Dr. Marion Subklewe, Medizinische Klinik und Poliklinik III, Ludwig-Maximilians-Universität München, die dort das „Zelluläre Immuntherapie-Programm“ leitet. Die ersten klinischen Fallberichte stammen aus dem Jahr 2010. Seitdem wurde diese Therapie kontinuierlich weiterentwickelt.
Seit August 2018 sind in Deutschland zwei Produkte zugelassen: Für rezidivierende bzw. therapieresistente (r/r) aggressive Lymphome (diffuse großzellige B-Zell-Lymphome [DLBCL] und primär mediastinale B-Zell-Lymphome [PMBL]) kann nun Axicabtagen-Ciloleucel (Yescarta®) oder Tisagenlecleucel (Kymriah®) nach zumindest zwei Vortherapien verwendet werden. Tisagenlecleucel ist auch für die r/r akute lymphatische B-Zell-Precursor-Leukämie (BCP-ALL) bei Patienten unter 26 Jahren zugelassen.
Welche Produkte gibt es und was können sie?
Die Indikationen im Bereich der aggressiven Lymphome sind bei diesen beiden Produkten weitgehend ähnlich, aber sie unterscheiden sich in der Produktion und im CAR-Design.
Die benötigten Zellen werden aus einer Leukapherese generiert und entweder „warm“ oder kryokonserviert an die jeweilige Firma geschickt. Die Insertion des CAR-Gens erfolgt durch einen viralen Vektor (Lentivirus oder Retrovirus). Die dadurch entstandenen T-Zellen werden expandiert, evtl. nochmals kryokonserviert und dem Patienten in einer einmaligen Infusion verabreicht.
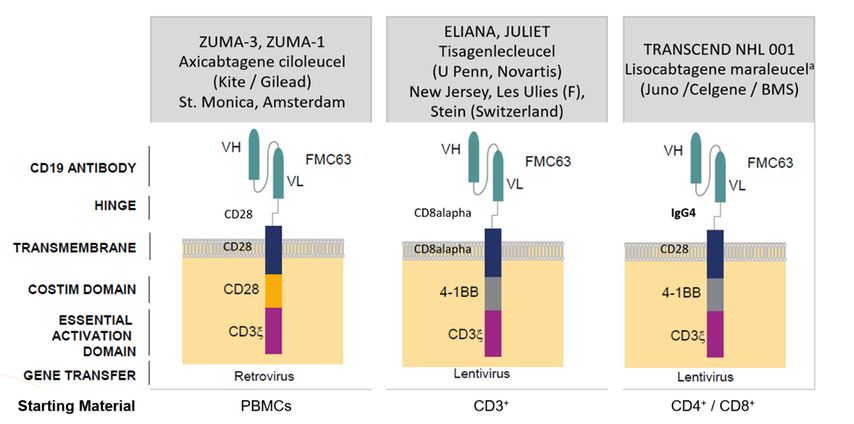
„Die drei verfügbaren CARs unterscheiden sich in verschiedenen Punkten, etwa was die Hinge- und Transmembran-Domänen betrifft, aber auch in den kostimulatorischen Domänen (hier wird entweder CD28 oder 4-1BB verwendet), im Ausgangsmaterial, im Vektor für den Gentransfer und natürlich auch in den Produktionsstätten“, führte die Hämatologin aus (Abb. 1). Neben den zwei bereits zugelassenen Produkten (Axicabtagen-Ciloleucel und Tisagenlecleucel) gibt es ein drittes, Lisocabtagen-Maraleucel, für das gerade eine Zulassung angestrebt wird.
Das benötigte Ausgangsmaterial ist für jedes Produkt verschieden. So werden etwa für die Herstellung von Axicabtagen-Ciloleucel mononukleäre Zellen aus dem peripheren Blut benötigt, für Tisagenlecleucel CD3+-Zellen und für das noch in Zulassung befindliche Lisocabtagen-Maraleucel CD4+/CD8+-Zellen.
Die Ergebnisse der klinischen Studien, die Axicabtagen-Ciloleucel (ZUMA)2, Tisagenlecleucel (JULIET)3 und Lisocabtagen-Maraleucel (TRANSCEND)4 untersuchten, zeigen ähnliche Ergebnisse. Die Gesamtansprechraten (ORR) liegen zwischen 52% und 83%, die besten Raten an kompletten Remissionen (CR) zwischen 40% und 58%. Die Langzeit-Ansprechraten betragen zwischen 37% und 47%, die Langzeit-CR-Raten liegen zwischen 30% und 42%. „Alles in allem sind das also einigermaßen vergleichbare Ergebnisse“, resümierte die Hämatologin.
Die Situation in Europa …
„Da nun auch in Europa Produktionsstätten für CAR-T-Zellen eröffnet wurden, hoffen wir alle sehr, dass dies die bisher sehr komplexe Logistik der CAR-T-Zell-Therapie ein wenig vereinfachen wird“, so Subklewe.
Nach der Zulassung gab es in Deutschland einen zuvor noch nie da gewesenen Auditierungsprozess von Zentren durch die Industrie. Im Mai 2020 waren 26 Zentren für die CAR-T-Zell-Therapie zertifiziert, meist für beide zugelassene Produkte. Dies sind Zentren, die bestimmte Kriterien, wie mindestens 120 Allotransplantationen in den letzten drei Jahren, erfüllen müssen.
In Österreich sind sechs Zentren zugelassen (zwei in Wien und je eines in Graz, Linz, Salzburg und Innsbruck). Dies ist, wenn man es auf die Bevölkerungszahlen umlegt, sogar eine doppelt so gute Versorgung wie in Deutschland. Ähnlich ist es in der Schweiz, wo derzeit bereits sechs Zentren zertifiziert und vier weitere in Zertifizierung sind. „In Europa insgesamt ist die Zahl der zertifizierten Zentren allerdings noch relativ niedrig“, merkte Subklewe an.
In Deutschland wurden bisher 496 Patienten mit CAR-T-Zellen behandelt, davon 348 mit kommerziellen Produkten. „Das ist doch deutlich weniger als die 1000 bis 1500 Patienten mit aggressiven Lymphomen oder BCP-ALL, die pro Jahr in Deutschland für eine solche Therapie infrage kommen. Allerdings kämpfen viele Zentren hier noch mit logistischen Problemen“, schränkte die Hämatologin ein.
… und in München
An der Ludwig-Maximilians-Universität (LMU) München wurde eine multidisziplinäre Immuno-Taskforce gegründet, um diesen logistischen und praktischen Herausforderungen zu begegnen. Die Taskforce hat die Aufgabe, die infrage kommenden Patienten durch die verschiedenen Schritte wie Indikationsprüfung, Abarbeiten von Checklisten, Leukapherese, Bridging-Therapie bis zur Transfusion der CAR-T-Zellen und Nachsorge zu begleiten.
Zunächst muss in einem hämatologischen Board die Indikation zur CAR-T-Zell-Therapie gestellt werden.
Welche Patienten kommen infrage?
Wenn die Indikation gestellt ist, muss der Patient noch eine Reihe von Kriterien erfüllen. Sein ECOG Performance Status darf nicht schlechter als 2 (besser 1+) sein, höhergradige Einschränkungen der Organfunktion dürfen nicht bestehen, auch keine andauernde, höhergradige Zytopenie. Die Lebenserwartung muss mindestens noch zwölf Wochen betragen und die Erkrankung so weit stabil sein, dass eine Bridging-Therapie möglich wird. Patienten mit primärem ZNS-Lymphom sind ausgeschlossen, bei sekundärem ZNS-Befall muss individuell entschieden werden. Es darf keine unkontrollierte Infektion geben, besonders keine Virusinfektionen vor Apherese und vor Therapie. Bei Patienten mit bestimmten Virusinfektionen in der Anamnese, vor allem Hepatitis B oder C und HIV, muss jeweils individuell entschieden werden.
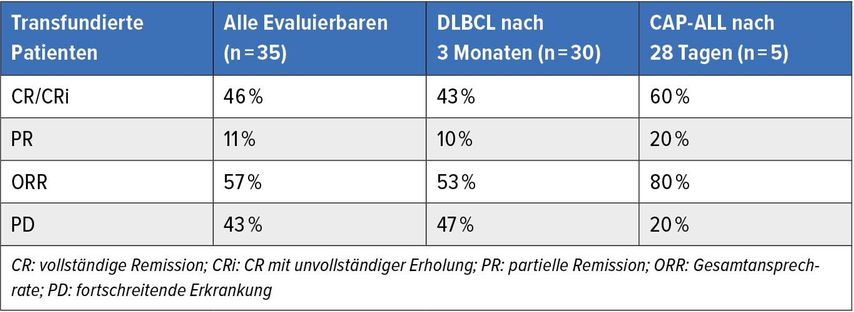
In München wurden 119 Patienten für die CAR-T-Zell-Therapie vorgestellt. 56 erfüllten die Indikation, 10 konnten wegen einer schnell progredienten Erkrankung die Therapie nicht mehr erhalten. Bei 46 war eine Leukapherese möglich, wobei sieben verloren gingen, weil sie nicht auf die Bridging-Therapie ansprachen. Zwei weitere warteten noch auf die Therapie, ein Patient war wegen Toxizität nicht auswertbar, einer wegen einer Beobachtungszeit von weniger als drei Monaten. „Am Ende hatten wir also 35 auswertbare Patienten“, so Subklewe. Tabelle 1 zeigt die Ansprechraten der transfundierten Patienten.
„Ein prädiktiver Faktor für einen schlechten Verlauf bei DLBCL ist eine erhöhte LDH zum Zeitpunkt der Apherese. Ein ungelöstes Problem sind die derzeit noch sehr langen Zeiten von der Erstvorstellung bis zur Apherese, im Durchschnitt 51 Tage, und von der Apherese zur Therapie im Durchschnitt nochmals 39 Tage“, so Subklewe abschließend.
Quelle:
„Real-Life CAR-T-Zellen in Deutschland“, Vortrag von Univ.-Prof. Dr. Marion Subklewe, München, im Rahmen des wissenschaftlichen Symposiums „Immuntherapie“, virtuelle Jahrestagung der DGHO, 10. Oktober 2020
Literatur:
1 Van der Stegen SJ et al.: The pharmacology of second-generation chimeric antigen receptors. Nat Rev Drug Discov 2015; 14(7): 499-509 2 Locke FL et al.: Long-term safety and activity of axicabtagene ciloleucel in refractory large B-cell lymphoma (ZUMA-1): a single-arm, multicentre, phase 1-2 trial. Lancet Oncol 2019; 20(1): 31-42 3 Schuster SJ et al.: Tisagenlecleucel in adult relapsed or refractory diffuse large B-cell lymphoma. N Engl J Med 2019; 380(1): 45-56 4 Abramson JS et al.: Lisocabtagene maraleucel for patients with relapsed or refractory large B-cell lymphomas (TRANSCEND NHL 001): a multicentre seamless design study. Lancet 2020; 396(10254): 839-52
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...