Umdenken in der RCC-Zweitlinientherapie
Die Zulassung von insgesamt sieben Wirkstoffen seit 2006 hat die Therapie des Nierenzellkarzinoms (RCC) revolutioniert. Jetzt stehen weitere Substanzen vor der Tür, die die Behandlung dieses Tumors künftig noch komplexer gestalten werden. In der Zweitlinientherapie werden sich in Kürze erhebliche Veränderungen ergeben, hieß es auf dem 11. EIKCS in Barcelona.
Mit Cabozantinib wurde ein Tyrosinkinaseinhibitor (TKI) entwickelt, der neben dem VEGFR auch die Kinaseaktivität von MET und AXL hemmt. „MET wird bei einer Anti-VEGF-Therapie hochreguliert. Es gibt also eine solide biologische Basis dafür, dass die gleichzeitige Inhibition von VEGFR und MET die Resistenzentwicklung verzögern kann“, erläuterte Prof. Dr. Brian Rini, Cleveland. Nach positiven Phase-I-Daten wurde Cabozantinib in der Phase-III-Studie bei 658 Patienten mit klarzelligem RCC, die unter einem VEGFR-TKI progredient geworden waren, mit Everolimus als einem Zweitlinienstandard verglichen.1
Cabozantinib schlägt Everolimus
Beim primären Endpunkt progressionsfreies Überleben (PFS) erwies sich Cabozantinib als signifikant überlegen: Es betrug bei den mit Everolimus behandelten Patienten median 3,8 Monate, war dagegen im Cabozantinib-Arm mit 7,4 Monaten nahezu verdoppelt (HR: 0,58; p<0,001). Dieses Ergebnis wurde in einer aktualisierten Analyse der METEOR-Studie kürzlich bestätigt (3,9 vs. 7,4 Monate; HR: 0,52; p<0,001).2 Eine Subgruppenanalyse zeigt zudem signifikante Vorteile zugunsten von Cabozantinib bei Patienten mit guter und intermediärer Prognose sowie eine hohe Aktivität bei den bislang nur schwer zu behandelnden Patienten mit viszeralen und Knochenmetastasen.
Auch das Ansprechen wurde erheblich verbessert: Die Responserate stieg von nur 5 % mit dem mTOR-Inhibitor auf 21 % mit Cabozantinib. Zudem zeichnete sich bereits bei der Interimsanalyse ein signifikanter Vorteil beim Gesamtüberleben (OS; „overall survival“) zugunsten des TKI mit einer Reduktion des Sterberisikos um relativ 33 % ab (HR: 0,67; p=0,005). Diese Überlegenheit hat sich mittlerweile bestätigt: Mit Cabozantinib behandelte Patienten überlebten median 21,4 Monate, die im Everolimus-Arm dagegen nur 16,5 Monate (HR: 0,66; p=0,0003). Auf Basis der METEOR-Daten wurde Cabozantinib kürzlich von der Federal Drug Administration (FDA) für Patienten nach einer Vortherapie mit VEGFR-TKI zugelassen.
Als problematisch wertete Prof. Dr. Sergio Bracardi, Arezzo, allerdings das Sicherheitsprofil des neuen Wirkstoffs: So litten 74 % der Patienten unter einer Diarrhö, die in 11 % vom Grad 3–4 war, 56 % unter Fatigue (G3–4: 9 % ), 50 % unter Übelkeit (G3–4: 5 % ), 42 % unter einem Hand-Fuß-Syndrom (G3–4: 6 % ) und 37 % unter Hypertonie (G3–4: 15 % ). Dosisreduktionen waren daher mit einer Rate von 60 % sehr häufig. Beim Einsatz der Substanz im klinischen Alltag sind daher laut Bracardi künftig noch Anstrengungen erforderlich, um die Verträglichkeit zu verbessern. Den derzeitigen Stellenwert von Cabozantinib sieht er insbesondere bei RCC-Patienten mit Knochen-, möglicherweise auch mit Lebermetastasen.
Checkpoint-Blockade verlängert Gesamtüberleben
Der PD1-Inhibitor Nivolumab ist sowohl in den USA als auch in Europa bereits für die Zweitlinientherapie des RCC zugelassen. Basis war die Phase-III-Studie CheckMate 025, in der Nivolumab bei 822 Patienten ebenfalls mit Everolimus verglichen wurde.3 Knapp drei Viertel der Patienten hatten vor Einschluss in die Studie eine, 26 % zwei antiangiogene Therapien erhalten.
Nivolumab führte im Vergleich zu Everolimus zu einer OS-Verlängerung um gut 5 Monate (25,0 vs. 19,6 Monate; HR: 0,73; p=0,0018). Rini bezeichnete diese Daten als eindrucksvoll, da sich die Überlebenskurven bereits früh, nach rund 3 Monaten, und langfristig anhaltend trennten. „Auch wurde eine Überlebenszeit von 25 Monaten in einem solchen Kollektiv refraktärer Patienten bisher noch nie berichtet“, betonte der Onkologe. Als bedauerlich bezeichnete er die Tatsache, dass bislang kein Biomarker für die Effektivität von Nivolumab beim RCC existiert: Der Checkpoint-Inhibitor war Everolimus unabhängig von der PD-L1-Expression überlegen. Das PFS war mit 4,6 Monaten unter Nivolumab und 4,4 Monaten unter Everolimus in beiden Studienarmen ähnlich. Nötig ist laut Rini ein längeres Follow-up, um zu klären, ob sich bei OS und PFS ein Plateau einstellt. Auf Nivolumab sprachen 21,5 % der Patienten nach median 3 Monaten an (Everolimus: 3,9 % bzw. 3,7 Monate); die mediane Responsedauer liegt bei 23 Monaten (Everolimus: 13,7 Monate). Als bemerkenswert bezeichnete Rini die Tatsache, dass etliche Patienten auch nach Absetzen von Nivolumab weiterhin in Remission sind.
Neuer Standard in der Zweitlinientherapie
Zudem wurde Nivolumab gut vertragen: Die Rate therapiebedingter Nebenwirkungen vom Grad 3–4 war mit 19 % deutlich niedriger als unter Everolimus mit 37 % . „Die gute Verträglichkeit ist eines der besten Argumente für den Einsatz dieser Substanz“, kommentierte Rini. Aufgrund des OS-Benfits und der Verträglichkeit ist Nivolumab nach seinen Worten in der Zweitlinientherapie des RCC als Standard anzusehen.
Er wies darauf hin, dass bei immunonkologisch behandelten Patienten vor dem Ansprechen ein „Tumor-Flare“ auftreten kann, der nach RECIST-Kriterien als Progression charakterisiert werden und zu einem vorzeitigen Therapieabbruch führen kann. Verursacht wird dieses Phänomen durch die Einwanderung von T-Zellen in den Tumor, was in bildgebenden Untersuchungen als Tumorwachstum interpretiert werden kann. „Es handelt sich hierbei jedoch nicht um eine Tumorproliferation“, betonte Rini. Werden diese Patienten weiterbehandelt, kommt es vielfach im weiteren Verlauf zur Tumorschrumpfung.
Erste aktive und verträgliche Kombination beim RCC
Kombinationstherapien wurden beim RCC bereits mehrfach geprüft, haben sich aber bislang nicht bewährt. Sie besitzen eine erhöhte Toxizität, sodass die Dosierungen der Einzelsubstanzen reduziert werden müssen und ein möglicher Wirkvorteil schwindet. In einem solchen Szenario bezeichnete Prof. Dr. Viktor Grünwald, Hannover, es als besser, Substanzen sequenziell einzusetzen. Als Ausnahme erwies sich in einer Studie der Phase Ib die Kombination von Everolimus und dem Multi-TKI-Lenvatinib:4 Hier war erstmals die gleichzeitige Gabe beider Substanzen in voller Dosierung möglich. „Zudem lieferte die Studie ein klares Signal für die Aktivität dieser Kombination“, erklärte Grünwald.
Sie wurde daher in einer randomisierten Phase-II-Studie weiter geprüft: 153 Patienten mit klarzelligem RCC und einer Vortherapie wurden den Monotherapien mit Everolimus oder Lenvatinib oder der Kombination beider Substanzen zugeteilt.5 Mit dem Zweifachregime wurde ein PFS (primärer Endpunkt) von 14,6 Monaten erreicht, das Grünwald als „einzigartig“ wertete. Mit Lenvatinib mono behandelte Patienten lebten median 7,4 Monate ohne Progress, die im Everolimus-Arm 5,5 Monate. Die Überlegenheit der Kombination wurde durch eine Post-hoc-Analyse mit zentraler Begutachtung der Bildgebung bestätigt (12,8 vs. 9,0 vs. 5,6 Monate).6 Auch Ansprechen und Remissionsdauer bezeichnete Grünwald für dieses Kollektiv vorbehandelter Patienten als „einmalig“: Auf die Kombination sprachen 43 % der Patienten an. Die Remissionsdauer bei Respondern beträgt 13 Monate und ist damit erheblich länger als in den Mono-Armen mit Lenvatinib (7,5 Monate) und Everolimus (8,5 Monate).
Zudem wurde in der Phase-II-Studie ein deutlicher OS-Vorteil erreicht: Kombiniert behandelte Patienten lebten median 25,5 Monate, während das OS unter Lenvatinib mit 19,1 Monaten und Everolimus mit 15,4 Monaten deutlich kürzer ausfiel. „Die Studie zeigt erstmals einen OS-Benefit mit einer Kombination“, betonte Grünwald. Er gab jedoch zu bedenken, dass es sich um eine unverblindete Phase-II-Studie mit limitierter Patientenzahl handelt, in der die Teilnehmer nicht anhand ihres Ansprechens auf die Vortherapie stratifiziert worden waren. Die FDA hat die Kombination Lenvatinib/Everolimus am 13. Mai 2016 auf Basis der Phase-II-Daten für Patienten mit fortgeschrittenem RCC nach antiangiogener Vortherapie zugelassen.
Neue Substanzen in der zweiten Therapielinie
Die neuen Substanzen haben im letzten Jahr zu einem Umdenken in der Zweitlinientherapie geführt. Die Aktivität von Everolimus in dieser Situation ist laut Powles unbestritten; sein Stellenwert ist aber durch die neuen Entwicklungen geringer geworden. Laut Powles sollten Nivolumab und Cabozantinib heute bevorzugt eingesetzt werden. Auch Dr. Laurence Albiges, Villejuif, geht davon aus, dass Checkpoint-Blocker und die neuen TKI künftig verstärkt in der Zweitlinientherapie verwendet werden und die bisherigen Standards Axitinib, Everolimus und Sorafenib in die dritte Therapielinie rutschen werden.
Management von Hirnmetastasen
„Die Disseminierung eines Tumors in das Gehirn ist ein relevantes Ereignis im Leben eines Krebspatienten“, gab Dr. Vincent Khoo, London, zu bedenken. Hirnmetastasen, die bei 5–20 % aller RCC-Patienten auftreten, rufen neurologische Symptome hervor, beeinträchtigen so die Lebensqualität und verkürzen das Überleben. Als Therapiemodalitäten stehen Chirurgie, Ganzhirnbestrahlung (WBRT, „whole brain radiotherapy“), Radiochirurgie und die systemische Therapie z.B. mit TKI zur Verfügung. Lange Zeit galt die WBRT, die zwischen 1970 und 1995 in mehreren Studien bei rund 2.600 Patienten mit unterschiedlichen soliden Tumoren evaluiert wurde, als Standard bei ZNS-Metastasen. Sie führt bei rund drei Viertel der Patienten zu einer symptomatischen Besserung; doch hält der Effekt median nur 8–12 Wochen an.
In mehreren nach 1990 durchgeführten Studien wurde die alleinige WBRT oder die alleinige stereotaktische Radiochirurgie (SRS) mit der Kombination beider Maßnahmen verglichen. Während mit der SRS eine verbesserte lokale Kontrolle der primären ZNS-Metastase erreicht wird, lassen sich mit der WBRT weitere Hirnmetastasen verhindern; dafür muss allerdings eine Verschlechterung der neurokognitiven Funktion in Kauf genommen werden. Operation und SRS führen laut Khoo zu vergleichbaren lokalen Kontrollraten. Lebensqualität oder OS werden durch die Chirurgie aber nicht verbessert; zudem geht sie mit einer nicht unerheblichen perioperativen Morbidität einher.
Stellenwert der systemischen Therapie unklar
Inwieweit TKI durch die Blut-Hirn-Schranke in das ZNS penetrieren, ist nicht ganz klar. Präklinischen Daten zufolge gelangen Sorafenib und Sunitinib in gesundes Hirngewebe. Doch ist ungewiss, ob sich dies auf Patienten mit ZNS-Metastasen übertragen lässt, erklärte Dr. Ana Molina, New York. In den TKI-Zulassungsstudien waren diese Patienten ausgeschlossen. Erfahrungen hierzu liegen nur aus den „Expanded access“-Programmen (EAP) mit Sunitinib (n=213) und Sorafenib (n=50) vor. Unter Sunitinib wurden eine Ansprechrate von 12 % , eine Stabilisierungsrate von 52 % , ein PFS von 5,6 Monaten und ein OS von 9,2 Monaten erreicht.7 Im Falle von Sorafenib lag die Ansprechrate bei 4 % , die Stabilisierungsrate bei 68 % .8 Das Toxizitätsprofil der TKI war in beiden EAP akzeptabel, betonte Molina.
Basierend auf den vielversprechenden Daten wurde eine Phase-II-Studie mit Sunitinib bei Patienten mit inoperablen ZNS-Metastasen (>2cm) initiiert.9 Doch war die Zeit bis zum Progress in dieser Studie mit nur 2,3 Monaten kurz; auch das OS fiel mit 6,9 Monaten kürzer aus als im EAP. Zudem wurde nur eine komplette Remission außerhalb des ZNS dokumentiert, sodass die Studie wegen mangelnder Effektivität gestoppt wurde.
Kürzlich wurden Empfehlungen für das Management von RCC-Patienten entwickelt, die den hohen Stellenwert lokaler Maßnahmen bei ZNS-Metastasierung betonen. Bei fitten Patienten mit solitären Metastasen sprechen sich die Experten für die Radiochirurgie oder die Resektion mit oder ohne Bestrahlung aus. Bei Patienten mit multiplen ZNS-Metastasen und Patienten, die für eine Resektion nicht geeignet sind, wird dagegen die WBRT empfohlen.
Als wichtig bezeichnete auch Khoo die Selektion von Patienten für die geeignete Therapie. Einer SRS sollten in erster Linie Patienten mit einer solitären ZNS-Metastase zugeführt werden, die einen guten Karnofsky-Performance-Status (≥70 % ) haben, <65 Jahren alt sind und deren Primärtumor gut kontrolliert ist. In dieser Gruppe stellt die SRS nach seinen Worten eine gute Therapieoption mit geringerer Morbidität als die Chirurgie dar.
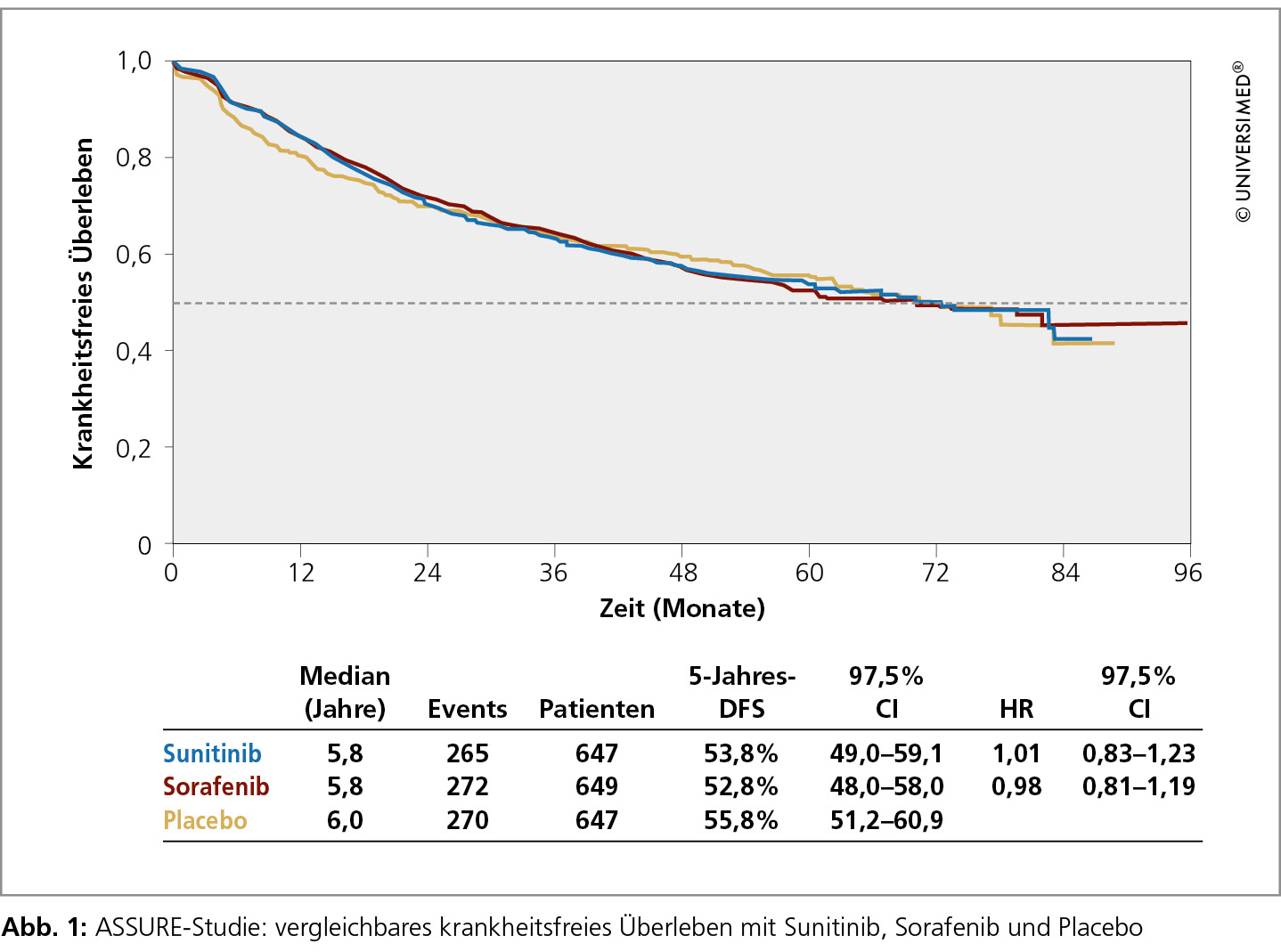
Adjuvante Therapie bislang nicht erfolgreich
Derzeit laufen 6 Studien mit TKI und Everolimus zur adjuvanten Therapie des RCC, die Prof. Dr. Tim Eisen, Cambridge, aufgrund der großen Patientenzahlen als aussagekräftig wertete. Eingeschlossen wurden Patienten mit intermediärem bzw. hohem Risiko. Ergebnisse liegen bislang nur aus der ASSURE-Studie vor, die die einjährige Therapie mit Sorafenib oder Sunitinib bei fast 2.000 Patienten versus Placebo verglich.10 „Die Studie ging negativ aus: Das krankheitsfreie Überleben als primärer Endpunkt war mit median 5,8 bis 6 Monaten in allen 3 Armen vergleichbar“, berichtete Eisen. Zwar gab es initial eine leichte Trennung der Ereigniskurven zugunsten der TKI (Abb. 1). Bei längerem Follow-up zeigte sich jedoch ein gegenteiliger Effekt mit einem besseren Ergebnis im Placeboarm, was Eisen als „beunruhigend“ bezeichnete. Auch die OS-Kurven überlagern sich; die 5-Jahres-Raten sind mit 77–81 % sehr ähnlich.
Eisen wies darauf hin, dass die TKI von zahlreichen ASSURE-Teilnehmern schlecht vertragen wurden, die Therapie daher oft in reduzierter Dosis initiiert wurde. In dieser Subgruppe erwiesen sich die TKI im Vergleich zu Placebo tendenziell sogar als deletär. In den übrigen Subgruppen gab es keine Unterschiede zwischen Verum und Placebo. Aufgrund der negativen ASSURE-Daten hält Eisen es für unwahrscheinlich, dass die noch laufenden adjuvanten Studien mit Sunitinib, Pazopanib oder Axitinib – jeweils über ein Jahr – positive Ergebnisse liefern werden. Als mögliche Ausnahmen nannte er lediglich die S-TRACT-Studie, die Sunitinib in einem RCC-Hochrisikokollektiv untersucht, und die SORCE-Studie, die die ein- mit der 3-jährigen Sorafenib-Therapie vergleicht. Abzuwarten bleibt auch das Resultat der EVEREST-Studie zur adjuvanten Therapie mit Everolimus.
1 Choueiri T et al: N Engl J Med 2015; 373: 1814-23
2 Escudier B et al: ASCO-GU 2016; Abstr. 499
3 Motzer R et al: N Engl J Med 2015; doi: 10.1056/NEJMoa1510665
4 Molina A et al: Cancer Chemother Pharmacol 2014; 73: 181-9
5 Motzer R et al: Lancet Oncol 2015; 16: 1473-82
6 Motzer R et al: Lancet Oncol 2016; 17: e4-5
7 Gore M et al: Lancet Oncol 2009; 10: 757-63
8 Stadler WM et al: Cancer 2010; doi: 10.1002/cncr24864
9 Chevreau C et al: Clin Genitourin Cancer 2014; 12: 30-4
10 Haas NB et al: J Clin Oncol 2015; 33(Suppl 7): Abstr. 403
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...


