Tyrosinkinase-Inhibition bleibt wichtig
Autor:innen:
Dr. Robert Wurm
Leitung der pulmologischen Ambulanz und Endoskopie
Klinische Abteilung für Lungenkrankheiten
Universitätsklinik für Innere Medizin (UKIM)
Medizinische Universität Graz
Ass. Dr. Lea Baumgartner
Univ.Klinik für Innere Medizin
LKH Univ.-Klinikum Graz
Korrespondenz:
E-Mail: robert.wurm@klinikum-graz.at
Lungenkrebs ist eine der häufigsten Tumorerkankungen und die häufigste Ursache tumorassozzierter Todesfälle weltweit.1 Eingeteilt werden Lungenkarzinome nach den unterschiedlichen histopathologischen Erscheinungsbildern in kleinzellige (SCLC) und nichtkleinzellige Karzinome (NSCLC). Mit rund 80–85% machen die nichtkleinzelligen Lungenkarzinome die deutliche Mehrheit aus,2 wobei es hier nochmals zwischen Adeno- und Plattenepithelkarzinomen zu unterscheiden gilt.
Die Erstdiagnose von Lungenkrebs erfolgt nicht selten in fortgeschrittenen Stadien und, damit einhergehend, in Verbindung mit einer schlechten Prognose.2 Behandlungskonzepte sind vielseitig und beinhalten neben operativen Verfahren auch Radio-, Chemo- und/oder Immuntherapie.
Daneben gelingt es immer besser, durch mittlerweile etablierte Verfahren, wie das „next-generation sequencing“ (NGS), spezifische Biomarker zu identifizieren und Patient:innen mit diesen molekularpathologischen Merkmalen einer zielgerichteten medikamentösen Therapie mit monoklonalen Antikörpern und/oder Tyrosinkinase-Inhibitoren (TKI) zuzuführen.3 Die reflektorische Biomarkertestung sollte bei Erstdiagnose (inbesondere bei Adenokarzinomen) unabhängig vom Erkrankungsstadium direkt bei Diagnosestellung erfolgen.16
Klinische Erfahrungen und Studiendaten der letzten Jahre haben gezeigt, dass zielgerichtete Therapien nicht nur gut verträgliche, sondern auch Erfolg versprechende Therapieoptionen sind. Der Einsatzbereich der TKI erweitert sich daher stetig. Im Nachfolgenden erwartet Sie ein kurzer Überblick über die diesjährigen Highlights im Bereich der zielgerichteten Tumortherapie bei nichtkleinzelligen Lungenkarzinomen (NSCLC).
EGFR-Mutation
Die Mutation von EGFR (insbesondere L858R Exon 19-del) ist mit rund 23% eine der häufigsten Treibermutationen bei NSCLC.4,8 Bereits nach Publikation der FLAURA-Studie im Jahr 20185 hat Osimertinib als oraler TKI Einzug in die zielgerichtete Krebstherapie gehalten und ist nach wie vor die Therapie der Wahl bei fortgeschrittenem NSCLC mit EGFR-Mutation.6
Nach Präsentation der Ergebnisse der Studien FLAURA2 und MARIPOSA am ESMO-Jahrestreffen 2023 werden vermutlich auch neue Therapieschemata Einzug in die Erstlinientherapie halten.
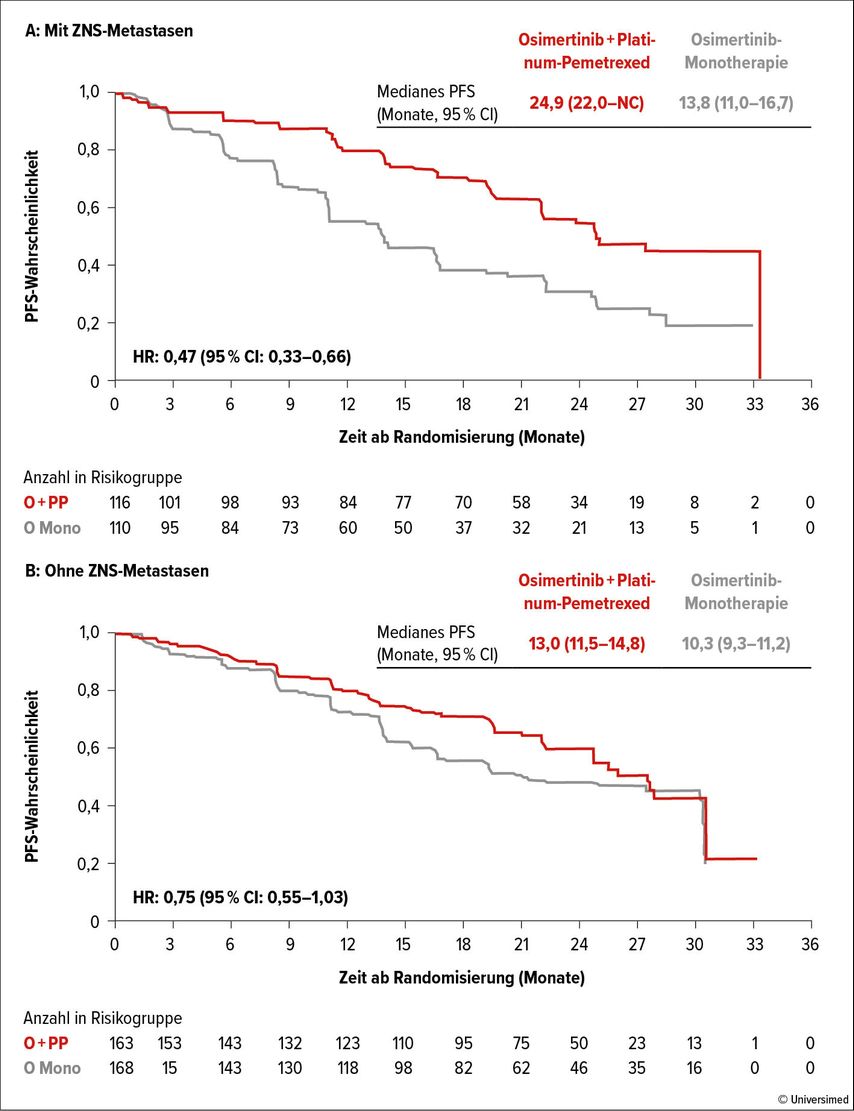
Die Daten der FLAURA2-Studie mit Gegenüberstellung einer Osimertinib-Monotherapie (80mg/d) mit einer Kombination aus Chemotherapie(Pemetrexed+Cis- oder Carboplatin)+TKI(Osimertinib 80mg/d) in der Erstlinientherapie demonstrieren einen klaren Vorteil der Kombinationstherapie mit einer signifikanten Verlängerung des progressionsfreien Überlebens in der Chemotherapie+TKI-Gruppe (medianes PFS: 25,5 vs. 16,7 Monate; HR: 0,62). Die Überlegenheit der Kombinationstherapie zeigte sich über alle Subgruppen hinweg, wobei besonders Patient:innen mit ZNS-Metastasen zu profitieren scheinen (PFS: 24,9 vs. 13,8 Monate; Abb. 1).7
Abb. 1: Studie FLAURA2: Überlebensvorteil unter Osimertinib+Chemotherapie insbesondere bei zerebralen Metastasen. Modifiziert nach Jänne P et al.7
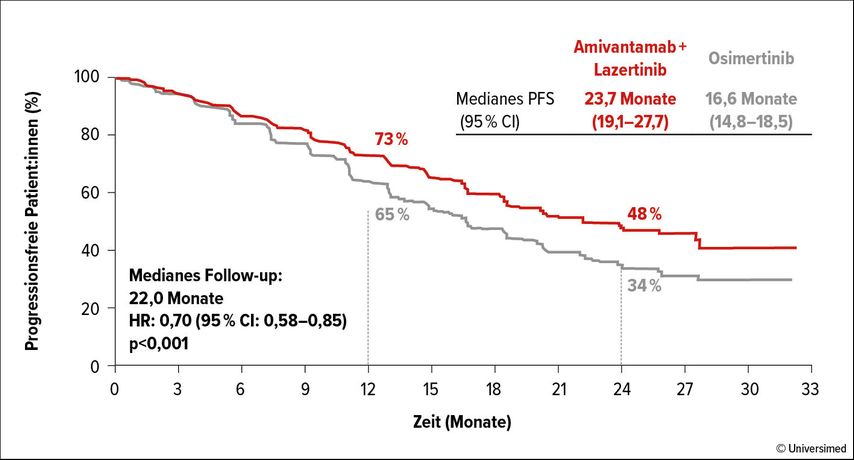
Ebenso vielversprechende Ergebnisse lieferte die MARIPOSA-Studie.9 Hier wurde in einer randomisierten, kontrollierten Phase-III-Studie eine Monotherapie mit Osimertinib mit einer Monotherapie mit Lazertinib (hochselektiver, ZNS-gängiger Drittgenerations-EGFR-TKI) als auch mit einer Kombinationstherapie mit Lazertinib+Amivantanab (EGFR-MET bispezifischer Antikörper) verglichen. Die Ergebnisse zeigen einen klaren Vorteil der Kombinationstherapie (Amivantanab+Lazertinib) gegenüber Osimertinib alleine (medianes PFS: 23,7 vs. 16,6 Monate; HR 0,70; Abb. 2). Auch hier konnte der Überlebensvorteil in allen Subgruppen gezeigt werden, inklusive derjenigen mit ZNS-Metastasen. Die beiden TKI-Monotherapien (Osimertinib vs. Lazertinib) lieferten hingegen nahezu idente PFS-Daten.9
Abb. 2: Studie MARIPOSA: PFS-Vorteil von Amivantanab+Lazertinib vs. Osimertinib. Modifiziert nach Cho BC et al.9
In beiden Studien waren die Nebenwirkungen allesamt überschaubar, wenn auch die Kombinationsgruppen insgesamt etwas höhere Nebenwirkungsraten aufwiesen.7,9
Besonders hervorzuheben ist jedoch ein signifikant häufigeres Auftreten von venös-thrombembolischen Ereignissen unter Amivantanab+Lazertinib. In Zukunft wird daher bei Anwendung dieses Therapieregimes eine prophylaktische Antikoagulation in den ersten 4 Therapiemonaten empfohlen.9
Bei fortgeschrittenem NSCLC mit EGFR-Mutation ist die Therapieentscheidung im Erstlinien-Setting derzeit meist klar. Herausfordernd wird es bei Progress der Tumorerkrankung unter einer laufenden TKI-Therapie. Resistenzmechanismen spielen hier eine Rolle.6 Die Studie MARIPOSA-2 liefert nun erste Daten für Patient:innen mit Tumorprogress unter Osimertinib, indem sie eine alleinige Chemotherapie im Zweitlinien-Setting einer Therapie mit Amivantamab+Chemotherapie (+/– Lazertinib) gegenüberstellt.10
Es zeigte sich erstmals ein verlängertes PFS durch Zugabe von Amivantanab (+/– Lazertinib) vs. alleinige Chemotherapie in der Zweitlinientherapie des NSCLC mit EGFR-Mutation (medianes PFS: 12,5 vs. 8,3 Monate bzw. 12,8 vs. 8,3 Monate [+Lazertinib]).10 Anzumerken ist auch hier die höhere Rate an (insbesondere hämatologischen) Nebenwirkungen bei konkomitanter Gabe von Kombinationstherapie (Chemotherapie+Amivantanab+Lazertinib).10
KRAS-Mutation
Neben EGFR-Mutationen bilden KRAS-Mutationen die zweithäufigste Gruppe an detektierten Biomarkern bei NSCLC,8 wobei Nikotinabusus einen typischen Risikofaktor für das Auftreten einer KRAS-Mutation darstellt. Am häufigsten betrifft die Mutation das Codon 12 (hier mit 40% die Alteration G12C, gefolgt von G12V und G12D).11
Viele Jahre gab es keine spezifische Therapie bei Vorliegen einer KRAS-Mutation. Den Umbruch brachte die Studie CodeBreaK 100. Sie führte 2021 zu einer Zulassung von Sotorasib, einem spezifischen KRAS-G12C-Inhibitor, in der Zweitlinientherapie bei NSCLC mit KRAS-G12C-Mutation.2
In der am WCLC 2023 präsentierten und aktuell noch laufenden Nachfolgestudie CodeBreaK 101 („Open label“-Phase-Ib-Studie) werden Effektivität und Sicherheit von Sotorasib in Kombination mit einer Chemotherapie (Carboplatin+Pemetrexed) im Setting der Erst- und Zweitlinientherapie untersucht. Die Gesamtansprechrate, unabhängig von der PD-L1-Expression, beträgt in der Erstlinientherapie 65%, in der Zweitlinientherapie 54%.12
ALK-Mutation
ALK-Fusionen betreffen meist junge Nichtraucher:innen, die häufigste nachgewiesene Translokation ist EML4-ALK.17 Glücklicherweise weisen die ALK-TKI-Therapien eine hocheffektive Wirkung auf, was mittlerweile bei fortgeschrittenem NSCLC mit ALK-Mutation zu einer Zulassung von fünf ALK-Inhibitoren in der Erstlinientherapie geführt hat (aktuell in Österreich: Alectinib, Brigatinib, Ceritinib, Crizotinib, Lorlatinib).2,18
Obwohl bei NSCLC mit EGFR-Mutation seit Publikation der ADAURA-Daten die adjuvante Therapie mit Osimertinib gut etabliert ist,14 gab es für ALK-positive Patien:innen bislang keine Empfehlungen für eine postoperative TKI-Therapie. Nach Präsentation der ALINA-Daten am ESMO-Jahrestreffen 2023 könnte sich dies aber ändern. Verglichen wurde hier die zweijährige adjuvante TKI-Therapie (Alectinib 600mg/d) mit der derzeitigen postoperativen Standard-Chemotherapie (vier Zyklen platinbasiert) in den Stadien IB–IIIA.
Unabhängig vom Erkrankungsstadium konnte ein deutlicher Benefit der adjuvanten TKI-Therapie gezeigt werden (medianes PFS im Alectinib-Arm nicht erreicht vs. 44 Monate im Chemotherapie-Arm; HR: 0,24).15 Eine Zulassung im adjuvanten Therapiesetting wird zukünftig auch bei NSCLC mit ALK-Mutation erwartet.
Während wir bis dato bei TKI-Therapien immer von fortgeschrittenen Stadien oder adjuvanten Therapiesettings sprachen, so werden zielgerichtete Therapien zukünftig auch im neoadjuvanten Setting Anwendung finden. Als Beispiel wurden am WCLC die ersten Daten der Studie NAUTIKA1 präsentiert. Hier wurden insgesamt zwölf ALK-positive NSCLC-Patient:innen in den Tumorstadien IB–III acht Wochen neoadjuvant mit Alectinib (600mg 2x tgl.) behandelt. Nach anschließender Operation war der primäre Studienendpunkt die „major pathologic response“ (MPR) im OP-Resektat.
Zusammenfassend ist festzustellen, dass, bei einer insgesamt sehr kleinen Studienkohorte, bei neun Patient:innen das Ziel einer MPR erreicht werden konnte. Durch die Therapie wurde in keinem der Fälle die Operation hinausgezögert, ebenso kam es bei insgesamt guter Verträglichkeit auch zu keinen schwerwiegenden therapieassoziierten Nebenwirkungen oder operativen Komplikationen.13
Conclusio und Aussicht
TKI-Therapien sind zukunftsträchtig und werden bald auch den Bereich der adjuvanten und neoadjuvanten Therapiesettings erobern. Daneben stehen durch neue Kombinationstherapien noch mehr vielversprechende Therapieansätze zur Verfügung. Höhere Ansprechraten, gute Tumorkontrolle und aussichtsvolle Langzeitergebnisse werden die Folge sein. Die gute Verträglichkeit ermöglicht außerdem eine gute Therapieadhärenz.
Dennoch gilt es umso mehr, eventuelle Nebenwirkungen, insbesondere bei Kombinationstherapien, zu erkennen und entsprechend zu behandeln. Für 2024 hoffen wir auf weitere spannende Daten und auch neue Zulassungen im Bereich der TKI-Therapien.
Literatur:
1 Siegel RL et al.: Cancer statistics, 2022. CA Cancer J Clin 2022; 72(1): 7-33 2 Guo H et al.: Biomarker-targeted therapies in non–small cell lung cancer: current status and perspectives. Cells 2022; 11(20): 3200 3 Soo R et al.: Scientific advances in thoracic oncology 2016. J Thorac Oncol 2017; 12(8): 1183-209 4 Rotow J, Bivona TG: Understanding and targeting resistance mechanisms in NSCLC. Nat Rev Cancer 2017; 17(11): 637-58 5 Soria JC et al.: Osimertinib in untreated EGFR-mutated advanced non–small-cell lung cancer. N Engl J Med 2018; 378(2): 113-25 6Passaro A et al.: ESMO expert consensus statements on the management of EGFR mutant non-small-cell lung cancer. Ann Oncol 2022; 33(5): 466-87 7 Jänne P et al.: Osimertinib with/without platinum-based chemotherapy as first-line treatment in patients with EGFRm advanced NSCLC (FLAURA2). WCLC 2023; Abstr. #PL03.13 8 Heydt C et al.: Novel approaches against epidermal growth factor receptor tyrosine kinase inhibitor resistance. Oncotarget 2018; 9(20): 15418-34 9 Cho BC et al.: MARIPOSA: phase 3 study of first-line amivantamab + lazertinib versus osimertinib in EGFR-mutant non-small-cell lung cancer. Future Oncol 2022; 18(6): 639-47 10 Passaro A et al.: MARIPOSA-2: Investigators. Amivantamab plus chemotherapy with and without lazertinib in EGFR-mutant advanced NSCLC after disease progression on osimertinib: primary results from the phase III MARIPOSA-2 study. Ann Oncol 2024; 35(1): 77-90 11 Cascetta P et al.: KRAS in NSCLC: state of the art and future perspectives. Cancers 2022; 14(21): 5430 12 Clarke JM et al.: MA06.05: CodeBreaK 101: Safety and efficacy of sotorasib with carboplatin and pemetrexed in KRAS G12C-mutated advanced NSCLC. J Thorac Oncol 2023; 18(Suppl. 11): S118-913 Lee JM et al.: Phase II NAUTIKA1 study of targeted therapies in stage II–III NSCLC: preliminary data of neoadjuvant alectinib for ALK+ NSCLC. WCLC 2022; Poster #EP02.04-005 14Herbst RS et al.: Adjuvant osimertinib for resected EGFR-mutated stage IB-IIIA non-small-cell lung cancer: updated results from the phase III randomized ADAURA trial. J Clin Oncol 2023; 41(10): 1830-40. Erratum in: J Clin Oncol 2023; 41(22): 3877 15 Solomon BJ et al.: ALINA: aphase III study of alectinib versus chemotherapy as adjuvant therapy in patients with stage IB–IIIA anaplastic lymphoma kinase-positive (ALK+) non-small cell lung cancer (NSCLC). J Clin Oncol 2019; 37(Suppl. 15): TPS8569 16Cheema PK et al.: Consensus recommendations for optimizing biomarker testing to identify and treat advanced EGFR-mutated non-small-cell lung cancer. Curr Oncol 2020; 27(6): 321-9 17 Franco R et al.: Anaplastic lymphoma kinase: a glimmer of hope in lung cancer treatment? Expert Rev Anticancer Ther 2013; 13(4): 407-20 18Onkopedia: Lungenkarzinom, nicht-kleinzellig (NSCLC). November 2022; Online unter https://www.onkopedia.com/de/onkopedia/guidelines/lungenkarzinom-nicht-kleinzellig-nsclc/@@guideline/html/index.html#ID0EV5BG
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...