Tumor-agnostische Therapie in der Onkologie
Autor:
Prof. Dr. med. Dr. phil. nat. Markus Jörger
Leitung Klinische Forschungsabteilung
Departement Innere Medizin
Klinik für Medizinische Onkologie & Hämatologie
Kantonsspital St. Gallen
E-Mail: markus.joerger@kssg.ch
Molekular-zielgerichtete und Tumor-agnostische Therapien versprechen, die Onkologie weiterzubringen. Wir betrachten die errungenen Fortschritte, das zukünftige Potenzial dieser Therapien und mögliche Hürden bei der Umsetzung in den klinischen Alltag.
Keypoints
-
Tumor-agnostische Therapien sind aus der individualisierten Tumortherapie hervorgegangen und sie unterstreichen den interdisziplinären Charakter der Onkologie
-
Tumor-agnostische Therapien werden neben «Entitäts-spezifischen» Therapien bestehen und die Algorithmen von onkologischen Therapien werden nochmals wesentlich an Komplexität zunehmen.
-
Es gibt noch einige Hürden auf dem Weg zu einer breiteren individualisierten Tumortherapie. Insbesondere der breite Zugang zu breiten Mutationspanels, die Interpretation seltener und komplexer molekulargenetischer Resultate sowie regulatorische Aspekte müssen gelöst werden.
Die Tumor-agnostische onkologische Therapie ist ein Terminus, der aus der Weiterentwicklung der individualisierten Tumortherapien hervorgegangen ist. Für Letztere wurden verschiedene Begriffe bemüht, beginnend mit «(molekular-)zielgerichteter Therapie» als Gegenpol zur weniger zielgerichteten Chemotherapie sowie der «Präzisions-Onkologie» und der individualisierten Tumortherapie. Der Paradigmenwechsel hin zur «Tumor-agnostischen» Therapie ist schliesslich ein kleiner, wenn auch bedeutender im Hinblick auf Arzneimittelzulassungen, welche Tumorentitäten zunehmend molekulargenetisch und nicht mehr histomorphologisch betrachten.
Der Enthusiasmus des Onkologen soll aber nicht darüber hinwegtäuschen, dass die anatomische und histomorphologische Tumorentität für unsere Therapiealgorithmen immer noch die weitaus grösste Bedeutung hat. Das Tumor-agnostische Denken hat jedoch zunehmenden Einfluss auch auf die interdisziplinäre Zusammenarbeit der Fachbereiche, und es weist den Interaktionen zwischen dem Onkologen und dem Molekularpathologen eine zunehmend grösser werdende Bedeutung zu. Ich werde im Folgenden einen kurzen Überblick über den aktuellen Stand der Tumor-agnostischen onkologischen Therapie geben.
Quantensprung durch molekular-zielgerichtete onkologische Therapien
Von den klassischen Chemotherapeutika kennen wir eine sigmoidale Dosis-Wirkungs-Beziehung sowie eine sigmoidale – oder in weiten Bereichen sogar lineare – Dosis-Toxizitäts-Beziehung, zumindest bezüglich einer Myelosuppression. Es gingen einige Jahre ins Land bis zur Erkenntnis, dass die Dosisoptimierung der Chemotherapeutika nicht über den Umstand hinwegtäuschen konnte, dass die Chemosensitivität der Tumoren sehr unterschiedlich ist und dass auch das Toxizitätsspektrum zwischen den Patienten gross ist. Teils liess sich dies durch pharmakogenetische Faktoren wie z.B. DPYD (Dihydropyrimidin-Dehydrogenase-Defizienz) bei Fluoropyrimidinen erklären, häufig blieb es jedoch unerklärt. Damit war die Onkologie mit dem Problem konfrontiert, dass Patienten teils auf Chemotherapie ansprechen und nur milde Toxizität erfahren, teils aber auch nicht ansprechen und trotzdem schwere Toxizität erleiden.
Ich kann mich gut erinnern, als im Jahr 2000 alle von «STI751» (später Imatinib) und der «grossen Wende» in der Onkologie sprachen. Natürlich haben wir das Problem onkologischer Erkrankungen in den letzten 20 Jahren nicht gelöst, die molekulare Orphanisierung und Therapie mit molekular- zielgerichteten Tyrosinkinaseinhibitoren (TKI) respektive monoklonalen Antikörpern hat dennoch zu einer substanziellen Verbesserung der onkologischen Therapien geführt. Auch der Ruf onkologischer Therapiemöglichkeiten hat sich wohl verbessert, wenn auch massgeblich durch den Durchbruch in der Immuntherapie.
Welche Tools sind für eine Tumor-agnostische Therapie notwendig?
Imatinib und CML (chronische myeloische Leukämie) waren insofern ein «Glücksfall», als das BCR-ABL-Gen weitgehend ubiquitär in CML-Zellen als kausale Krankheitsursache zu finden ist. Bei den EGFR-TKI und dem Bronchialkarzinom wurde die Sache schon schwieriger, so wurden die aktivierenden EGFR-Mutationen und deren prädiktiver Nutzen bei dieser Tumorentität erst nach Zulassung der EGFR-TKI beim Bronchialkarzinom beschrieben. Heute setzen wir die EGFR-TKI ausschliesslich bei Bronchialkarzinompatienten mit aktivierenden EGFR-Mutationen ein. Seither ist das bronchiale Adenokarzinom zum Paradebeispiel der molekularen Orphanisierung und molekular zielgerichteten Therapiemöglichkeiten geworden. Bei asiatischen Patienten mit dieser Erkrankung sollten durchschnittlich zwei Drittel einer molekular-zielgerichteten Therapie zugeführt werden können (exklusive PD-L1 ≥50% und Immuncheckpoint-Inhibitoren).
Neben der Identifizierung molekulargenetischer – sogenannter «drugable» – Alterationen waren jedoch weitere technische Fortschritte notwendig, um einen breiten Einsatz molekular-zielgerichteter Therapien zu ermöglichen. Dazu gehören vor allem die Skalierung moderner Sequenzierungsmethoden, die Markteinführung erschwinglicher Sequenzierungs-Plattformen («Moore’s law»), die Kombination von Mutations-/Amplifikations-/Fusions-Diagnostik («next-generation sequencing») sowie Softwarelösungen zur Diagnostik und Interpretation seltener oder komplexer genetischer Alterationen. Kürzlich haben etliche grössere Gesundheitsinstitutionen der Schweiz sogenannte molekulare Tumorboards etabliert, um der gesamten diagnostischen Kette und Komplexität der Interpretation genetischer Alterationen und Therapieempfehlungen Rechnung zu tragen.
Wann ist ein Tumor-agnostischer Ansatz sinnvoll, und welche Tumor-agnostischen Therapien stehen uns zur Verfügung?
Voraussetzung für die Tumor-agnostische Therapie ist das Vorhandensein eines prädiktiven Biomarkers, der das Therapieansprechen unabhängig von Tumorentität und Tumorhistologie voraussagen kann. Das entsprechende Onkologikum hat also eine vergleichbare pharmakologische Wirkung in «Biomarker-positiven» Tumoren. Dies schliesst nicht aus, dass die Wirksamkeit trotz Vorhandensein des Biomarkers über die Tumorentitäten etwas variiert; ein klassisches Beispiel sind BRAF-mutierte kolorektale Tumoren, bei welchen die BRAF-TKI keinen nachhaltigen Effekt haben. Natürlich ist es eine wichtige Voraussetzung für die Tumor-agnostische Therapie, dass der Biomarker zuverlässig detektiert werden kann respektive dass die entsprechenden Tests validiert und zugänglich sind.
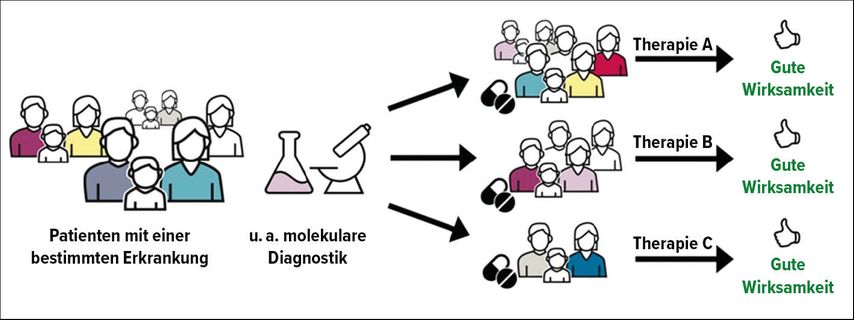
Abb. 1: Die individualisierte Tumortherapie macht sich Patienten- und Tumor-spezifische Faktoren zunutze, um einem möglichst grossen Anteil eine wirksame Therapie zukommen zu lassen. Die molekulare Diagnostik im Tumorgewebe spielt dabei eine grosse Rolle
Im Gegensatz zu vielen gängigen molekular-zielgerichteten Therapien, welche längst in die Onkologie eingeführt wurden, geht die erste von der FDA (Federal Drug Administration) in den USA zugelassene Tumor-agnostische onkologische Therapie auf das Jahr 2017 zurück, als der anti-PD-1-monoklonale Antikörper Pembrolizumab bei Mikrosatelliten-instabilen Tumoren (MSI-H) zugelassen wurde. 2018 folgte der orale NTRK-TKI Larotrectinib bei NTRK-Fusions-positiven Tumoren, 2019 der orale NTRK-TKI Entrectinib bei NTRK-Fusions-positiven Tumoren und 2020 schliesslich Pembrolizumab bei Tumoren mit hoher Mutationslast (≥10 Mutationen/Megabase) – bei all diesen handelt es sich um FDA-Zulassungen.
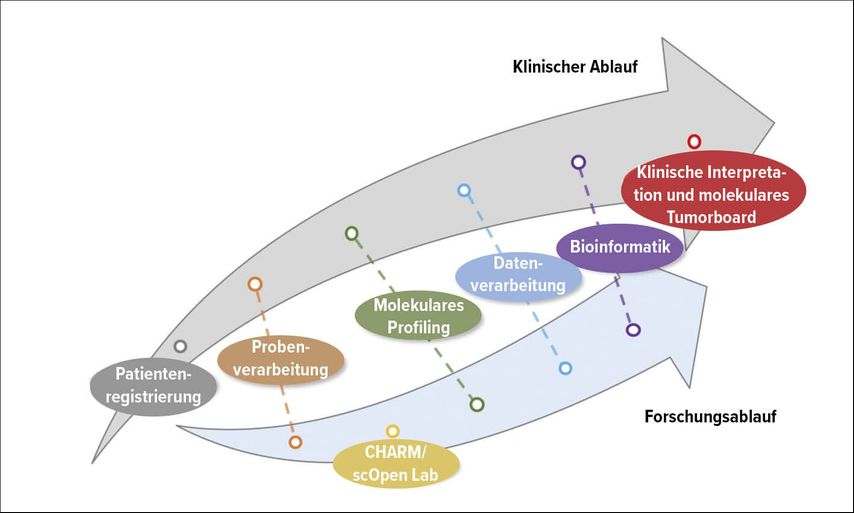
Abb. 2: Die molekulare Diagnostik bedingt eine enge Zusammenarbeit zwischen Pathologie und onkologischen Fachbereichen. Insbesondere die Interpretation seltener und/oder komplexer genetischer Alterationen sowie der Zugang zu entsprechenden zielgerichteten Therapien stellen eine Herausforderung dar
Was sagt uns die Datenlage bezüglich individualisierter Tumortherapien?
Bevor wir zu enthusiastisch werden, ist es wichtig, die aktuelle Datenlage zur individualisierten Tumortherapie Revue passieren zu lassen. Natürlich erhalten Tumor-agnostische onkologische Therapien nur eine Zulassung, nachdem ihre Wirksamkeit in klinischen Studien belegt worden ist. Zumindest die FDA akzeptiert hierbei auch nicht randomisierte Studien, vorausgesetzt die biologische Rationale (Biomarker/zielgerichtete Therapie) ist gegeben und die Wirksamkeit der neuen Therapie ist «hoch».
Das übergeordnete Ziel von uns Onkologen und akademischen Gruppen bleibt es aber, möglichst vielen unserer Patienten eine solche molekular-zielgerichtete, individualisierte, effiziente Therapie zu ermöglichen, wobei es trotz der überragenden Bedeutung der Thematik bis dato nur eine randomisierte Studie dazu gibt (die französische SHIVA-Studie). Insgesamt kommt man nicht umhin zu erwähnen, dass breite Initiativen zur individualisierten Tumortherapie ernüchternde Resultate erbracht haben.
Schwaederle et al. zeigten in einer Metaanalyse onkologischer Phase-I-1 und Phase-II-Studien2 eine Superiorität individualisierter Therapien bezüglich radiologischen Ansprechens, progressionsfreien Überlebens (PFS) und Gesamtüberleben (OS). Die erste Initiative des MD Anderson Cancer Center (MDACC) bei 1542 Tumorpatienten wurde 2014 von Tsimberidou et al. publiziert, wobei PFS und OS von Patienten, die eine molekular-zielgerichtete Therapie erhielten, leicht länger waren. Allerdings konnten nur 9% der ursprünglich eingeschlossenen Tumorpatienten einer solchen molekular-zielgerichteten Therapie zugeführt werden.3 Studien dieser Art sind zudem dem Bias ausgesetzt, dass prädiktive Biomarker häufig einen zusätzlichen (günstigen) prognostischen Wert aufweisen.
Die zweite MDACC-Initiative – IMPACT – schloss 3743 Tumorpatienten ein, von denen 19% einer molekular-zielgerichteten Therapie zugeführt werden konnten, wiederum verbunden mit einer leichten Verbesserung des radiologischen Ansprechens (16,2% versus 6,4%) und einer Verlängerung des PFS (4,0 versus 2,8 Monate) und OS (9,3 versus 7,3 Monate).4
Die erste wichtige französische Studie – MOSCATO – schloss 1110 Patienten ein, von denen 18% einer molekular-zielgerichteten Therapie zugeführt werden konnten, wobei ein Drittel dieser Patienten eine Verlängerung des PFS von mindestens 30% gegenüber der Vortherapie erzielte.5
Die einzige randomisierte Studie – SHIVA – verglich eine Tumorboard-empfohlene, zielgerichtete Therapie mit einer «empirischen» Therapie durch den Onkologen bei 293 Tumorpatienten mit molekularen Alterationen, welche zur damaligen Zeit als «drugable» galten.6 Dabei konnte SHIVA keine Verbesserung der Prognose durch molekular-zielgerichtete Therapien zeigen.
Zuletzt sei noch die grosse US-amerikanische NCI-MATCH-Initiative erwähnt, welche einen weniger «holistischen» Ansatz einnimmt und vielmehr neue Onkologika mit spezifischen molekulargenetischen Alterationen «matcht» und den Therapieerfolg einzeln untersucht. Hieraus sind mehrere erfolgreiche Therapien hervorgegangen, etwa Nivolumab bei «mismatch repair»-defizienten, nicht kolorektalen Tumoren,7 Capivasertib bei AKT1- E17K-mutierten Tumoren,8 Dabrafenib/Trametinib bei BRAFV600E-mutierten Tumoren9 oder Trametinib bei BRAFnonV600E-mutierten Tumoren.10
Wie können wir Tumor-agnostische Therapien in der Praxis umsetzen?
Etliche Voraussetzungen für eine erfolgreiche Umsetzung molekular-zielgerichteter Therapien bei unseren Patienten wurden zwar geschaffen, es bleiben aber noch einige Hürden zu nehmen. Zuerst müssen Patienten mit «drugable» molekularen Alterationen erkannt werden, d.h., interne Algorithmen zur Durchführung eines breiten molekularen Panels sollten in Absprache mit den Pathologen etabliert werden. Weiters kommt der Interpretation molekulargenetischer Resultate eine wichtige Bedeutung zu, und auch hier spielt die Interdisziplinarität Onkologie–Pathologie eine prioritäre Rolle. Das molekulare Tumorboard scheint hier ein gutes Instrument zu sein und wurde von etlichen grösseren Institutionen für diesen Zweck eingerichtet.
Zuletzt ist es mir ein Anliegen, auf die Problematik des Off-Label-Einsatzes onkologischer Therapeutika hinzuweisen, was ich auch in den breiteren Themenkreis der molekular-zielgerichteten Therapien ansiedle. Auch wenn in der Schweiz mit Artikel 71a eine Möglichkeit geschaffen wurde, Off-Label-Therapien für unsere Patienten verfügbar zu machen, muss doch auf die Schwierigkeiten diesbezüglich und den ungleichen Zugang zu solchen Therapien für unsere Patienten hingewiesen werden. Diesen Punkt hat die Arbeitsgruppe um Dr. med. Kasenda in einer kürzlich erschienenen Arbeit eindrücklich beschrieben.11 Dabei wurde unter 3046 PatientInnen der Onkologie an drei grösseren Schweizer Kliniken aufgezeigt, dass die Entscheidungen über den Zugang zu Off-Label-Use-Therapien von den entsprechenden Krankenkassen nicht auf Basis evidenzbasierter Daten gefällt wurden. Hier identifizieren wir ein Spannungsfeld zwischen wissenschaftlichem Forschritt und regulatorischen, versicherungsökonomischen Aspekten.
Literatur:
1 Schwaederle M et al: Association of biomarker-based treatment strategies with response rates and progression-free survival in refractory malignant neoplasms: ameta-analysis. JAMA Oncol 2016; 2(11): 1452-9 2 Schwaederle M et al: Impact of precision medicine in diverse cancers: a meta-analysis of phase II clinical trials. J Clin Oncol 2015; 33(32): 3817-25 3 Tsimberidou AM et al.: Personalized medicine for patients with advanced cancer in the phase I program at MD Anderson: validation and landmark analyses. Clin Cancer Res 2014; 20(18): 4827-36 4 Tsimberidou AM et al.: Long-term overall survival and prognostic score predicting survival: the IMPACT study in precision medicine. J Hematol Oncol 2019; 12(1): 145 5 Massard C et al.: High-throughput genomics and clinical outcome in hard-to-treat advanced cancers: results of the MOSCATO 01 trial. Cancer Discov 2017; 7(6): 586-95 6 Le Tourneau C et al.: Molecularly targeted therapy based on tumour molecular profiling versus conventional therapy for advanced cancer (SHIVA): a multicentre, open-label, proof-of-concept, randomised, controlled phase 2 trial. Lancet Oncol 2015; 16(13): 1324-34 7 Azad NS et al.: Nivolumab is effective in mismatch repair-deficient noncolorectal cancers: results from arm Z1D-A subprotocol of the NCI-MATCH (EAY131) study. J Clin Oncol 2020; 38(3): 214-22 8 Kalinsky K et al.: Effect of capivasertib in patients with an AKT1 E17K-mutated tumor: NCI-MATCH subprotocol EAY131-Y nonrandomized trial. JAMA Oncol 2021; 7(2): 271-8 9 Salama AKS et al.: Dabrafenib and trametinib in patients with tumors with BRAF(V600E) mutations: results of the NCI-MATCH trial subprotocol H. J Clin Oncol 2020; 38(33): 3895-904 10 Johnson DB et al.: Trametinib activity in patients with solid tumors and lymphomas harboring BRAF Non-V600 mutations or fusions: results from NCI-MATCH (EAY131). Clin Cancer Res 2020; 26(8): 1812-9 11 Herbrand AK et al.: Association of supporting trial evidence and reimbursement for off-label use of cancer drugs. JAMA Netw Open 2021; 4(3): e210380
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...