Tripeltherapie, Olaparib und Niraparib beim Prostatakarzinom
Die Zukunft der Therapie des Prostatakarzinoms ist vielfältig: Neben Konzepten der Kombinationstherapie, aufbauend auf Androgendeprivation, werden auch Therapieprotokolle erprobt, die ursprünglich auf molekularer Charakterisierung der Patienten beruhen. Einigen dieser Therapien und respektive relevanten Studien widmete sich das Genitourinary Cancers Symposium 2022 der American Society of Clinical Oncology (ASCO), das in San Francisco stattfand. Im Fokus stand die Behandlung von Männern mit metastasiertem hormonsensitivem Prostatakarzinom oder metastasiertem kastrationsresistentem Prostatakarzinom.
Keypoints
-
Die ARASENS-Studie zeigt einen relevanten und signifikanten Gesamtüberlebensvorteil für die Kombination aus ADT plus Docetaxel (6 Zyklen) und Darolutamid versus ADT plus Docetaxel.
-
Die Resultate der PROPELStudie zeigen einen signifikanten Vorteil im radiografisch progressionsfreien Überleben für die Kombination Olaparib plus Abirateron/Prednison versus Placebo plus Abirateron/Prednison in der ersten Linie bei Patienten mit kastrationsresistentem Prostatakarzinom unabhängig vom Nachweis einer relevanten Alteration in DNA-Reparatur-Genen.
-
Die Resultate der MAGNITUDE-Studie zeigen einen signifikanten Vorteil im radiografisch progressionsfreien Überleben für die die Kombination Niraparib plus Abirateron/Prednison versus Placebo plus Abirateron/Prednison in der ersten Linie bei Patienten mit prädefinierten molekularen Alterationen in DNA-Reparatur-Genen und kastrationsresistentem Prostatakarzinom.
Beim diesjähren Genitourinary Cancers Symposium der American Society of Clinical Oncology (ASCO) wurden mehrere wichtige Studien zum Prostatakarzinom vorgestellt. Insbesondere für die Behandlung von Männern mit fortgeschrittenem Prostatakarzinom wurden drei grosse Studien, welche den Primärendpunkt erreicht haben, präsentiert: ARASENS beim metastasierten hormonsensitiven Prostatakarzinom sowie PROPEL und MAGNITUDE beim metastasierten kastrationsresistenten Prostatakarzinom.
Tripeltherapie auf dem Vormarsch: ARASENS
Die ARASENS-Studie hat 1306 Patienten mit metastasiertem hormonsensitivem Prostatakarzinom auf Androgendeprivation (ADT) plus Docetaxel versus ADT plus Docetaxel plus Darolutamid randomisiert.1 Untersucht wurde der primäre Endpunkt Gesamtüberleben. 2021 wurden bereits Daten der PEACE-1-Studie mit einem ähnlichen Konzept präsentiert (ADT plus Docetaxel plus/minus Abirateron/Prednison).2 Im Gegensatz zu PEACE-1 hat die ARASENS-Studie mit nur zwei Armen und einer Gabe von Docetaxel an alle Patienten ein klareres Design. Ausserdem schliesst sie sowohl synchron (ca. 85%) als auch metachron metastasierte Patienten (ca. 15%) ein.
Relevanter Gesamtüberlebensvorteil
In der ARASENS-Studie hat die Tripeltherapie (ADT plus Docetaxel plus Darolutamid) zu einem relevanten Gesamtüberlebensvorteil geführt (nicht erreicht [NR] vs. 48,9 Monate, HR: 0,68, 95% CI: 0,57–0,8). In den Subgruppenanalysen bestätigt sich der Vorteil für die Tripeltherapie in allen untersuchten Subgruppen. Auch in allen relevanten sekundären Endpunkten bestätigte sich der Vorteil der Tripeltherapie (Zeit bis zur Kastrationsresistenz, Zeit bis zur Schmerzprogression, Zeit bis zur Einleitung einer weiteren antineoplastischen Therapie).
Die zusätzliche Gabe von Darolutamid zu ADT und Docetaxel war zudem gut verträglich und führte lediglich zu geringgradiger Hypertonie und Leberfunktionsstörung (Erhöhung der Aspartat-Aminotransferase [AST]) und der Alanin-Aminotransferase [ALT]). Obwohl auch ein relevanter Anteil an Patienten im Alter ≥75 Jahre eingeschlossen wurde, konnten mehr als 85% aller Patienten die geplanten sechs Zyklen Docetaxel abschliessen.
Tumorvolumen wird vernachlässigt
Eine Schwäche der ARASENS-Studie ist die Tatsache, dass keine Aufschlüsselung der Daten in Bezug auf Tumorvolumen («low volume» vs. «high volume») präsentiert wurde. Zudem ist auch nach PEACE-1 und ARASENS die Frage zum Stellenwert der Chemotherapie in diesen Therapiesituationen offengeblieben. Nicht untersucht wurde bis jetzt, ob Patienten, welche bereits eine Kombination aus ADT und einer neuen endokrinen Therapie (Abirateron/Prednison, Apalutamid, Darolutamid, Enzalutamid) erhalten, von einer zusätzlichen frühen Gabe von Docetaxel profitieren.
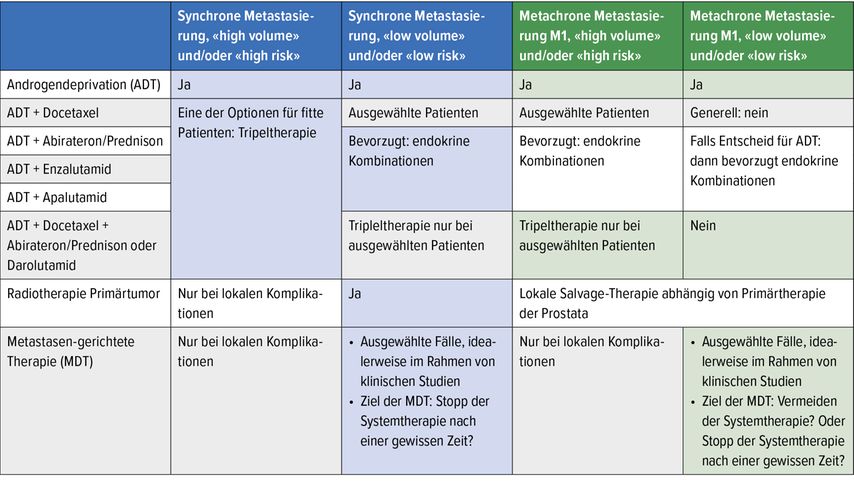
In Tabelle 1 sind die Therapieoptionen aufgeführt, die im Jahr 2022 für Patienten mit metastasiertem hormonsensitivem Prostatakarzinom verfügbar sind. Die Tripeltherapie ist, unterstützt von den Daten der PEACE-1- und ARASENS-Studie, ganz klar eine Option. Aus Sicht des Autors ist sie jedoch primär sinnvoll bei Patienten mit synchron metastasierter Erkrankung und hohem Tumorvolumen («high volume») und/oder aggressiver Tumorbiologie (Lokalisation der Metastasen, Ausdehnung, «International Society of Urological Pathology»[ISUP]-Grad, molekularpathologische Charakteristika).
Über den Tellerrand: PROPEL und MAGNITUDE
Beim fortgeschrittenen kastrationsresistenten Prostatakarzinom konnte in der ersten prospektiv randomisierten Phase-III-Studie (PROFOUND) der Vorteil des Poly-ADP-Ribose-Polymerase(PARP)-Inhibitors Olaparib gegenüber einer endokrinen Therapie bei molekular ausgewählten Patienten (vor allem BRCA1/BRCA2) gezeigt werden. Olaparib ist von der US-amerikanischen Food and Drug Administration (FDA) bei Nachweis einiger pathogener Alterationen in DNA-Reparatur-Genen zugelassen worden. Die European Medicines Agency (EMA) und auch Swissmedic haben die Zulassung auf Patienten mit Nachweis einer BRCA1- oder BRCA2-Alteration beschränkt (Keimbahn und/oder somatisch).
Zwei grosse Studien, welche am ASCOGU 2022 vorgestellt wurden, stellen das Konzept des Einsatzes von PARP-Inhibitoren ausschliesslich bei molekular ausgewählten Patienten mit Prostatakarzinom infrage.
PROPEL
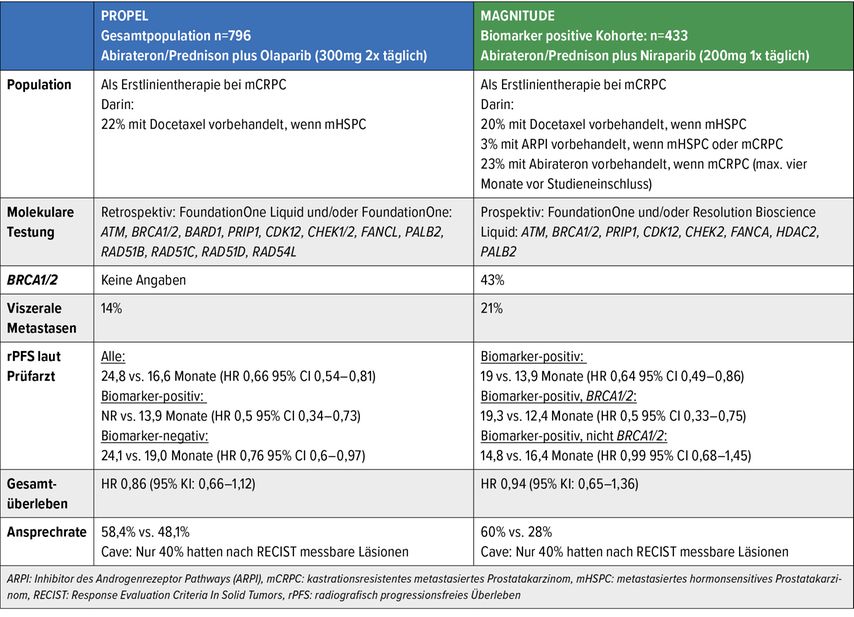
Die PROPEL-Studie schliesst Patienten mit kastrationsresistentem Prostatakarzinom ein (22% hatten Docetaxel im hormonsensitiven Stadium erhalten).3 Sie sind auf Olaparib (2x300mg/Tag) plus Abirateron/Prednison (Standarddosierung) versus Placebo plus Abirateron/Prednison randomisiert. Eine molekulare Testung war für den Studieneinschluss nicht notwendig, die molekulare Analyse wurde aber im Laufe der Studie durchgeführt (FoundationOne Liquid und/oder FoundationOne, Testung für: ATM, BRCA1/2, BARD1, PRIP1, CDK12, CHEK1/2, FANCL, PALB2, RAD51B, RAD51C, RAD51D, RAD54L). PROPEL hat den primären Endpunkt des radiografisch progressionsfreien Überlebens (rPFS) mit einem signifikanten Vorteil für die Patienten mit der Olaparib/Abirateron-Kombination erreicht (24,8 vs. 16,6 Monate, HR: 0,66, 95% CI: 0,54–0,81).
Der Vorteil zeigt sich in allen präsentierten Subgruppen, interessant ist hier aber vor allem der Unterschied von Biomarker-positiven Patienten (HR 0,5) gegenüber Biomarker-negativen Patienten (HR 0,76, Tab. 2). Bezüglich des Gesamtüberlebens zeigt sich mit dem aktuellen Follow-up noch kein relevanter Vorteil. Die zusätzliche Gabe von Olaparib zu Abirateron/Prednison resultiert in erhöhter Toxizität. Deswegen musste die Dosierung von Olaparib bei 20% der Patienten reduziert und die Gabe bei 14% komplett gestoppt werden. Eine Zunahme von Anämie ist als relevante Nebenwirkung zu erwähnen (alle Grade: 46% vs. 16%, Grad ≥3: 15% vs. 3%).
Der rPFS-Vorteil in PROPEL ist eindrücklich, aber es ist zu beachten, dass aktuell für die Kombination noch kein Überlebensvorteil nachgewiesen werden konnte und sie durchaus relevante Nebenwirkungen mit sich bringt. Wichtige Details zu den molekularen Alterationen, insbesondere, wie viele Patienten mit BRCA1/2-Alterationen eingeschlossen wurden, fehlen. Ein weiterer wichtiger Diskussionspunkt ist die Tatsache, dass wahrscheinlich viele Patienten im hormonsensitiven Stadium in der Praxis bereits eine kombinierte endokrine Therapie erhalten haben. Die klassische «PROPEL-Population» wird somit vermutlich in Zukunft nicht mehr so gross sein.
MAGNITUDE
Die MAGNITUDE-Studie schliesst Patienten mit kastrationsresistentem Prostatakarzinom ein. Von diesen hatten 20% Docetaxel im hormonsensitiven Stadium und 3% eine neue endokrine Therapie im hormonsensitiven oder nicht metastasierten kastrationsresistenten Stadium erhalten.4 Sie wurden 2:1 auf Niraparib (1x200mg/Tag) plus Abirateron/Prednison (Standarddosierung) versus Placebo plus Abirateron/Prednison randomisiert. Eine molekulare Testung war für den Studieneinschluss zwingend notwendig (FoundationOne und/oder Resolution Bioscience Liquid, Testung für: ATM, BRCA1/2, PRIP1, CDK12, CHEK2, FANCA, HDAC2, PALB2).
MAGNITUDE untersucht das Konzept prospektiv in zwei Kohorten: der Biomarker-positiven Kohorte, in die der Einschluss mit einer qualifizierenden Alteration wie oben beschrieben erfolgt, und der Biomarker-negativen Kohorte, in die Patienten nur bei Fehlen des Nachweises einer oben beschriebenen Alteration aufgenommen werden. Die Studie wurde bei der Biomarker-negativen Kohorte nach Einschluss von 233 Patienten frühzeitig beendet, nachdem sich keinerlei Vorteil im kombinierten Endpunkt gezeigt hatte (Prostata-spezifisches Antigen [PSA] und/oder rPFS, HR: 1,09, 95% CI: 0,75–1,59). In der Biomarker-positiven Kohorte erreichte MAGNITUDE jedoch den primären Endpunkt (rPFS), spezifisch bei Patienten mit BRCA1/2-Alterationen, mit einem signifikanten Vorteil für die Niraparib/Abirateron-Kombination (16,6 vs. 10,9 Monate, HR: 0,53, 95% CI: 0,36–0,79). Der Vorteil zeigte sich auch in der gesamten Biomarker-positiven Subgruppe (HR: 0,73, 95% CI: 0,56–0,96, Tab. 2). Bezüglich des Gesamtüberlebens präsentiert sich mit dem aktuellen Follow-up noch kein relevanter Vorteil. Die zusätzliche Gabe von Niraparib zu Abirateron/Prednison resultiert in zusätzlicher Toxizität. Deswegen musste die Dosierung von Niraparib bei 20% der Patienten reduziert und die Gabe von Niraparib bei 11% komplett gestoppt werden. Als relevante Nebenwirkungen zu erwähnen sind Anämie (alle Grade: 46% vs. 20%, Grad ≥3: 30% vs. 8%) und Thrombozytopenie (alle Grade: 21% vs. 9%, Grad ≥3: 6.6% vs. 2.4%).
Die Resultate der MAGNITUDE-Studie sind intuitiv besser verständlich als die der PROPEL-Studie. Auch sind die prospektive Biomarkertestung und die Auftrennung in eine Biomarker-positive und eine Biomarker-negative Kohorte zu unterstreichen. Wichtig ist hier, hervorzuheben, dass der rPFS-Vorteil vor allem in der BRCA1/2- Subgruppe (43% der Biomarker-positiven Kohorte) nachgewiesen werden konnte. Ausserdem bringt die Kombination von Niraparib und Abirateron/Prednison relevante zusätzliche Toxizität mit sich, obwohl Niraparib in einer konservativ niedrigen Dosierung eingesetzt wurde. Auch der Gesamtüberlebensvorteil wurde bei MAGNITUDE noch nicht berichtet. In der Diskussion wird spekuliert, ob allenfalls eine höhere Dosierung von Niraparib zu einem anderen Resultat in der Biomarker-negativen Kohorte geführt hätte.
Neue Erkenntnisse, neue Fragen
Mit ARASENS, MAGNITUDE und PROPEL sind einige Fragen beantwortet, aber auch viele neue aufgeworfen worden. Man darf auf Updates in künftigen Konferenzen gespannt sein. Bei der kommenden Advanced Prostate Cancer Consensus Conference (APCCC 2022, www.apccc.org ) sollen viele dieser Fragen von einem Experten-Panel aufegriffen, diskutiert und nachfolgend in der Konsensuspublikation veröffentlicht werden.
Literatur:
1 Smith R et al.: Darolutamide and survival in metastatic, hormone-sensitive prostate cancer. N Engl J Med 2022; 386: 1132-42 2 Fizazi K et al.: Abiraterone plus prednisone added to androgen deprivation therapy and docetaxel in de novo metastatic castration-sensitive prostate cancer (PEACE-1): a multicentre, open-label, randomised, phase 3 study with a 2×2 factorial design. Lancet 2022; S0140-6736(22)00367-1. Online ahead of print 3 Saad F et al.: PROpel: Phase III trial of olaparib (ola) and abiraterone (abi) versus placebo (pbo) and abi as first-line (1L) therapy for patients (pts) with metastatic castration-resistant prostate cancer (mCRPC). J Clin Oncol 2022; 40(6): 11 4Chi K et al.: Phase 3 MAGNITUDE study: First results of niraparib (NIRA) with abiraterone acetate and prednisone (AAP) as first-line therapy in patients (pts) with metastatic castration-resistant prostate cancer (mCRPC) with and without homologous recombination repair (HRR) gene alterations. J Clin Oncol 2022; 40(6): 12
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...