Transplantation und zelluläre Therapie: wichtige Fortschritte
Bericht:
Dr. Therese Schwender
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Das 49. Jahresmeeting der European Society for Blood and Marrow Transplantation (EBMT) brachte Ärzt*innen, Krankenpflegende, Fachleute aus der klinischen Forschung und Patient*innen zusammen, um die neuesten Entwicklungen auf dem Gebiet der Blut- und Knochenmarktransplantation und der zellulären Therapien zu diskutieren. Ineinigen Indikationen konnte über wichtige Fortschritte berichtet werden.
Beim Presidential Symposium präsentierte Dr. Yngvar Floisand, Oslo/Norwegen, Resultate der mit dem Van Bekkum Award ausgezeichneten randomisierten, doppelblinden, placebokontrollierten, multizentrischen Phase-III-Studie zum Einsatz des monoklonalen Antikörpers Vedolizumab als Prophylaxe einer akuten Graft-versus-Host Disease (aGvHD) des unteren Gastrointestinaltrakts bei Patient*innen nach einer ersten allogenen hämatopoetischen Stammzelltransplantation (allo-HSCT).1
Bei Vedolizumab handelt es sich um einen selektiv im Darm wirkenden immunmodulatorischen monoklonalen Antikörper, der zur Behandlung von Colitis ulcerosa und Morbus Crohn eingesetzt wird. Vedolizumab bindet an das α4β7-Integrin auf pathogenen Homing-Lymphozyten im Darm und hemmt selektiv die Adhäsion dieser Zellen an das mukosale Addressin-Zelladhäsionsmolekül 1 (MAdCAM-1).2
Wie Dr. Floisand einleitend erklärte, entwickeln etwa 40% bis 70% der allo-HSCT-Empfänger*innen trotz entsprechender Routineprophylaxe eine gastrointestinale aGVHD der Grade 2 bis 4. In ihrer Studien nun erhielten 343 Teilnehmende randomisiert (1:1) entweder intravenös 300mg Vedolizumab (Tag –1 vor der allo-HSCT und Tag +13, Tag +41, Tag +69, Tag +97, Tag +125 und Tag +153 nach der allo-HSCT) oder Placebo zusätzlich zu einer Standardprophylaxe, bestehend aus einer Kombination aus einem Calcineurin-Inhibitor und Methotrexat (oder Mycophenolat-Mofetil). Der primäre Endpunkt der Studie war das intestinale aGvHD-freie Überleben bis zum Tag +180 nach der allo-HSCT.
Erste positive Phase-III-Studie zuVedolizumab
Wie es sich zeigte, erwies sich Vedolizumab im Vergleich zu Placebo als signifikant wirksamer in der Prävention einer intestinalen aGvHD.1 So erreichten 85,5% der Teilnehmenden im Vedolizumab-Arm im Vergleich zu 70,9% unter Placebo den primären Endpunkt (HR: 0,45; 95% CI: 0,27–0,73; p<0,001).
„Auch 365 Tage nach der Transplantation war die Rate des intestinalen aGVHD-freien Überlebens bei den mit Vedolizumab behandelten Personen signifikant höher als in der Placebogruppe“, berichtete Dr. Floisand. Wie Subgruppenanalysen ergaben, blieb der Vorteil von Vedolizumab unabhängig von Faktoren wie dem Konditionierungsregime (myeloablativ bzw. reduzierte Intensität) oder einer Prophylaxe mit bzw. ohne ATG (Antithymozytenglobulin) erhalten.
Auch in verschiedenen sekundären Endpunkten erwies sich Vedolizumab als überlegen. Behandlungsbedingte Nebenwirkungen wurden bei 25% bzw. 28% und schwerwiegende Nebenwirkungen bei 69% bzw. 71% der mit Placebo bzw. Vedolizumab behandelten Patient*innen gemeldet (>Grad 3: 92% unter Vedolizumab, 89% unter Placebo). Unter den Nebenwirkungen von speziellem Interesse traten schwere Infektionen unter Vedolizumab numerisch häufiger auf als in der Placebogruppe (74% vs. 67,3%). „Dabei handelte es sich hauptsächlich um Infektionen der oberen Atemwege“, erläuterte der Redner.
Abschließend erklärte er, dass es sich hier um die erste positive Phase-III-Studie zu einer spezifischen Prophylaxe einer aGvHD des unteren Gastrointestinaltrakts handelt. „Weitere Analysen unserer Daten werden folgen, so zum Beispiel zum Einfluss von Vedolizumab auf die Entwicklung einer chronischen GvHD.“
rrMM: CAR-T-Zelltherapie vs. Standardtherapie
Ebenfalls beim Presidential Symposium präsentierte Dr. Paula Rodríguez-Otero, Pamplona/Spanien, die Daten der Studie KarMMa-3 zum Einsatz von Idecabtagen vicleucel (Ide-cel) im Vergleich zu Standardtherapien bei stark vorbehandelten Patient*innen mit einem rezidivierten/refraktären multiplen Myelom (rrMM).3
„Auch wenn sich dank Proteasominhibitoren, IMiD und der monoklonalen Anti-CD38-Antikörper die Behandlungsmöglichkeiten beim multiplen Myelom in den vergangenen Jahren deutlich verbessert haben, kommt es weiterhin zu Rezidiven“, sagte sie einleitend. Für Patient*innen, die bereits früh innerhalb der Therapie alle drei Substanzklassen erhalten hätten („triple-class exposed“, TCE), gebe es nur noch begrenzte Möglichkeiten.
In der randomisierten Phase-III-Studie KarMMa-3 wurde nun erstmals eine CAR-T-Zell-Therapie im direkten Vergleich zu Standardtherapien bei Myelom-Betroffenen untersucht, die zwei bis vier Vortherapien (TCE) erhalten hatten und gegenüber der letzten Behandlungslinie refraktär waren. Als Standardtherapie konnten die Prüfärzt*innen entweder DPd (Daratumumab/Pomalidomid/Dexamethason), DVd (Daratumumab/Bortezomib/Dexamethason), IRd (Ixazomib/Lenalidomid/Dexamethason), Kd (Carfilzomib/Dexamethason) oder EPd (Elotuzumab/Pomalidomid/Dexamethason) wählen (n=126). Insgesamt 225 Teilnehmende erhielten eine Ide-cel-Infusion mit einer Zieldosis von 150 bis 450x106 CAR-T-Zellen.
Der primäre Endpunkt war das von einem IRC (Independent Review Committee) ermittelte progressionsfreie Überleben (PFS). Das mediane Alter der Teilnehmenden lag bei 63 Jahren, die mediane Zeit seit Diagnose des Myeloms betrug 4,1 Jahre. Bei 44% der Patient*innen lag eine Hochrisiko-Zytogenetik vor und 66% der Teilnehmenden waren tripelrefraktär.
Risiko für Progress oder Tod um51% reduziert
Nach einem medianen Follow-up von 18,6 Monaten ergab sich für die mit Ide-cel behandelten Teilnehmenden ein signifikant längeres PFS im Vergleich zur Standardbehandlung (median 13,3 Monate vs. 4,4 Monate; HR: 0,49; 95% CI: 0,38–0,65; p<0,0001). „Der PFS-Benefit für Ide-cel konnte dabei konsistent über verschiedene Subgruppen beobachtet werden, so auch bei älteren Patient*innen, bei hoher Tumorlast, bei Hochrisiko-Zytogenetik und unabhängig von der Anzahl an Vortherapien“, ergänzte Dr. Rodríguez-Otero.
Ide-cel führte im Weiteren zu einer signifikanten Verbesserung der Gesamtansprechrate (ORR) im Vergleich zur Standardtherapie (71% vs. 42%, p>0,0001), mit einer höheren Rate an Erkrankten, die ein komplettes Ansprechen oder einen MRD(„minimal residual disease“)-negativen Status erreichten. Die Ansprechdauer unter Ide-cel betrug 14,8 Monate im Vergleich zu 9,7 Monaten unter Standardtherapie. „Für eine Aussage bezüglich des Gesamtüberlebens sind die Daten noch nicht reif genug“, erklärte die Referentin.
In der behandelten Population traten unerwünschte Ereignisse des Grades 3/4 bei 93% der Teilnehmenden unter Ide-cel- bzw. bei 75% unter Standardtherapie auf (Grad 5: 14% bzw. 6%). Bei 88% der mit Ide-cel behandelten Patient*innen kam es zu einem Zytokinfreisetzungssyndrom beliebigen Grades (Grad 3/4: 4%). Eine Neurotoxizität (alle Grade) trat bei 15% der Ide-cel-behandelten Studienteilnehmenden auf (Grad 3/4 bei 3%).
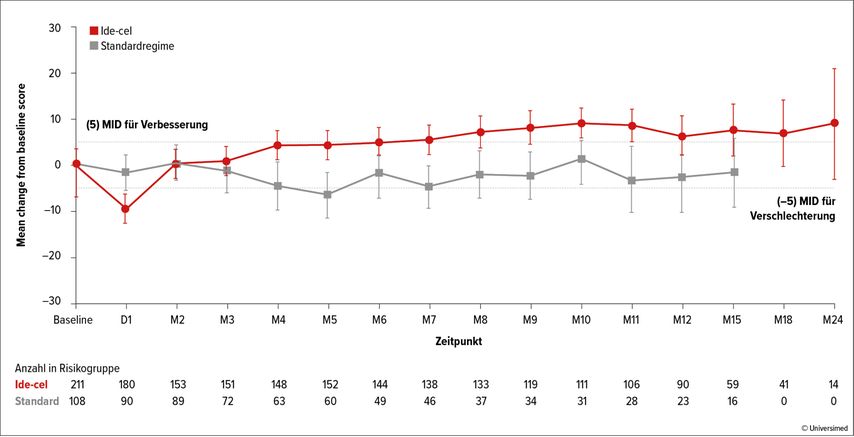
„Wichtig anzumerken ist zudem, dass Ide-cel im Vergleich zu den Standardbehandlungen zu klinisch relevanten Verbesserungen bei verschiedenen ‚patient-reported outcomes‘ führte, darunter Schmerzen, Fatigue, Funktionsfähigkeit und Lebensqualität“, so Dr. Rodriguez-Otero (Abb. 1).
Abb. 1: Bei stark vorbehandelten Patient*innen mit einem rezidivierten/refraktären multiplen Myelom führte Idecabtagen vicleucel (Ide-cel) im Vergleich zu Standardbehandlungen zu einer relevanten Verbesserung der Lebensqualität. Modifiziert nach Rodríguez-Otero P et al.3
EBV-positive lymphoproliferative Posttransplantationserkrankungen
Eine Epstein-Barr-Virus(EBV)-positive lymphoproliferative Posttransplantationserkrankung („EBV-positive post-transplant lymphoproliferative disease“, PTLD) kann sowohl nach der Transplantation eines soliden Organs (SOT) als auch nach einer HSCT auftreten.
„Mit einer Inzidenz von etwa 2% nach allo-HSCT und 5% bis 10% nach einer SOT wird sie häufig als selten bezeichnet“, sagte Dr. Sylvain Choquet, Paris/Frankreich. „Wenn wir aber sehen, dass zum Beispiel 2020 in der EU und den kollaborierenden Staaten über 18000 allo-HSCT und über 25000 SOT durchgeführt wurden, dann ist das nicht mehr so selten“, gab er zu bedenken.
Als Erstlinientherapie erfolgt in diesen Fällen, soweit möglich, eine Reduktion der Immunsuppression, gefolgt von einer Standardtherapie mit Rituximab (R) oder Rituximab plus Chemotherapie. Nach Versagen von R oder R-Chemo liegt das mediane Überleben bei Betroffenen nach allo-HSCT bei 0,7 Monaten und nach SOT bei 4,1 Monaten. „Dies verdeutlicht den enormen Bedarf an weiteren Optionen für diese Patient*innen“, betonte Dr. Choquet.
Tabelecleucel erfolgreich
Mit Tabelecleucel (Tab-cel) wurde in der laufenden Phase-III-Studie ALLELE eine allogene EBV-spezifische „Off-the-shelf“-T-Zell-Immuntherapie bei Patient*innen mit EBV+ PTLD getestet.4 Die Studienteilnehmenden (14 nach HSCT, 29 nach SOT) mit Versagen von R oder R-Chemo erhielten Tab-cel in einer Dosierung von 2x106 Zellen/kg an den Tagen 1, 8 und 15 eines 35-tägigen Zyklus.
Der primäre Endpunkt der Studie war die ORR. Das mediane Alter der Studienteilnehmenden betrug 48,5 Jahre. „Wir konnten aber auch zwei Kinder, eines nach HSCT und eines nach SOT, einschließen“, berichtete Dr. Choquet. Gut 20% der Teilnehmenden wiesen einen ECOG Score von >2 auf. Der häufigste PTLD-Subtyp war das diffuse großzellige B-Zell-Lymphom (67,4%). Zum Zeitpunkt des Screenings wiesen 76,7% der Teilnehmenden eine extranodale Erkrankung auf. Die mediane Zeit von der Transplantation bis zur Diagnose der EBV+ PTLD betrug 4,3 Monate (HSCT) bzw. 1,1 Jahr (SOT). Im Median erhielten die Betroffenen zwei Behandlungszyklen mit Tab-cel.
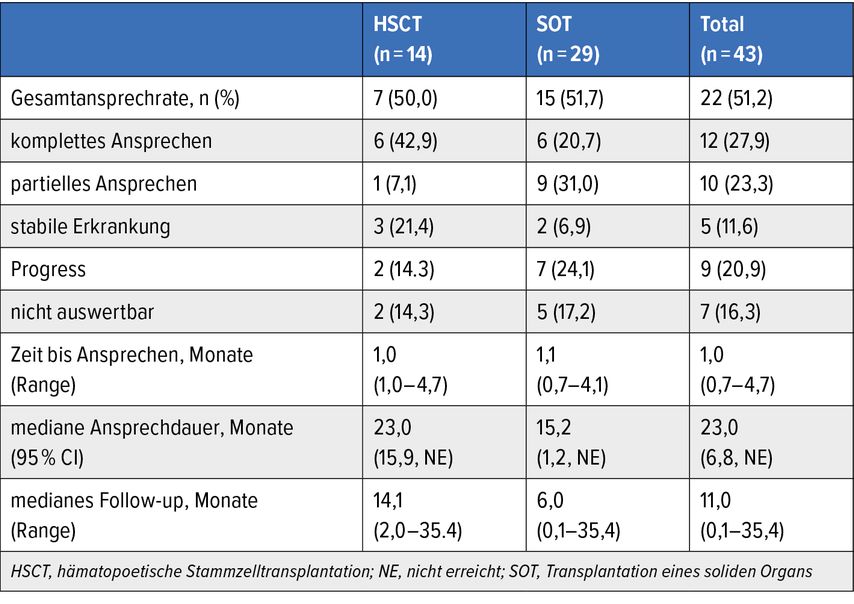
Insgesamt sprachen gut 50% der Studienteilnehmenden auf die Tab-cel-Behandlung an (Tab. 1). „Die mediane Ansprechdauer bei den 22 Respondern liegt bei etwa zwei Jahren. Lediglich vier Responder entwickelten ein Rezidiv oder starben“, ergänzte der Redner. Das geschätzte mediane Gesamtüberleben beträgt 18,4 Monate. Die 1-Jahres-Überlebensrate liegt bei den Respondern bei 84,4% und bei den Non-Respondern bei 34,8% (Gesamtpopulation: 61,1%).
Tab. 1: Ergebnisse einer Behandlung mit Tabelecleucel bei Patient*innen mit einer EBV-positiven lymphoproliferativen Posttransplantationserkrankung (EBV+ PTLD) im Rahmen der ALLELE-Studie. Modifiziert nach Choquet S et al.4
„Die Verträglichkeit war insgesamt recht gut. Wir hatten lediglich zwei Studienteilnehmende mit Grad-3/4-Toxizitäten“ so Dr. Choquet. Insbesondere konnten keine Tumor-Flare-Reaktionen, keine Zytokinfreisetzungssyndrome, keine GvHD und keine Abstoßungsreaktionen beobachtet werden. „Diese Ergebnisse belegen, dass Tab-cel einen potenziell grundlegenden Behandlungsfortschritt für Personen mit einer EBV-positiven lymphoproliferativen Posttransplantationserkrankung bedeutet“, sagte er und wies abschließend darauf hin, dass Tab-cel mittlerweile von der EMA für Erwachsene und pädiatrische Patient*innen mit einer EBV+ PTLD nach mindestens einer Vortherapie zugelassen ist.
Quelle:
49th Annual Meeting of the European Society for Blood and Marrow Transplantation (EBMT), 23. bis 26. April 2023, Paris/F und online
Literatur:
1 Chen YB et al.: Vedolizumab for prophylaxis of lower gastrointestinal acute graft-versus-host disease after allogeneic hematopoietic stem-cell transplantation from unrelated donors: a phase 3, randomized, double-blind, placebo-controlled, multicenter study. EBMT 2023; Abstr. #GS02-02 2 Fachinformation Entyvio® (Vedolizumab). www.swissmedicinfo.ch , Stand Dezember 2021 3 Rodríguez-Otero P et al.: Idecabtagene vicleucel versus standard regimens in patients with triple-class–exposed relapsed and refractory multiple myeloma: karMMa-3, aphase 3 randomized controlled trial. EBMT 2023; Abstr.#GS02-10 4 Choquet S et al.: Updated results from phase 3 study tabelecleucel for post-transplant lymphoproliferative disease following allogeneic hematopoietic cell or solid organ transplant after failure rituximab or R+chemotherapy (ALLELE). EBMT 2023; Abstr. #Paed3-02
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...