ISTH 2024: Thrombolyse, Risikoprädiktion, Hämophilieprophylaxe
Bericht:
Dr. Andreas Billich
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Der ISTH-Kongress im Juni 2024 mit über 5000 Teilnehmenden bot die Gelegenheit, tief in das Feld von Thrombose und Hämostase einzutauchen.Zu den Highlights unter den Wirkstoffen gehörten ein Glykoprotein-VI-Inhibitor, Efanesoctocog alfa und Mim8.
Neuer GPVI-Inhibitor mit interessanten präklinischen Daten
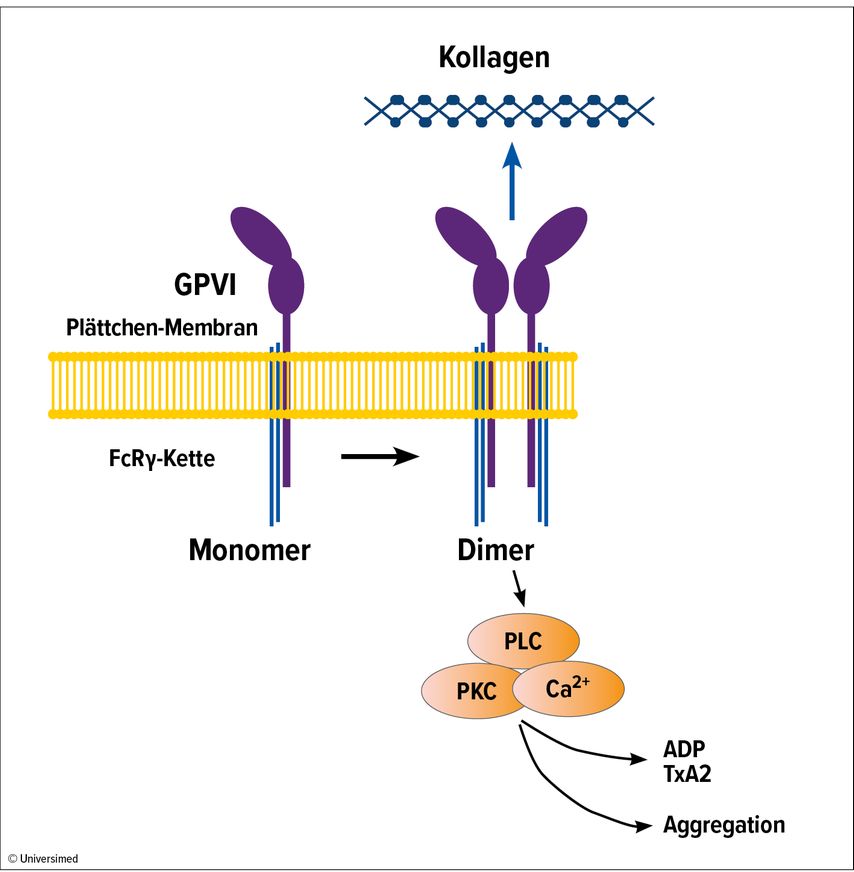
Der thrombozytäre Kollagenrezeptor Glykoprotein (GP) VI spielt eine wichtige Rolle bei Aktivierung und Adhäsion der Plättchen und damit bei der Bildung von Thromben (Abb. 1).1 Dr. Stefano Navarro (Universität Würzburg, Deutschland) berichtete über die Entwicklung eines neuen humanisierten Anti-GPVI-Fab-Fragments (EMA601).3 Dieser Inhibitor bindet mit hoher Affinität an den humanen Rezeptor (KD: 0,2nM) und hemmt dessen Funktion, möglicherweise durch Blockade der Dimerisierung von GPVI.
Für die nichthumanisierte Variante von EMA601 wurde gezeigt, dass sie die GPVI-abhängige Aggregation von Thrombozyten und die Thrombusbildung in menschlichem Blut ex vivo hemmt. In humanisierten GPVI-Mäusen schützte der Inhibitor vor arterieller Thrombose und reduzierte die Infarktgröße in einem Modell des ischämischen Schlaganfalls; die Blutungszeit wurde jedoch nicht verlängert.
EMA601 ist daher ein vielversprechender Kandidat für die Behandlung thrombotischer Erkrankungen ohne Beeinflussung der normalen Hämostase.
Pro-Urokinase zur Thrombolyse beiLungenembolie
Bei Patient:innen mit akuter Lungenembolie und erhöhtem Risiko kann eine systemische thrombolytische Therapie eine lebensrettende Maßnahme darstellen. Rekombinanter gewebespezifischer Plasminogenaktivator (rt-PA; Alteplase) ist das bevorzugte und bei Lungenembolie zugelassene thrombolytische Agens.4 Allerdings ist diese Therapie mit einem Blutungsrisiko verbunden.
Rekombinante humane Pro-Urokinase (rhPro-UK), die wie Alteplase nicht immunogen ist und spezifisch auf den Thrombus wirkt, könnte ähnlich effektiv sein, jedoch unter Vermeidung des Blutungsrisikos.
Prof. Zhi-Cheng Jing (Guangdong Provincial People’s Hospital, Guangzhou, China) berichtete von einer randomisierten Phase-II-Studie, die rhPro-UK mit Alteplase bei Patient:innen mit akuter Lungenembolie verglich.5 Die Wirksamkeit der beiden Therapien, unter anderem gemessen an der Reduktion des pulmonalen arteriellen Blutdrucks und der rechts-ventrikulären (RV) Dilatation sowie der Verbesserung der RV-Funktion, unterschied sich nicht voneinander. Die Häufigkeit von Blutungen war mit rhPro-UK jedoch signifikant niedriger als mit Alteplase, was sich durch einen relativ moderaten Einfluss von rhPro-UK auf die Koagulation erklären lässt.
Wenn sich diese Beobachtungen in einer größeren Phase-III-Studie bestätigen, könnte rhPro-UK eine ähnlich wirksame, aber sicherere Alternative zu Alteplase bei akuter Lungenembolie darstellen.
Vienna CATScore:externe Validierung
Venöse Thromboembolien (VTE) sind eine häufige Komplikation bei Tumorerkrankungen. Um Krebspatient:innen mit hohem VTE-Risiko zu identifizieren, wurden verschiedene Modelle zur Risikoabschätzung etabliert. Für eines dieser Modelle, den Vienna CATScore,6 der Nomogramm-basiert ist und Tumortyp und D-Dimere als Variablen inkludiert, wurde jetzt eine externe Validierung unternommen, wie Dr. Cornelia Englisch (Medizinische Universität Wien) berichtete.7
Dafür wurde eine prospektive Kohorte von Patient:innen, die eine Krebstherapie (einschließlich Immuncheckpoint-Inhibitor-Therapien) begannen, bei Studieneinschluss sowie drei Wochen und drei Monate nach Therapiebeginn analysiert.
Die Studie schloss 598 Patient:innen ein, von denen 54 in der sechsmonatigen Beobachtungszeit eine VTE erlitten. Der Vienna CATScore zeigte eine gute Unterscheidungsfähigkeit zu allen drei Zeitpunkten. Wenn ein vorhergesagtes VTE-Risiko von 8% nach sechs Monaten als Schwelle für Hochrisiko festgelegt wurde (wie von den aktuellen ESMO-Leitlinien empfohlen),8 dann unterschied der CATScore effektiv zwischen einer Hoch- und Niedrigrisiko-Gruppe mit beobachteten VTE-Inzidenzen von 6,3% vs. 13,6% (p<0,001).
Zusammengefasst bestätigt diese externe Validierung die Befähigung des Vienna CATScore, das 6-Monats-VTE-Risiko in den ersten drei Monaten moderner Krebstherapie vorherzusagen, was die zielgenaue Auswahl von Patient:innen für eine primäre Thromboseprophylaxe ermöglicht.
Risiko für postthrombotisches Syndrom bei Kindern
Das postthrombotische Syndrom (PTS) ist die häufigste langfristige Komplikation bei Kindern, die eine tiefe Venenthrombose (TVT) an den Extremitäten erlitten haben. Prof. Marisol Betensky (Johns Hopkins University, St. Petersburg, USA) stellte eine Studie vor, die nach Risikofaktoren für die Entwicklung eines PTS während dreier Monate nach provozierter TVT suchte.9 Unter den 399 eingeschlossenen Patient:innen entwickelten 37% ein PTS. Als mögliche prognostische Faktoren wurden ein Alter >12 Jahre und ein kompletter Venenverschluss sowie ein niedriger Fibrinolyse-Index sechs Wochen nach der TVT-Diagnose identifiziert. Nach multivariater Analyse verblieb eine reduzierte fibrinolytische Kapazität als unabhängiger prognostischer Marker für ein PTS (OR: 2,1; p=0,011).
Zusammengenommen ergab diese Studie eine hohe Rate von PTS nach provozierter TVT bei Kindern und wies auf eine Assoziation zwischen PTS und verminderter Plasma-Fibrinolyse hin. PTS tritt vor allem bei pädiatrischen Patient:innen im Teenageralter bei persistierendem Venenverschluss auf.
Langzeitdaten zuEfanesoctocog alfa
Bei schwerer Hämophilie A, dem kongenitalen Faktor-VIII-Mangel, ist eine regelmäßige Prophylaxe durch Substitution von Faktor VIII (FVIII) geboten, um spontane Blutungen und Gelenkschäden zu verhindern. Efanesoctocog alfa ist eine neue Art von Substitutionstherapie, die sich durch eine drei- bis vierfach längere Halbwertszeit verglichen mit bisherigen FVIII-Produkten auszeichnet und nachhaltig hohe Spiegel von FVIII-Aktivität bei nur einmal wöchentlicher Gabe ermöglicht.10 Im Juni 2024 wurde Efanesoctocog alfa in der EU für Patient:innen aller Altersgruppen auf Grundlage der Phase-III-Studie XTEND-1 zugelassen.11
Beim ISTH-Kongress wurde die Interimsanalyse der Verlängerungsstudie XTEND-ed von Dr. Annette von Drygalski (University of California, San Diego, USA) vorgestellt.12 Bei 43 Studienteilnehmenden, die Efanesoctocog alfa für ≥12 Monate erhielten, waren zu Studienbeginn 132 Gelenke von spontanen Blutungen betroffen; diese Gelenksblutungen klangen unter der Prophylaxe zu 100% ab. Die Gesundheit der Gelenke war bereits während XTEND-1 verbessert worden; diese Verbesserung blieb bei der Mehrzahl während zwölf Monaten fortgesetzter Prophylaxe in der XTEND-ed-Studie erhalten oder vergrößerte sich weiter. Patient:innen mit den am schwersten betroffenen Gelenken hatten den meisten Vorteil. Die größte Verbesserung wurde beim Flexionsverlust der Gelenke verzeichnet.
Diese Daten belegen einen nachhaltigen Schutz vor Gelenksblutungen durch Efanesoctocog alfa.
Hämophilie-A-Prophylaxe mit Mim8
Der bispezifische Antikörper Mim8 ist ein FVIII-Mimetikum der neuen Generation. Dr. Maria Mancuso (Humanitas Research Hospital, Mailand, Italien) präsentierte die Ergebnisse der Phase-III-Studie FRONTIER2, die die Wirksamkeit und Sicherheit von Mim8 in der Prophylaxe der Hämophilie A mit und ohne Inhibitoren untersuchte.13
Die Studie zeigte, dass eine einmal wöchentliche oder einmal monatliche Mim8-Prophylaxe die annualisierte Rate behandlungsbedürftiger Blutungen gegenüber einer Behandlung bei Bedarf um mindestens 97% reduzierte. Mim8 zeigte auch bei Patient:innen, die vor der Studie eine andere Prophylaxe erhalten hatten, eine um mindestens 42% reduzierte Blutungsrate. Die Mehrzahl der Patient:innen (65–95%) hatte keinerlei behandlungsbedürftige Blutungen unter der Mim8-Prophylaxe;Sicherheitsbedenken traten nicht auf.
Die Studie belegt somit die Wirksamkeit und Sicherheit von Mim8 bei HämophilieA.
Mezagitamab bei primärer Immunthrombozytopenie
Immunthrombozytopenie (ITP), eine seltene Blutungsstörung, wird durch Autoantikörper gegen Thrombo- und Megakaryozyten hervorgerufen. Mezagitamab ist ein monoklonaler Antikörper, der CD38-exprimierende Zellen depletiert, was zur Verminderung von Anti-Plättchen-Antikörpern und zur Verbesserung der Plättchenzahl führen sollte. Prof. David Kuter (Harvard Medical School, Boston, USA) stellte die Interimsanalyse einer randomisierten Phase-II-Studie zu Mezagitamab bei chronischer/persistierender primärer ITP vor.14
Mezagitamab war in der Studie gut verträglich; die Inzidenz von Nebenwirkungen war im Mezagitamab- und im Placebo-Arm der Studie ähnlich. Mit Mezagitamab zeigte sich ein rascher und nachhaltiger Anstieg der Plättchenzahl. Diese Verbesserung war dosisabhängig und klinisch relevant; nach Ende der achtwöchigen Behandlung mit Mezagitamab blieb die Plättchenzahl für mindestens acht weitere Wochen erhöht. Erste Daten weisen auf ein unter Mezagitamab-Therapie vermindertes Auftreten von Blutungen hin.
Quelle:
2024 Congress of the International Society on Thrombosis and Haemostasis (ISTH), 22.–26. Juni, Bangkok, Thailand
Literatur:
1 Jung SM, Moroi M: Platelet glycoprotein VI. Adv Exp Med Biol 2008; 640: 53-63 2 Fuentes E: Modulation of glycoprotein VI and its downstream signaling pathways as an antiplatelet target. Int J Mol Sci 2022; 23(17): 9882 3 Navarro S et al.: EMA601, a novel humanised Fab inhibits platelet glycoprotein VI with unprecedented potency and protects mice from arterial thrombosis and ischemic stroke. ISTH-Kongress 2024; Abstr. #LB01.4 4 Konstantinides SV et al.: 2019 ESC Guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J 2020; 41(4): 543-603 5 Jing ZC et al.: Evaluation of recombinant human prourokinase in the treatment of acute pulmonary embolism (ERUPTE): a randomized, single-blinded, multicenter, phase 2 trial. ISTH-Kongress 2024; Abstr. #B01.3 6 Pabinger I et al.: A clinical prediction model for cancer-associated venous thromboembolism: a development and validation study in two independent prospective cohorts. Lancet Haematol 2018; 5(7): e289-98 7 Englisch C et al.: The Vienna CATScore for predicting VTE risk in patients with cancer: an external validation across multiple time-points. ISTH-Kongress 2024; Abstr. #OC03.4 8 Falanga A et al.: Venous thromboembolism in cancer patients: ESMO Clinical Practice Guideline. Ann Oncol 2023; 34(5): 452-67 9 Betensky M et al.: Clinical and laboratory-based risk factors for the development of post-thrombotic syndrome (PTS) in children with provoked deep venous thrombosis (DVT): findings from the Kids-DOTT trial and biobank. ISTH-Kongress 2024; Vortrag OC 65.5 10 Dargaud Y et al.: Efanesoctocog alfa: the renaissance of Factor VIII replacement therapy. Haematologica 2024; doi: 10.3324/haematol.2023.284498 11 Von Drygalski A et al.: Efanesoctocog alfa prophylaxis for patients with severe haemophilia A. N Engl J Med 2023; 388(4): 310-8 12 von Drygalski A et al.: Interim analysis of joint outcomes in adult and adolescent patients with severe hemophilia A receiving efanesoctocog alfa during the phase 3 XTEND-ed long-term extension study. ISTH Kongress 2024; Abstr. #OC01.4 13 Mancuso ME et al.: Efficacy and safety of Mim8 prophylaxis in adults and adolescents with hemophilia A with or without inhibitors: Phase 3, open-label, randomized, controlled FRONTIER2 study. ISTH-Kongress 2024; Abstr. #LB01.5 14 Kuter DJ et al.: Safety, tolerability, and efficacy of mezagitamab (TAK-079) in chronic or persistent primary immune thrombocytopenia: Interim results from a phase 2, randomized, double-blind, placebo-controlled study. ISTH-Kongress 2024; Abstr. #LB01.1
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...