Thorakale Malignome: Neues zu «targeted therapies» und Immuntherapien
Autoren:
Dr. med. Sebastian Kraus1
Prof. Dr. med. Dr. phil. nat. Sacha Rothschild2
1 Stadtspital Zürich Triemli, Klinik für Medizinische Onkologie und Hämatologie
2 Kantonsspital Baden, Zentrum für Onkologie/Hämatologie
Korrespondenz:
E-Mail: sebastian.kraus@stadtspital.ch
Auch in diesem Jahr wurden auf dem European Lung Cancer Congress (ELCC) innovative und vielversprechende Therapieansätze vorgestellt, die sowohl zielgerichtete Behandlungsmöglichkeiten als auch immunonkologische Daten umfassen. Im Folgenden präsentieren die Autoren ihre diesjährigen Kongress-Highlights.
MARIPOSA-Studie:Daten zum Gesamtüberleben
Amivantamab (Ami), ein bispezifischer Antikörper, der gegen EGFR und MET gerichtet ist, wurde in Kombination mit Lazertinib (Laz), einem oralen Tyrosinkinase-Inhibitor (TKI) der dritten Generation, der ebenfalls gegen EGFR wirkt, in der Erstlinienbehandlung von lokal fortgeschrittenem oder metastasiertem nichtkleinzelligem Bronchialkarzinom (NSCLC) mit häufigen EGFR-Mutationen (Ex19del oder L858R) mit dem EGFR-TKI Osimertinib (Osi) verglichen. Bisher zeigte sich ein progressionsfreies Überleben (PFS) zugunsten der Kombination aus Ami und Laz (HR: 0,7).1
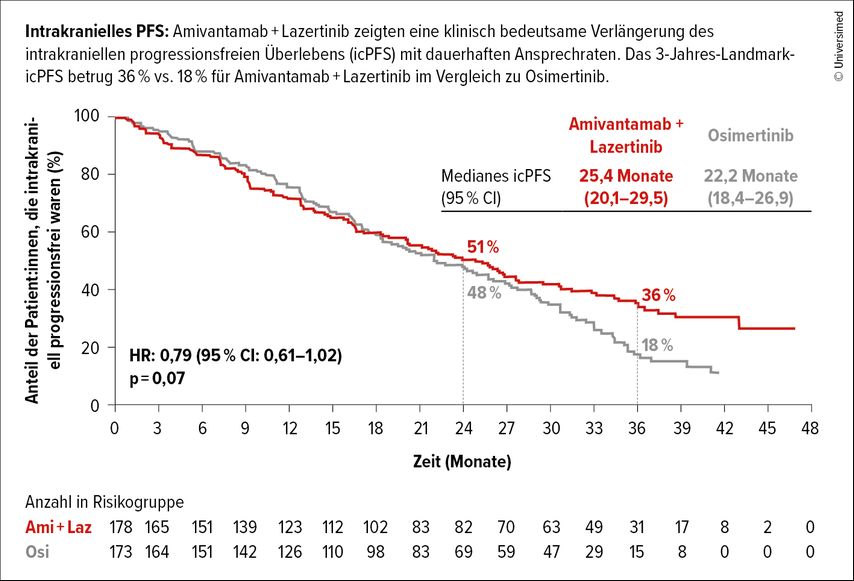
Auf dem diesjährigen ELCC wurden die Daten zum Gesamtüberleben aus dieser Phase-III-Studie veröffentlicht.2 Die mediane Nachbeobachtungszeit liegt in dieser Analyse bei 37,8 Monaten. Nach 36 Monaten waren 51% der Patient:innen im Osimertinib-Arm und 60% im Ami- und Laz-Arm noch am Leben (HR: 0,75; p<0,005). Nach drei Jahren lag das Überleben ohne intrakranielle Progression bei 36%im experimentellen Arm im Vergleich zu 18% unter Osi (HR: 0,79; p=0,07; Abb.1). Zudem konnte die Zeit bis zur symptomatischen Progression unter Ami und Laz im Vergleich zu Osi verlängert werden (43,6 vs. 29,3 Monate; HR: 0,69; p<0,001).
Abb. 1: Intrakranieller PFS-Vorteil von Amivantamab+Lazertinib (Ami+Laz) vs. Osimertinib (Osi) in der MARIPOSA-Studie (modifiziert nach Yang JCH et al.)2
Die meisten unerwünschten Ereignisse traten in den ersten vier Therapiemonaten auf, wobei insbesondere Hauttoxizitäten, darunter Ausschläge, Paronychien, akneiforme Dermatitis, Juckreiz und Hauttrockenheit, die potenziell therapielimitierend sein können, zu beachten sind.Sie können durch ein prophylaktisches dermatologisches Vorgehen, wie es in der COCOON-Studie randomisiert untersucht wurde, reduziert werden.3
In dieser Studie erhielten Patient:innen, die in der ersten Therapielinie mit Ami/Laz behandelt wurden, entweder die lokal üblichen prophylaktischen und therapeutischen Massnahmen oder ein intensiviertes und präemptives dermatologisches Management. Dieses beinhaltete den Gebrauch von oralem Doxycyclin oder Minocyclin, topische Clindamycin-Lotion auf den Skalp, Chlorhexidin für die Nägel sowie Ceramid-basierte Feuchtigkeitscremes.
Dieses intensivierte Schema reduzierte die Häufigkeit von Nebenwirkungen von Grad 2 oder schwereren dermatologischen Nebenwirkungen signifikant (76,5% vs. 38,6%). Auch die Rate an Therapieabbrüchen wurde signifikant von 19% auf 11% reduziert. Das Auftreten von Infusionsreaktionen kann durch prophylaktische Steroidgabe verringert werden (SKIPPirr-Studie).4 Besonders erwähnenswert sind unter der Kombination von Ami und Laz auch bis zu 40% thromboembolische Ereignisse, weshalb in den ersten vier Monaten eine prophylaktische Antikoagulation empfohlen wird.
In der MARIPOSA-Studie zeigen sich Hinweise auf einen Überlebensvorteil mit der Kombination aus Ami und Laz, wobei jedoch die erhöhte Toxizität, der Einfluss auf die Lebensqualität durch die Toxizität sowie die intravenöse Therapie und dadurch die häufigeren Konsultationen im Spital sowie die höheren Kosten berücksichtigt werden müssen.
Zudem ist die Einordnung im Vergleich zum FLAURA2-Regime (Kombination von Platin/Pemetrexed),5 für das noch keine OS-Daten publiziert sind, sowie zu späteren potenziellen und bereits zugelassenen Therapieoptionen in der späteren Therapielinie wie Datopotamab-Deruxtecan (+Osimertinib), Patritumab-Deruxtecan, Savolitinib+Osimertinib und Amivantamab in Kombination mit einer Chemotherapie von Bedeutung.
SAVANNAH-Studie:Savolitinib und Osimertinib
Nach der Behandlung mit Osimertinib in der ersten Therapielinie bei NSCLC mit typischen EGFR-Mutationen werden MET-assoziierte Resistenzmechanismen häufig beobachtet. In der Phase-II-Studie SAVANNAH wurde Savolitinib, ein oraler MET-Tyrosinkinase-Inhibitor, in Kombination mit Osimertinib bei Nachweis einer MET-Amplifikation (MET IHC ≥90%) und/oder Überexpression (FISH 10+) nach Progression unter Osimertinib untersucht.6
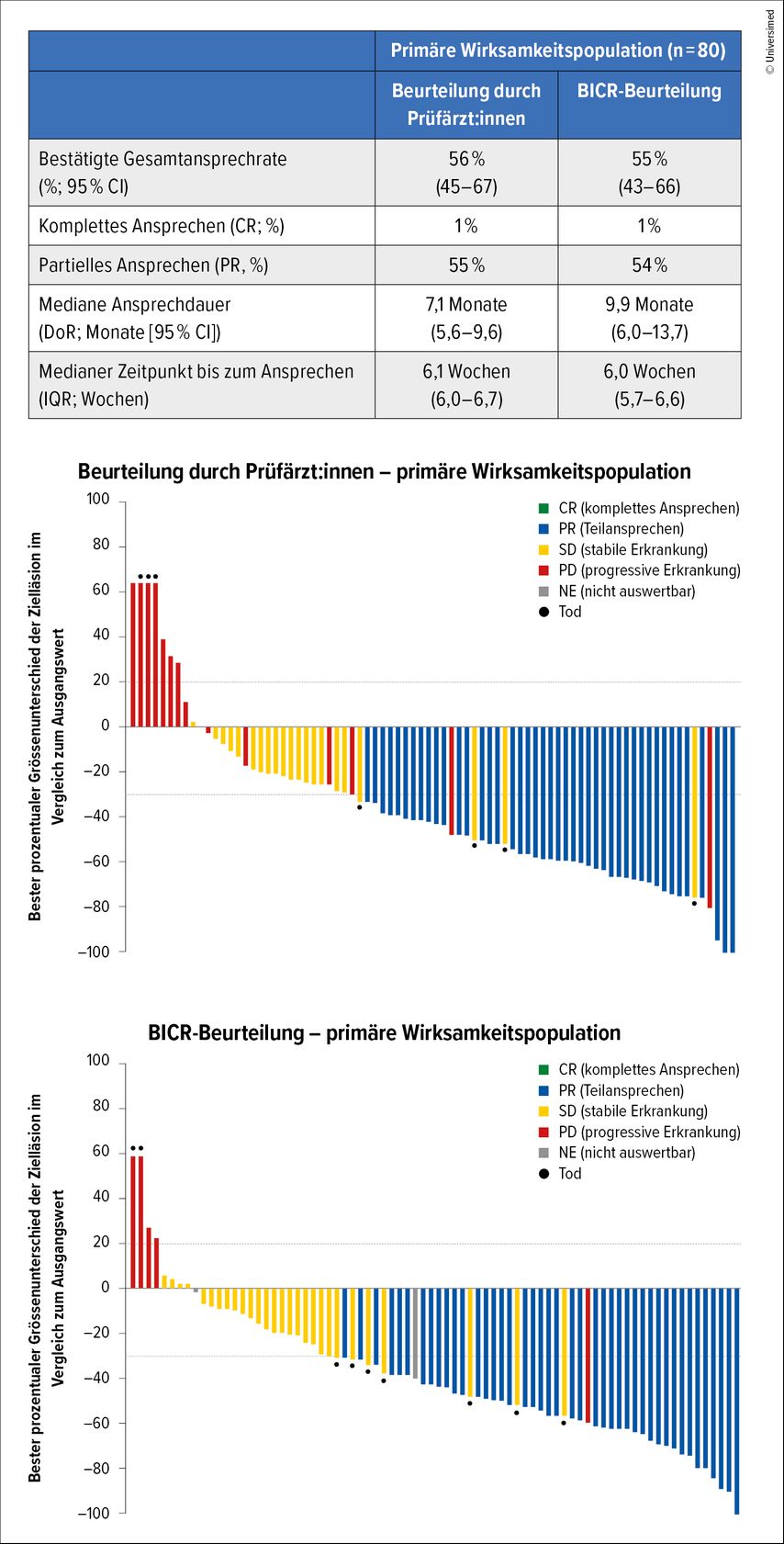
Der primäre Endpunkt der Studie war die durch ein unabhängiges Komitee beurteilte Gesamtansprechrate (ORR). Diese lag bei 55% (95% CI: 43–66) bei einer medianen Zeit des Ansprechens (DoR) von 9,9 Monaten (95% CI: 6–13,7; Abb.2).
Abb. 2: Ansprechen unter Durvalumab plus Trastuzumab-Deruxtecan in der SAVANNAH-Studie (modifiziert nach Ahn MJ et al.)6
Das mediane PFS betrug 7,5 Monate (95% CI: 6,4–11,3). Als häufigste Nebenwirkungen wurden periphere Ödeme und gastrointestinale Toxizitäten beobachtet.
In der Phase-III-Studie SAFFRON (NCT05261399) wird Savolitinib in Kombination mit Osimertinib im Vergleich zur Chemotherapie mit Platin und Pemetrexed weiter untersucht. Leider bleibt der direkte Vergleich mit Chemotherapie in Kombination mit Amivantamab zunächst unbeantwortet.
ORCHARD: Osimertinib+Datopotamab-Deruxtecan nach Progression
Derzeit stehen zahlreiche therapeutische Kombinationsmöglichkeiten für Patient:innen zur Verfügung, die eine Progression nach Osimertinib zeigen. Angesichts der Häufigkeit von EGFR-Mutationen weltweit ist die optimale Therapiesequenz von entscheidender Bedeutung. Aus diesem Grund wurde die biomarkerbasierte Plattformstudie mit dem Namen ORCHARD ins Leben gerufen. In dieser Studie werden verschiedene Kombinationen je nach Resistenzentwicklung nach Osi in unterschiedlichen Modulen evaluiert.
Aus Subgruppenanalysen der TROPION-Lung-Studien ergab sich, dass das gegen Trop2 gerichtete Antikörper-Wirkstoff-Konjugat Datopotamab-Deruxtecan (Dato-DXd) insbesondere bei Patient:innen mit Treibermutationen wirksam sein kann.
Die Phase-II-Daten aus dem ORCHARDModul, in dem Dato-DXd mit Osimertinib kombiniert wurde, wurden präsentiert und zeigten je nach Dosis von Dato-DXd (4mg/kg oder 6mg/kg) ein mPFS von 9,5 bzw. 11,7 Monaten, eine ORR von 43% bzw. 36% und eine DoR von 6,3 bzw. 20,5 Monaten.7 Die Dosis von 6mg/kg wurde als bevorzugte Dosis identifiziert.
Im Sicherheitsprofil traten in den jeweiligen Kohorten keine neuen unerwünschten Ereignisse auf. Die Kombination von Dato-DXd mit oder ohne Osimertinib bei typischen EGFR-Mutationen wird in den Phase-III-Studien TROPIONLung14 und TROPIONLung15 weiter untersucht.
SOHO-01-Studie: neuerperoraler therapeutischer Ansatz
Der orale Tyrosinkinase-Inhibitor BAY 2927088, der reversibel an EGFR und HER2 bindet, wurde in einem Phase-I/II-Design bei Patient:innen untersucht, die naiv gegenüber HER2-gesteuerten Therapien waren, sowie bei Patent:innen, welche nach einer Behandlung mit HER2-gesteuerten ADC einen Progress hatten.
BAY 2927088 zeigte dabei eine bemerkenswerte Wirksamkeit, insbesondere bei HER2-naiven Patient:innen (n=44), mit einer ORR von 70,5% und einer mDoR von 8,7 Monaten (95% CI: 4,5–NE). In der vorbehandelten Patient:innenkohorte (n=34), von denen 82,4% zuvor Trastuzumab-Deruxtecan erhalten hatten, beobachteten wir eine ORR von 35,3% mit einer mDoR von 9,5 Monaten (95% CI: 4,1–NE).
Hinsichtlich der unerwünschten Ereignisse war Durchfall die häufigste Nebenwirkung, wobei 11,5% der Patient:innen eine Dosisreduktion benötigten; jedoch gab es keine Behandlungsunterbrechungen aufgrund von Durchfall. Die Phase-III-Studie SOHO-02 wird diesen neuen Wirkstoff in der Erstlinieneinstellung für NSCLC mit HER2-Mutationen im Vergleich zur Standardtherapie in der palliativen Standard-of-Care-Erstlinientherapie bewerten (NCT06452277).
KRYSTAL-7: Adagrasibund Pembrolizumab
Im Bereich der zielgerichteten Therapien wurde in einem Phase-II-Studien-Design der gegen KRASG12C gerichtete Inhibitor Adagrasib in Kombination mit Pembrolizumab als Erstlinientherapie bei Patient:innen mit NSCLC und einer nachgewiesenen KRAS-G12C-Mutation untersucht. Beim diesjährigen ELCC wurden die Daten derjenigen Subgruppe von Patient:innen gezeigt, die eine PD-L1-Expression ≥50% hatten.8
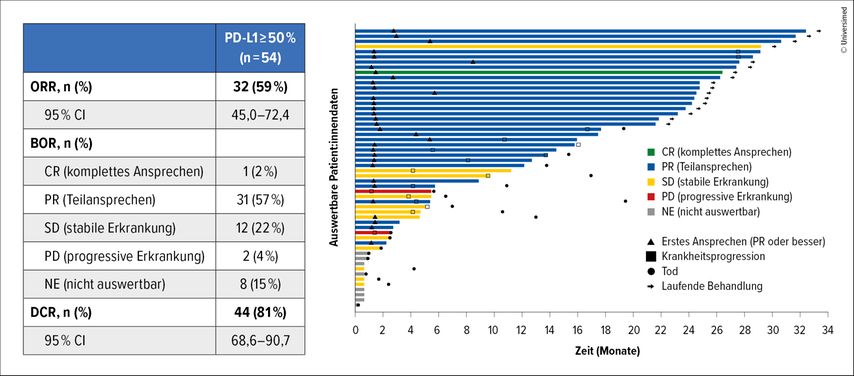
In der KRYSTAL-7-Studie zeigten sich bei den 54 untersuchten Patient:innen eine ORR von 59% (95% CI: 45–72,4) und eine Krankheitskontrollrate (DCR) von 81% (95% CI: 68,6–90,7). Die mediane DoR betrug bemerkenswerte 26,3 Monate (95% CI: 26,3–NE). Das mediane PFS lag bei 27,7 Monaten (95% CI: 8,1–NE), während das mediane Gesamtüberleben (OS) noch nicht erreicht war (Abb.3).
Abb. 3: Lang anhaltende Ansprechraten mit der Kombination aus Adagrasib und Pembrolizumab bei NSCLC mit KRAS-G12C-Mutation und hoher PD-L1-Expression in der Studie KRYSTAL-7 (modifiziert nach Garassino MC et al.)8
An unerwünschten Ereignissen traten vor allem Übelkeit (56%), Durchfall (47%), ALAT-Erhöhung (47%) und ASAT-Erhöhung (36%) auf. In 48% der Fälle kam es zu einer Dosismodifikation von Adagrasib, und in 67% der Fälle wurden Therapieunterbrechungen notwendig. In 7% der Fälle musste Adagrasib abgesetzt werden, während in 17% der Fälle Pembrolizumab gestoppt wurde.
Insgesamt erwies sich die Kombination aus zielgerichteter Therapie und Checkpoint-Blockade als eine sehr effektive Therapieoption mit lang anhaltendem Ansprechen, jedoch auch mit einer erhöhten Toxizität. Diese Kombination wird in einem Phase-III-Design im Vergleich zur Pembrolizumab-Monotherapie weiter untersucht (NCT04613596).
Pembrolizumab subkutanvs. intravenöse Applikation
In einer Phase-III-Studie wurde bei Patient:innen mit NSCLC die subkutane Applikation von Pembrolizumab mit der intravenösen Verabreichung in Kombination mit platinbasierter Chemotherapie verglichen (MK-3475A-D77-Studie).9 Die Ergebnisse zeigten eine Nichtunterlegenheit der subkutanen Applikation. Beide Verabreichungsformen erfolgten alle sechs Wochen.
Das mediane PFS betrug subkutan 8,1 Monate im Vergleich zu 7,8 Monaten intravenös (ORR-Ratio: 1,08; 95% CI: 0,85–1,37), während die mediane Dauer des Ansprechens (DoR) 9,1 Monate für die subkutane und acht Monate für die intravenöse Applikation betrug.
Bei der subkutanen Applikation traten in 2,4% der Fälle unerwünschte Ereignisse an der Injektionsstelle auf, die jeweils als Grad 1 klassifiziert wurden. Die mediane Injektionszeit für das Volumen von 4,8ml lag bei zwei Minuten.
Zusammenfassend gesagt bietet die subkutane Applikation von Pembrolizumab eine Möglichkeit, die Behandlung zeitsparend, ressourcenschonend und ohne Einbussen in der Effektivität durchzuführen.
SAKK 16/14: Durvalumab perioperativ+neoadjuvante Chemotherapie
Verschiedene perioperative Chemoimmuntherapie-Regime konnten bereits erfolgreich in den klinischen Alltag integriert werden. Eine der ersten Studien, die diesen Behandlungsansatz verfolgte, ist die Studie SAKK 16/14.
In dieser Studie erhielten die Patient:innen zunächst drei Zyklen Chemotherapie mit Cisplatin und Docetaxel, gefolgt von zwei Zyklen Durvalumab, bevor eine Operation stattfand. Postoperativ erfolgten zwölf Gaben Durvalumab. Die Studie richtete sich an Patient:innen mit NSCLC im Stadium IIIA(N2).
Bei insgesamt 67 Patient:innen wurde nach zwölf Monaten eine Rate des ereignisfreien Überlebens (EFS) von 73,4% beobachtet (95% CI: 62,7–81,5).10 Die Rate an pathologischen Komplettremissionen (CRR) lag bei 18,2%, während die Rate der sehr guten partiellen Remission («major PRR»), definiert als <10% vitale Tumorzellen, 61,8% betrug.
Beim ELCC wurde nun die finale Analyse der Studie veröffentlicht. Die mediane Nachbeobachtungszeit liegt bei 72 Monaten und ist damit die längste aller bisher publizierten Studien zu neoadjuvanten oder perioperativen Immuntherapien. In der finalen Analyse zeigte sich ein medianes EFS von vier Jahren (95% CI: 2,4–NR) mit einer 5-Jahres-EFS-Rate von 45,9% (95% CI: 31,7–59). Das mOS wurde bei einem medianen Follow-up von 72 Monaten nicht erreicht, während die 5-Jahres-OS-Rate bei 65,8% lag (95% CI: 52,9–76).
Bei Patient:innen mit pathologischer Komplettremission (n=10) betrug die 5-Jahres-EFS-Rate 71,4%, und die OS-Rate lag bei 100%. Bei Patient:innen mit einer signifikanten partiellen Remission (n=34) betrug die 5-Jahres-EFS-Rate 65,7% und die 5-Jahres-OS-Rate 97%. Die PD-L1-Positivität erwies sich, ähnlich wie in anderen Studien, als prädiktiv günstig.
Die Studie SAKK 16/14 bestätigt den Nutzen der perioperativen Chemoimmuntherapie beim lokal fortgeschrittenen Stadium des NSCLC. Aktuell wird eine wichtige Debatte darüber geführt, welche Patient:innen von einer Therapiedeeskalation in Form einer alleinigen neoadjuvanten Chemoimmuntherapie profitieren könnten. Die Daten aus der Studie ETOP 25-23 ADOPT-Lung (NCT06284317) werden möglicherweise diese Frage klären.
Literatur:
1 Cho BC et al.: NEJM 2024; 391: 1486-98 2 Yang JCH et al.: ELCC 2025; Abstr. #4O 3 Girard N et al.: ELCC 2025; Abstr. #10MO 4 Spira AI et al.: J Thorac Oncol 2025; S1556-0864(25)00051-6 5 Planchard D et al.: NEJM 2023; 389: 1935-48 6 Ahn MJ et al.: ELCC 2025; Abstr. #2O 7 LeX et al.: ELCC 2025; Abstr. #1O 8 Garassino MC et al.: ELCC 2025; Abstr. #5MO 9 Felip E et al.: ELCC 2025; Abstr. #8MO 10 Rothschild SI et al.: SAKK 16/14: Durvalumab in addition to neoadjuvant chemotherapy in patients with stage IIIA(N2) non-small-cell lung cancer-a multicenter single-arm phase II trial. J Clin Oncol 2021; 39(26): 2872-80
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...