Eine konventionelle Therapiestudie mit revolutionärem Inhalt
Autor:
PD Dr. med. Boris Eugen Schleiffenbaum
Hämatologie
Klinik Im Park, Zürich
AndreasKlinik Cham, Hirslanden
Die inzwischen rein molekulare Klassifikation der akuten myeloischen Leukämie (AML) nach der International Consensus Conference (ICC) 2022 bzw. in der Revision der WHO 2022 beherrschte viele Gespräche am diesjährigen ASH-Treffen. Im Mittelpunkt stand sie vor allem auch wegen der teilweise unterschiedlichen Kriterien der beiden Klassifikationen und der damit teilweise einhergehenden Verwirrung.
Keypoints
-
Auch die ELN-Risikokriterien 2022 gelten nur für die hergebrachten Induktionstherapien mit einer intensiven Chemotherapie.
-
Unter dem Etikett «AML» finden wir einen ganzen Strauss unterschiedlicher, seltener, akuter myeloischer Erkrankungen. Ein wirkliches Verständnis für die Pathophysiologie und Prognose der Erkrankung erlangen wir nur, indem wir die Daten international vernetzen, wie es in den USA durch die Gruppe «Harmony» vorgemacht wurde. Zu einer Optimierung der Therapie gelangen wir eher durch eine zentrale Koordinierung der so unterschiedlichen Therapien und Therapiestudien entsprechend dem Konzept der Beat-Master-Studie in den USA.
-
Induktions-Kombinationstherapien unter Einbezug von Venetoclax zeigen vielversprechende Ergebnisse bei jüngeren wie auch bei fitten älteren Patienten im De-novo-und im R/R-Setting.
-
Die Kombinationstherapie des CD47-Antikörpers Magrolimab mit Venetoclax/Azacitidin lässt uns auch für unsere Patienten mit TP53-biallelisch mutierter sAML hoffen.
-
Patienten mit R/R-AML werden in Zukunft u.U. direkt einer Stammzelltransplantation zugeführt, ohne den vorherigen Versuch der Reinduktion.
Die Konklusionen, die man aus den Resultaten einer von Dr. Sanchez vorgestellten Studie ziehen konnte, werfen ein neues Licht auf die molekulare Subklassifikation der AML: Dr. Sanchez statuierte, dass die Bedeutung des NPM1-Mutationsstatus entscheidend von der Zahl und Art der Komutationen abhängig ist. Stärker noch ändert diese Aussage den Blick auf die Kriterien zur Risikostratifizierung 2022 des European LeukemiaNet (ELN).1
Hartmut Döhner, der Vater der ELN-Risikokriterien, wies in einer seiner Präsentationen nach, worauf die Autoren der Kriterien schon bei deren Publikation aufmerksam gemacht hatten: Die Kriterien gelten nur für die klassischen, intensiven Chemotherapien, nicht aber für die neuen Therapien, wie zum Beispiel jene mit Venetoclax und Azacitidin (Ven-Aza).2
Nachdem gezeigt werden konnte, dass die Prognose einer AML biologisch im Wesentlichen durch die Chromosomenaberrationen und die molekularen Mutationen definiert ist, sollten in Zukunft die primäre Auswahl und die Intensität der Therapien aller Patienten nur auf Grundlage der molekularen Biologie der Erkrankung erfolgen. Eingeschränkt werden diese Entscheidungen natürlich weiterhin durch das Alter und die Komorbiditäten des Patienten, nicht aber durch die Entitäten «sekundär» (sAML, nach myelodysplastischem Syndrom [MDS] oder MDS/myeloproliferativer Neoplasie [MPN]), «therapieassoziiert» (tAML, nach Chemo- oder Radiotherapie) oder «myelodysplasia-related» (mit entsprechenden morphologisch-myelodysplastischen Veränderungen). Diese ehemaligen Subgruppen gelten fortab nur mehr als qualifizierend.3
Dies wurde nochmals durch eine retrospektive Studie aus der Charité bestätigt: tAML zeigen zwar vermehrt negative patientenspezifische und molekularbiologische Prognosefaktoren, die vorgängige Chemotherapie ist aber kein unabhängiger eigener Risikofaktor.4
Therapien einer De-novo-AML
Eine über drei Jahrzehnte durchgeführte retrospektive Studie der Cancer and Leukemia Group B (CALGB) konnte bei Patienten mit CBFB-MYH11- und RUNX1-RUNX1T1-Mutationen zeigen, dass beide Subtypen der AML in etwa eine gleich günstige Prognose haben, die jeweils gebessert wird, wenn die Patienten mehr als drei Zyklen hoch dosiertes Cytarabin (HiDAC) in der Konsolidation erhalten. Sekundäre Chromosomenaberrationen, inklusive einer Trisomie 8 und eines komplexen Karyotyps, hatten keinen Einfluss auf die Prognose, wohl aber eine Tyrosinkinase-KIT-Komutation.5
Eine australische Gruppe berichtete über die Kombination einer «5+2»-Therapie (Cytarabin [araC] 100mg/m2, Tage 8–14; Idarubicin [Ida] 12mg/m2, Tage 8+9) mit Venetoclax («ramp-up»: Tage 1–7, Enddosis 50/100/200/400/600mg, Tage 8–14) in der Induktion und Konsolidation (4x«2+1») bei älteren Patienten (>65 Jahre/>60 Jahre und monosomaler Karyotyp)mit AML in der Erstlinie.
Auch mit der maximalen Venetoclax-Dosis von 600mg wurde diese Therapie relativ gut vertragen (therapiebedingte Nebenwirkungen [TEAE] von Grad 3: TLS: 0%, febrile Neutropenie: 67%, Sepsis: 28%, lokale Entzündung: 17%; 30-Tages-Mortalität: 4%). Je nach Risikoprofil zeigte sie ein sehr unterschiedliches Ansprechen:
-
Komplettremission (CR): 73% vs. de novo 90%, sAML: 51%
-
medianes Gesamtüberleben (mOS): 15,4 Monate (M.) vs. de novo 31,3 M. vs. sAML 6,3 M. vs. NPM1mut 43,4 M. vs. IDH2mut 43,9 M. vs. TP53mut 3,6 M.
Eine gleichzeitige Prophylaxe mit Posaconazol erwies sich als schwierig und machte eine massive Reduktion von Venetoclax notwendig.
In der geplanten Phase-III-Studie ist beim Vergleich mit dem klassischen «7+3»-Schema eine solche Prophylaxe generell nicht mehr vorgesehen und wird allenfalls bei strenger Indikation in den Venetoclax-freien Intervallen erfolgen.6
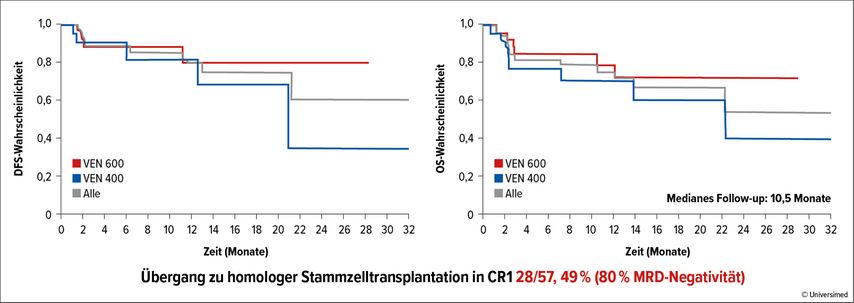
Eine vom Prinzip her ähnliche Therapie wurde von einer italienischen Gruppe in einer Dosisfindungsstudie getestet (Venetoclax 400mg vs. 600mg). Im Hinblick auf die ausgewählte «Intermediate risk»- oder «High risk»-Population jüngerer AML-Patienten (<65 Jahren) wurde sie mit einer deutlich intensiveren Chemotherapie kombiniert (FLAI: Fludarabin 30mg/m2, Tage 1–5, AraC 2g/m2, Tage 1–5, Ida 8mg/m2, Tage 1,3,5). Die Studienpopulation zeigte im Vergleich mit einer «propensity-matched» historischen Kontrolle («7+3») ein ausserordentlich gutes Ansprechen (vollständiges klinisches Ansprechen [cCR]: 86,7% vs. 68,6%, minimale Resterkrankung [MRD]: 74,0% vs. 48,9%), wobei die höhere Venetoclax-Dosis nochmals deutlich besser abschnitt (Abb. 1; CR: 70%, 82% vs. 58%, Gesamt-MRD: 74%, 78% vs. 67%)– und das bei einer durchaus vertretbaren Toxizität (vor allem infektiöse TEAE; 30-Tages-Mortalität: 1,8%, 60-Tages-Mortalität: 5,3%).7
Von grosser praktischer Bedeutung in der Behandlung sind die Ergebnisse einer französischen Studie, die zeigen konnte, dass die Reduktion der Dauer der Behandlung mit Venetoclax (400mg/d p.o.) auf sieben von 28 Tagen im Zyklus parallel zur Gabe von Azacitidin (75mg/m2 s.c. Tage 1–7) in der Kombinationstherapie älterer, nicht fitter AML-Patienten bei Vermeidung von schwereren Nebenwirkungen der Therapie zu sehr ansprechenden Ergebnissen führen kann.8
Neue Wege beschritt eine spanische Gruppe, die den epigenetischen Enzym-LSD1/KDM1A-Inhibitor Iadademstat (60/90μg p.o. Tage 1–5/Woche) in Kombination mit Azacitidin (75mg/d s.c. Tage 1–7, 28-Tages-Zyklus) in einer einarmigen Open-Label-Phase-IIa-Studie bei nicht fitten AML-Patienten in der Erstlinie mit ausgesprochenem Erfolg und gut beherrschbaren Nebenwirkungen testete:9
-
CR/CRi: 64%
-
MRD-negativ: 82%
-
Transfusionsunabhängigkeit: 71%
-
Ansprechen in 86% innerhalb von zwei Zyklen
Stoffwechselspezifische Therapien
NPM1 und KMT2A
Revumenib inhibiert die Interaktion von Menin und KMT2A, indem es im Menin kompetitiv an der Tasche bindet, an der auch KMT2A bindet. Dadurch kommt es zu einer Auflösung des Transkriptionskomplexes aus Menin und KMT2Ar bzw. Menin, NPM1mut und KMT2A. Diese Auflösung wiederum reguliert die Transkription von MEIS1 und HOXA9 herunter und ermöglicht über die damit verbundenen epigenetischen Veränderungen eine Wiederaufnahme der Zelldifferenzierung und schlussendlich auch der Apoptose.
Dr. Ghayas berichtete über die ersten Ergebnisse der Phase-I-Studie AUGMENT-101, einer Monotherapie-Dosisfindungsstudie mit R/R (rezidivierten/refraktären) AML-Patienten:10,11,12
-
Komplettremission: 30% (78% MRD-negativ)
-
mediane Zeit bis zum Rezidiv (TTR): 1,9 Monate
-
mediane Zeit bis zum Ansprechen (mDOR): 9,1 Monate
-
mOS: 7 Monate
-
T-Prolymphozyten-Leukämie (TPL): 38%
Neben der Herunterregulierung von MEIS1 und HOXA9 konnte auch die «down-stream» davon gelegene Herabregulierung von FLT3 gezeigt werden, wie auch die Differenzierung der AML-Blasten im Knochenmark.
Die Nebenwirkungen ergeben sich teilweise direkt aus dem Wirkmechanismus:12
-
QTc-Verlängerung: Grad 3 in 10% der empfohlenen Phase-II-Dosis (RP2D; 130/160mg/m2 bzw. 65/95mg/m2 bei Komedikation starker CYP3A5-Inhibitoren)
-
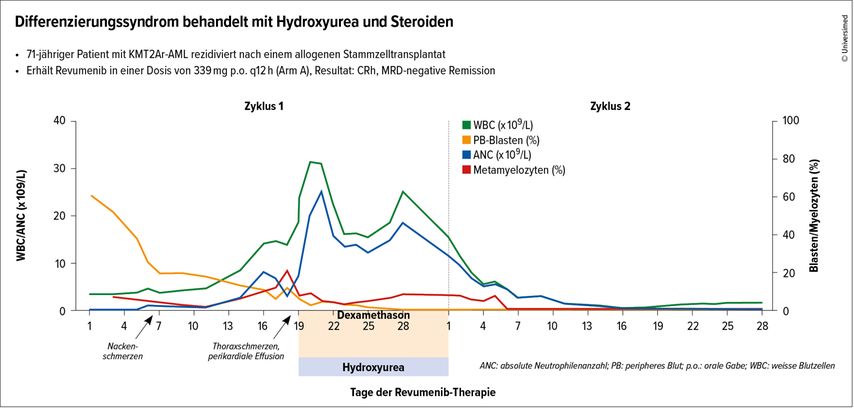
Differenzierungssyndrom: 16% (Abb. 2; rascher Neutrophilen-Anstieg im peripheren Blut, Dyspnoe/Hypoxie, pulmonale Infiltrate, Pleura- und Perikard-Erguss, Ödeme, Niereninsuffizienz, Exanthem, Lymphadenopathie)
Abb. 2: Differenzierungssyndrom behandelt mit Hydroxyurea und Steroiden. Modifiziert nach Ghayas CI et al. 202212
Mit Ziftomenib, einem anderen Menin-Inhibitor, konnten ähnlich gute Ergebnisse für Patienten mit R/R AML mit NPM1mut, aber nicht für jene mit R/R AML und KMT2Ar erzielt werden:13,14
-
partielle Remission [CRi]: 30% vs. 5,6%
-
MRD-negativ: 42,9% vs. 100%
FLT3
Die Kombination einer klassischen Induktion mit dem FLT3-Inhibitor der ersten Generation, Midostaurin, ist jetzt schon seit Jahren Standard in der Therapie jüngerer AML-Patienten mit FLT3mut, wie auch die Gilteritinib-Monotherapie in der Reinduktion im R/R Setting.
Das MD Anderson Cancer Center der University of Texas präsentierte jetzt vielversprechende Daten einer Phase-I-Studie zur Behandlung von Patienten, für die eine intensive Induktionschemotherapie nicht infrage kommt. Die Studie untersuchte die Kombination von Venetoclax (400mg/d p.o. nach 3 Tagen «ramp-up» im 1. Zyklus über 28 Tage) und Azacitidin (75mg/m2 s.c./i.v., Tage 1–7) mit Gilteritinib (80mg vs. 120mg p.o., Tage 1–28) in der Erstlinientherapie wie auch bei R/R AML-Patienten mit einer FLT3-Mutation.
Sie fand eine ausserordentlich hohe Rate an CR (92% Erstlinientherapie vs. 20% R/R), MRD-Negativität (82% Erstlinientherapie vs. 43% R/R), mit einem rezidivfreien Einjahresüberleben von 74% bei Erstlinientherapie vs. 25% bei R/R und einem 1-Jahres-Gesamtüberleben von 85% bei Erstlinientherapie vs. 30% R/R. Unabhängig vom MRD-Status konnte ein Grossteil der Patienten zur Transplantation gebracht werden (MRD-positiv 91%, MRD-negativ 80%). Die Therapie war gut verträglich (TEAE von Grad 3: Tumorlyse-Syndrom [TLS]: 4%, Infekte: 22%, zudem leichtere gastrointestinale Nebenwirkungen und selten auch QT-Verlängerungen). Aufgrund einer verzögerten Erholung der Neutrophilen-Werte (Zyklus 1 >500G/L median über 37 Tage) und Thrombozyten-Werte (Zyklus 1>50G/L median über 25 Tage) vor allem in der Konsolidation (Venetoclax 400mg p.o., Tage 1–28, Azacitidin 75mg/m2, Tage 1–7, Gilteritinib, Tage 1–5) wurde für die Phase II für Gilteritinib eine Dosis von 80mg gewählt. Zudem musste im Weiteren in vielen Fällen eine Dosisreduktion vorgenommen werden (Venetoclax 33%, Azacitidin 38%, Gilteritinib 33%).15
IDH1/IDH2
In einer Studie der Beat-AML-Master-Trials untersuchten E. Stein und Kollegen, ob AML-Patienten mit IDH1mut, für die eine Induktionschemotherapie nicht infrage kommt, mit einer initialen Enasidenib-Monotherapie (100mg/d über 5 Zyklen [28 Tage]; bei CR/CRi weiter bis zur Progression/Unverträglichkeit) erfolgreich behandelt werden können, wenn jene, die keine CR/CRi erreichen, mit einer Kombinationstherapie aus Enasidenib/Azacitidin nachbehandelt werden (75mg/m2 s.c., Tage 1–7, 4 Zyklen; bei CR/CRi weiter über 12 Zyklen mit anschliesssender Enasidenib-Erhaltungstherapie bis zur Progression/Unverträglichkeit).
Im Beat-AML-Master-Trial werden Patienten innerhalb von sieben Tagen einer ihren Mutationen entsprechenden stoffwechselspezifischen Therapie zugewiesen, oder, falls keine solche Therapie zur Verfügung steht, einer anderen Studie mit einem neuen Therapeutikum.
Die Patienten, die unter Enasidenib allein (CR/CRi: 48%, mDur: 11,1 Monate, mOS: 17,1 Monate) nicht erfolgreich induziert werden konnten, erreichten in der Kombinationstherapie sekundär häufig noch eine CR/CRi (42%, mDur: 14,6 Monate, mOS: 12,5 Monate) bei einer ähnlichen Rate an Nebenwirkungen (TLS: 3% vs. 0%, Differenzierungssyndrom: 23,3% vs. 17,6%, zudem Nausea, Inappetenz und Diarrhö als wesentliche nichthämatologische Nebenwirkungen).
Im Gegensatz zu den Autoren ziehe ich jedoch daraus den Schluss, dass alle Patienten initial mit der Kombination aus Enasidenib/Azacitidin behandelt werden sollten. Die Begründung sehe ich darin, dass u.U. auch die Patienten, die unter einer Monotherapie eine CR/CRi erreichten, möglicherweise eine tiefere und längere Remission erreicht hätten, und die Patienten, die keine CR/CRi unter der Monotherapie erreichten (immerhin 52%), von Anfang an richtig und damit besser behandelt worden wären.16
MRD
Seit fast 40 Jahren schon ist die Frage der MRD Teil der Diskussion in der Therapie der AML. In den letzten Jahren hat nun die MRD in den Alltag der Behandlung der AML Einzug gehalten. MRD-positive Patienten haben nach Induktion und Konsolidation eine schlechtere Prognose. Daher werden heute MRD-positive Patienten mit einem «intermediate» oder sogar auch mit einem «favourable» ELN2022-Risikoprofil meist einer Transplantation zugeführt.17
Ähnlich kann der MRD-Status (>/=1 Log-Anstieg) auch für die Entscheidung zur Reinduktion genutzt werden (Venetoclax 600mg/d p.o., Tage 1–28, Low-Dose-AraC 20mg/m2 i.v., Tage 1–10). In einer MRD-gesteuerten Interventionsstudie gelang so die Reinduktion (1–3 Log-Reduktion: 8%, >3 Log-Reduktion: 8%, MRD-negativ: 54%) mit einem entsprechend guten konsekutiven ereignisfreien Überleben (EFS) über zwei Jahre (55,4%) und OS über zwei Jahre (72,6%). Ein guter Teil der Patienten (42%) konnte erfolgreich eine Transplantation erhalten (2-Jahres-OS: 65,0%).18
Ein ganz besonders interessanter Aspekt des MRD-Konzepts wäre die Wiedereinführung der Immunüberwachung der Patienten mit reduzierter Tumorlast, die in der klinisch ausgebrochenen Leukämie offensichtlich verloren gegangen ist. Dr. Van de Loosdrecht und Kollegen hatten in ihrer Phase-II-Studie AML-Patienten in MRD-positiver CR1, für die eine Stammzelltransplantation nicht infrage kam, mit einem Cocktail aus dendritischen Zellen intradermal geimpft (Tage 0,2,4,6,14,18). Die dendritischen Zellen hatten sie aus AML-Blasten-Zelllinien in Kultur gewonnen. Somit exprimierten die Zellen multiple Tumor-Antigene.
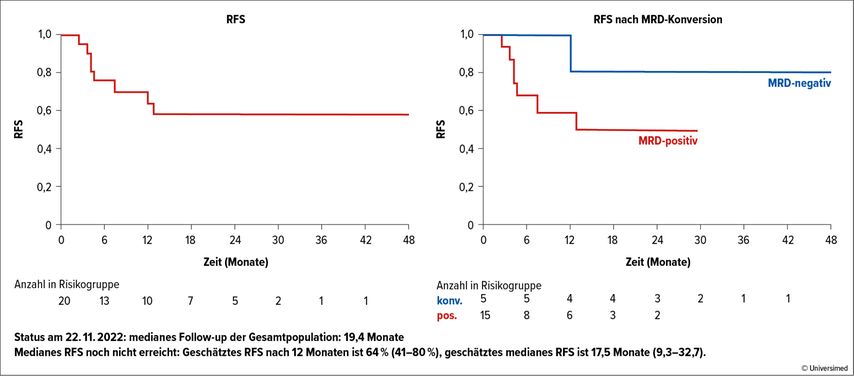
In fünf von zwanzig Patienten kam es zu einer MRD-Konversion, in zwei von zwanzig Patienten zu einer 1-Log-MRD-Reduktion (zusammen 7/20 oder 35%). Die gemessene tumorspezifische Immunreaktion (γ-IFN) korrelierte indirekt mit der Wahrscheinlichkeit für ein Rezidiv und mit einem numerisch besseren rezidivfreien Überleben (RFS) wie auch OS in den MRD-konvertierten Patienten (geschätztes mRFS: 17,5 Monate, mOS: 30,3 Monate in der Gesamtpopulation). Ein weiterer Vorteil dieser Therapie mit einem «Off the shelf»-Medikament liegt zudem in den äusserst geringen Nebenwirkungen (Abb. 3; vor allem lokale Impfreaktionen).19
Abb. 3: Daten zum rezidivfreien Überleben (RFS) in der Studie ADVANCE II. Modifiziert nach Van de Loosdrecht AA et al. 202219
Retrospektive Studien der European Society for Blood and Marrow Transplantation (EBMT) deuten darauf hin, dass die MRD nicht nur eine prognostische Bedeutung hat, sondern auch einen prädiktiven Wert, da in Kenntnis des MRD-Status neue, wesentliche Therapieentscheidungen getroffen werden können. So konnte in diesen Studien gezeigt werden, dass MRD-positive Patienten von einer MAC-Transplantation mehr zu profitieren scheinen als von einer RIC-Transplantation. Definitiv kann die Frage des prognostischen bzw. prädiktiven Wertes der MRD aber nur in randomisierten kontrollierten Studien (RCT) entschieden werden;17siehe auch weiter unten eine Studie zur Transplantation von R/R AML-Patienten plus/minus vorgängige Reinduktion.20
Rezidivierte/refraktäre AML mitHochrisiko
Eine retrospektive Studie aus der Mayo Clinic machte auf die ausserordentlich schlechte Prognose von R/R AML-Patienten nach einer Ven-HMA(Azacitidin oder Decitabin)-Therapie aufmerksam (OS rezidiviert: 3,1 Monate, OS refraktär: 2,9 Monate), mit besonders schlechter Prognose der Patienten mit einer TP53-, RAS- oder ASXL1-Mutation.21
TP53
Im angeborenen Immunsystem wird die Phagozytose der Makrophagen durch pro- (Calreticulin) und antiphagozytäre Signale (CD47) geregelt. Krebszellen vermeiden die Phagozytose durch Überexpression von CD47, wie erstmals für die AML gezeigt.22 Magrolimab, ein humanisierter IgG4-anti-CD47-Antikörper, restauriert die Phagozytose von Leukämiestammzellen (LSC) in vitro und in vivo.23 Als Monotherapie bei der R/R AML war Magrolimab zwar sicher, aber ineffektiv.24
Aufgrund präklinischer Daten (Azacitidin führt zu einer vermehrten Expression von Calreticulin auf AML-Zellen) wurde die Kombination von Azacitidin und Magrolimab in einer Phase-Ib-Studie getestet, diesmal mit grossem klinischem Erfolg.25,26 Angesichts der Effektivität der Kombinationstherapie aus Azacitidin (75mg/m2 s.c., Tage 1–7) und Venetoclax (400mg/d p.o., Tage 1–28, nach «ramp up») in der Behandlung der AML war es naheliegend, diese Kombination in der Phase-Ib/II-Studie um Magrolimab zu erweitern (C1 2x/Woche, C2 1x/Woche, C3+ alle 2 Wochen; 1mg/kgKG C1d1; 15mg/kgKG C1d4+8; 30mg/kgKG C1d11+; Dosis = RP2D der Phase Ib).27
Darauf aufbauend stellte Dr. Daver die Ergebnisse der Phase-II-Studie (gleiches Therapieschema, jedoch mit einer variablen Dauer der Venetoclax-Gabe [Tage 21,28]) vor:
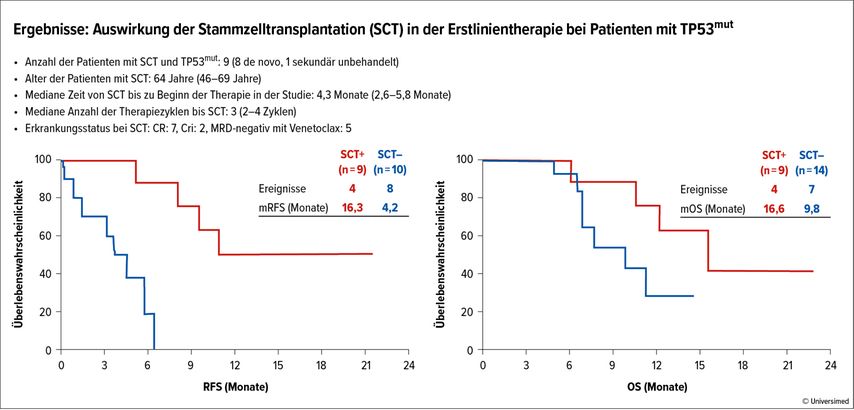
In Patienten mit neu diagnostizierter (ND) AML mit TP53mut gelang eine CR bei 42%, mit einer 18-Monats-DOR von 52% und einem 12-Monats-OS von 53% (Ven-HMA vs. Aza-Ven-Magrolimab; «propensity-matched» mOS: 3,5 Monate vs. 10,4 Monate). Diese Ergebnisse bereiteten die Brücke zur entscheidenden Transplantation (Abb. 4; TPL+/– mRFS 16,3 Monate vs. 4,2 Monate, mOS 16,6 Monate vs. 9,8 Monate). Bei den Patienten, die auf die Therapie ansprachen, konnte ein im Schnitt stärker ausgeprägter Rückgang der TP53-VAF nachgewiesen werden als in den Patienten, die nicht ansprachen.
Abb. 4: Auswirkung der Stammzelltransplantation (SCT) in der Erstlinientherapie bei Patienten mit TP53mut. Modifiziert nach Chua CC et al. 20226
Weit besser noch war das Ansprechen in AML-Patienten mit ND TP53wt:
-
CR/CRi: 88%
-
CR: 56%
-
18-Monats-DOR: 74%
-
12-Monats-OS: 83%
Im R/R Setting zeigten vor allem die Venetoclax-vorexponierten Patienten einen ausserordentlich schlechten Verlauf:
R/R AML Ven-exposed:
-
CR: 0%
-
CR/CRi: 11%
-
mRFS: 7,5 Monate
-
mOS: 5,6 Monate
R/R AML Ven-naiv:
-
CR: 39%
-
CR/CRi: 44%
-
mRFS: 3,1 Monate
-
mOS: 3,1 Monate
Insgesamt war die Rate an Nebenwirkungen hoch (90% mindestens eine TRAE >/= Grad 3: febrile Neutropenie, Lungenentzündung, Sepsis). Zudem muss bei der CD47-Therapie inhärent mit einem initialen Abfall des Hämoglobinwertes (Hb) gerechnet werden, da alternde Erythrozyten in zunehmendem Mass CD47 exprimieren (Hb-Abfall: 12g/L, 0–39g/L).28
Mein Enthusiasmus speist sich aber auch aus dem biologischen Konzept der Studie. Es werden hier drei insgesamt gut verträgliche therapeutische Prinzipien miteinander kombiniert: der hypomethylierende epigenetische, teilweise wohl auch chemotherapeutische Ansatz von Azacitidin, die Anti-Anti-Apoptose von Venetoclax und die Reaktivierung der CD47-supprimierten Phagozytose von Magrolimab. Aber auch insgesamt scheint gerade diese Kombination biologisch sinnvoll. Die durch Azacitidin und Venetoclax bewirkten Schäden bzw. Veränderungen an der Tumorzelle induzieren die Expression von Calreticulin und machen so die Phagozytose der Zelle mit der Gabe des Anti-CD47-Antikörpers (Magrolimab) erst möglich.
Alle drei therapeutischen Prinzipien sind nicht mutationsspezifisch, was der Tumorzelle die Möglichkeit zum Ausweichen durch erneute Mutation geben würde, sondern zielen differenziell auf die AML-Zelle. CD47 ist ein LSC(leukämische Stammzelle)-Marker. Die Kombinationstherapie aus Azacitidin und Magrolimab reduziert CD34/CD38-LSC im Knochenmark. Dies macht Hoffnung auf lang anhaltende Remissionen. Es darf angenommen werden, dass die Wirkung auf LSC nachgewiesen werden kann, wahrscheinlich in vermehrtem Masse auch für die hier diskutierte Dreiertherapie. Dass auch die Organisatoren des ASH-Treffens diese Ansicht teilen, zeigt, dass der Wallace H. Coulter Award an Irving Weissman ging, den Entdecker des CD47-Mechanismus und Ingenieur von Magrolimab.
Der vierte Vortrag der «Plenary Session», der meiner Ansicht nach die Philosophie der Transplantation bei AML vom Kopf auf die Füsse stellen wird, wurde nicht vom Erstautor, sondern vom Letztautor gehalten – von Johannes Schetelig, MD, MSc.20 In der vorgestellten multizentrischen, randomisierten, Open-Label- Phase-III-Studie konnte gezeigt werden, dass die chemotherapeutische Reinduktion (HAM, AraC, 2x3g, Tage 1–3; Mitoxantron, 10mg/m2, Tage 3–5) mit dem Ziel, eine CR2 zu erreichen, verglichen mit der direkten Transplantation ohne vorgängige Chemotherapie zu keinem grösseren Therapieerfolg führt (56-Tages-RFS: 81,0% vs. 83,5%; kein Unterschied im RFS gerechnet von Tag 56 bzw. im OS, gerechnet vom Zeitpunkt der Randomisierung), wohl aber vermehrte Nebenwirkungen (ernste Nebenwirkungen [SAE] >/= Grad 3: 64% vs. 23%) und einen längeren Krankenhausaufenthalt zur Folge hat (42 Tage vs. 19 Tage).
Interessanterweise war gerade die Frage der Transplantation im R/R AML-Setting anderntags Thema der «Educational Session».29 Nur 300 von 3200 Patienten in den USA erhalten pro Jahr im R/R Setting eine Transplantation, u.a. deswegen, weil alle bisherigen Studien zeigten, dass nicht nur bei Patienten in einer CR/CRi im Vergleich zu Patienten, die die Remission nicht erreicht hatten, die besseren Ergebnisse erzielt werden konnten, sondern auch bei MRD-negativen AML-Patienten im Vergleich zu MRD-positiven Patienten. Dr. Weisberg machte allerdings selbst darauf aufmerksam, dass all diesen Studien ein Selektions-Bias anhaftet, da nur die Patienten mit Transplantationen Teil der jeweiligen Studie waren.
Gerade dieses Bias trifft nun aber für die jetzt vorliegende deutsche Studie nicht zu. Die Autoren konnten zudem zeigen, dass alle, auch die während der «Educational Session» diskutierten, Risikofaktoren (Alter, Performance Status, ELN-Score/Zytogenetik, Historie der vorgängigen Chemotherapie) einer Transplantation im R/R Setting durch die Randomisierung zwischen den beiden Therapiekohorten erfolgreich balanciert waren. Auch ergab die Subgruppen-Analyse nur für jüngere Patienten mit einem niedrigen HCT-CI und einer De-novo-AML mit eher günstigem ELN-Risikoscore Vorteile für die Vorinduktion mit Chemotherapie.
Auf Grundlage dieser Daten wird es in Zukunft nicht mehr um eine vorsichtige Auswahl jener Fälle gehen, in denen transplantiert werden soll, sondern vielmehr darum, möglichst bei allen Patienten mit R/R-AML direkt ohne vorgängige Chemotherapie eine Transplantation durchzuführen.
Literatur:
1 Sánchez AH et al.: Machine learning allows the identification of new co-mutational patterns with prognostic implications in NPM1 mutated AML – results of the European Harmony Alliance. ASH 2022; Abstr. #304 2 Döhner MD et al.: ELN risk stratification is not predictive of outcomes for treatment-naïve patients with acute myeloid leukemia treated with venetoclax and azacitidine. ASH 2022; Abstr. #602 3 Matthews A, Pratz KW: Optimizing outcomes in secondary AML. Hematology Am Soc Hematol Educ Program 2022; 2022(1): 23-9 4 Gross S et al.: Therapy-related AML: clinical/biological features and long-term outcome in a cohort of 1133 adult AML patients. ASH 2022; Abstr. #539 5 Hyak J et al.: Characterization of survival outcomes and clinical and molecular modulators in adult patients with core-binding factor acute myeloid leukemia (CBF-AML) treated with HiDAC consolidation: an alliance legacy study. ASH 2022; Abstr. #536 6 Chua CC et al.: High response and prolonged treatment-free remission after a short-course of modified intensive chemotherapy and venetoclax in elderly AML: an updated analysis of the CAVEAT trial. ASH 2022; Abstr. #711 7 Marconi G et al.: Gimema AML1718 part 1: planned interim analysis of a safety run-in and phase 2 open-label study of venetoclax, fludarabine, idarubicin and cytarabine (V-FLAI) in the induction therapy of non low-risk acute myeloid leukemia. ASH 2022; Abstr. #710 8 Willekens C et al.: Reduced venetoclax exposition to seven days of azacitidine is efficient in treatment-naïve patients with acute myeloid leukemia. ASH 2022; Abstr. #222 9 Salamero O et al.: Iadademstat combination with azacitidine is a safe and effective treatment in first line acute myeloid leukemia. Final results of the ALICE trial. ASH 2022; Abstr. #712 10 Stein EM et al.: Safety and efficacy of menin inhibition in patients with MLL-rearranged and NPM1 mutant acute leukemia: a phase 1, first-in-human study of SNDX-5613 (AUGMENT 101). ASH 2021; Abstr. #699 11 Ghayas CI et al.: Outcomes after transplant in rapsed/refractory KMT2Ar (MLLr) and mNPM1 (NPM1c) leukemia patients achieving remissions after menin inhibition: SNDX-5613 (revumenib) Ph1 experience. ASH 2022; Abstr. #376 12 Ghayas CI et al.: The menin inhibitor SNDX-5613 (revumenib) leads to durable responses in patients (Pts) with KMT2A-rearranged or NPM1 mutant AML: updated results of a phase (Ph) 1 study. ASH 2022; Abstr. #63 13 Wang ES et al.: Preliminary data on a phase 1/2a first in human study of the menin-KMT2a (mll) inhibitor KO-539 in patients with relapsed or refractory acute myeloid leukemia. ASH 2020; Abstr. #115 14 Erba HP et al.: Update on a phase 1/2 first-in-human study of the menin-KMT2A (MLL) inhibitor ziftomenib (KO-539) in patients with relapsed or refractory acute myeloid leukemia. ASH 2022; Abstr. #64 15 Short N et al.: Updated results from a phase I/II study of the triplet combination of azacitidine, venetoclax and gilteritinib for patients with FLT3-mutated acute myeloid leukemia. ASH 2022; Abstr. #831 16 Stein E at al.: A risk-adapted study to assess the efficacy of enasidenib and subsequent response-driven addition of azacitidine for newly diagnosed IDH2-mutant AML patients: 3-year follow-up. ASH 2022; Abstr. #834 17 Hourigan CS: Achieving MRD negativity in AML: how important is this and how do we get there? Hematology Am Soc Hematol Educ Program 2022; 2022(1): 9-14 18 Tiong IS et al.: A prospective phase 2 study of venetoclax and low dose Ara-C (VALDAC) to target rising molecular measurable residual disease and early relapse in acute myeloid leukemia. ASH 2022; Abstr. #606 19 Van de Loosdrecht AA et al.: Use of an allogeneic leukemia-derived dendritic cell vaccine in MRD+ AML-patients results in MRD conversion, improved relapse-free survival and vaccine induced immune responses to tumor antigens. ASH 2022; Abstr. #713 20 Stelljes M et al.: In patients with relapsed/refractory AML sequential conditioning and immediate allogeneic stem cell transplantation (allo-HCT) results in similar overall and leukemia-free survival compared to intensive remission induction chemotherapy followed by Allo-HCT: results from the randomized phase III ASAP trial. ASH 2022; Abstr. #4 21 Ilyas R et al.: Outcome of patients with acute myeloid leukemia following failure of front-line venetoclax plus hypomethylating agent therapy. ASH 2022; Abstr. #537 22 Jaiswal S et al.: CD47 is upregulated on circulating hematopoietic stem cells and leukemia cells to avoid phagocytosis. Cell 2009; 138(2): 271-85 23 Majeti R et al.: CD47 is an adverse prognostic factor and therapeutic antibody target on human acute myeloid leukemia stem cells. Cell 2009; 138(2): 286-99 24 Vyas P et al.: Initial phase 1 results of the first-in-class anti-CD47 antibody Hu5F9-G4 in relapsed/refractory acute myeloid leukemia patients. EHA 2018; Abstr. #PF232 25 Sallman DA et al.: The first-in-class anti-CD47 antibody magrolimab combined with azacitidine is well-tolerated and effective in AML patients: phase 1b results. ASH 2020; Abstr. #330 26 Sallman DA et al.: The first-in-class anti-CD47 antibody magrolimab (5F9) in combination with azacitidine is effective in MDS and AML patients: ongoing phase 1b results. ASH 2019; Abstr. #569 27 Yannan J et al.: Combined blockade of CD47-sirpa interaction by 5F9 (magrolimab) and azacitidine/venetoclax therapy facilitates macrophage-mediated anti-leukemia efficacy in AML pre-clinical models. ASH 2021;Abstr. #510 28 Daver N et al.: Phase I/II study of azacitidine (AZA) with venetoclax (VEN) and magrolimab (magro) in patients (pts) with newly diagnosed (ND) older/unfit or high-risk acute myeloid leukemia (AML) and relapsed/refractory (R/R) AML. ASH 2022; Abstr. #61 29 Weisdorf D: To transplant or not to transplant in active or high-risk myeloid disease: allogeneic transplantation for advanced acute leukemia. Hematology Am Soc Hematol Educ Program 2022; 2022(1): 534-8
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...