Die Therapie des metastasierten Urothelkarzinoms schreibt Geschichte
Autor:innen:
PD Dr. med. Ursula Vogl
Dr. med. Alberto Badellino
Istituto Oncologico della Svizzera Italiana (IOSI), Bellinzona
Korrespondenz:
E-Mail: ursula.vogl@eoc.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Im Jahr 2023 wurden einige wichtige klinische Studiendaten in Rahmen der grossen Kongresse ASCOGU, ASCO und ESMO präsentiert. Einige davon sind auch «practice changing». Einige wissenschaftlich sehr interessante Daten müssen noch in weiteren Studien gefestigt werden, um unmittelbar in der klinischen Praxis anwendbar zu sein. Ein Meilenstein des Jahres 2023 wurde beim metastasierten Urothelkarzinom in der Erstlinientherapie am ESMO-Kongress 2023 in Madrid präsentiert. Die Phase-III-Studie EV-302 hat die Ära einer platinfreien Erstlinientherapie eingeleitet. Ihre Präsentation wurde mit stehenden Ovationen gefeiert.
Keypoints
-
In der Erstlinienbehandlung des metastasierten Urothelkarzinoms hat sich seit dem ESMO-Kongress 2024 mit der Präsentation der Studie EV-302 der Standard nun auf eine platinfreie Therapie geändert. Gleichzeitig wurden auch die Daten der Studie CheckMate901 gezeigt, die Nivolumab plus Cisplatin/Gemcitabin vs. Cisplatin/Gemcitabin untersuchte: Hier konnte durch die Hinzugabe von Nivolumab (jedoch nur für Cisplatin-fitte Patienten) ebenfalls ein Überlebensvorteil gezeigt werden.
-
Eine neoadjuvante Chemotherapie des muskelinvasiven Urothelkarzinoms ist Standard bei Cisplatin-fitten Patienten. Die Phase-III-Studie GETUG AFU V05 VESPER zeigte einen Überlebensvorteil bei den Regimen ddMVAC gegenüber Cisplatin/Gemcitabin. Diese Regime sollten bevorzugt verwendet werden.
-
In der Behandlung des High-Risk-Rezidivs des lokal kurativ behandelten Prostatakarzinoms hat die Studie EMBARK die Kombination ADT plus Enzalutamid untersucht. Die dreiarmige Studie hat auch die Monotherapie mit Enzalutamid untersucht, auch diese war in Bezug auf das metastasenfreie Überleben (MFS) der ADT-Monotherapie signifikant überlegen.
-
Die (nach Versagen eines ARTA und Docetaxel im metastasierten kastrationsresistenten Prostatakarzinom-Setting [mCRPC]) bereits in der Schweiz zugelasseneRadionuklidtherapie 177-Lutetium-PSMA-617 könnte nach den Ergebnissen der Phase-III-Studie PSMAfore nun in das Prä-Docetaxel-Therapiesetting vorrücken.
-
Beim mit TKI und IO vorbehandelten metastasierten klarzelligen Nierenzellkarzinom (mccRCC) hat eine neue Substanzklasse, der HIF-2-alpha-Inhibitor Belzutifan, Einzug in das grosse Armarium der Behandlungsoptionen bei dieser Erkrankung gehalten.
Prostatakarzinom
Lokalisiertes Prostatakarzinom: Rezidiv nach lokal kurativer Therapie
Patienten mit einem biochemischen Rezidiv nach lokal kurativer Therapie mittels Prostatektomie oder kurativer Strahlentherapie+/-Androgendeprivations-Therapie(ADT) erhalten je nach PSA-Verdopplungszeit zumeist eine Therapie mit intermittierender ADT.
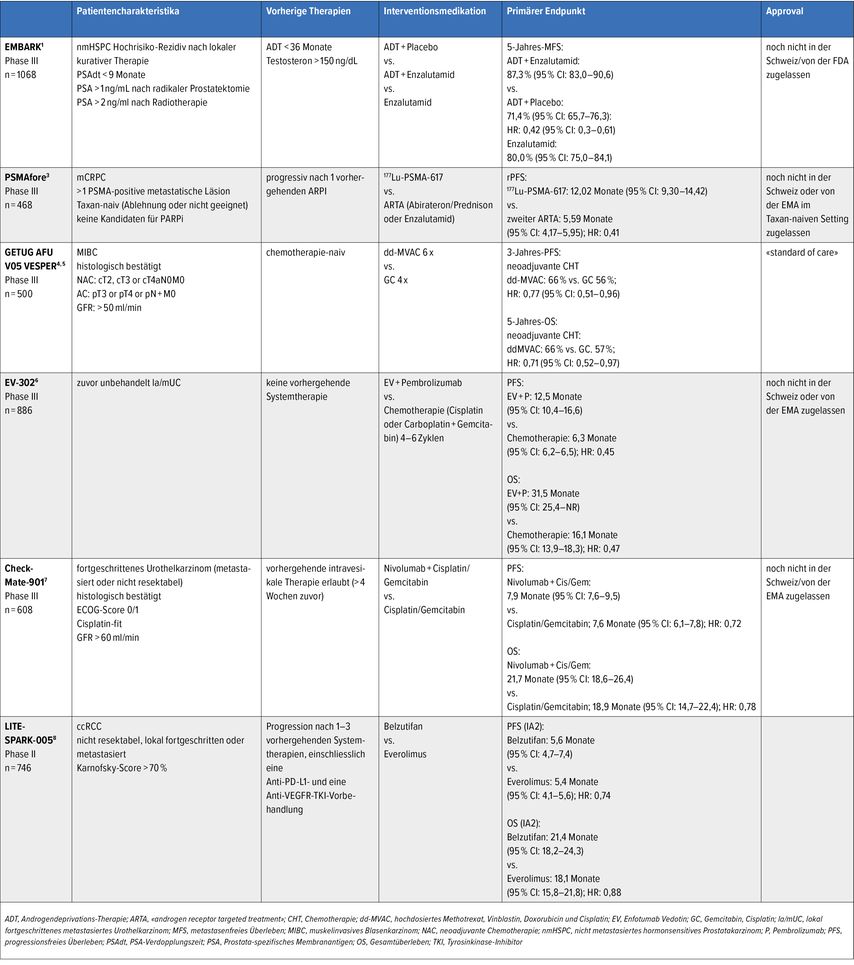
Die Phase-III-Studie EMBARK hat Patienten mit einem besonders aggressiven biochemischen Rezidiv (M0; z.B. PSA-Verdopplungszeit von <9 Monaten) nach lokal kurativer Therapie untersucht.1 Diese dreiarmige Studie (350 Patienten/Arm) randomisierte Patienten in eine Therapie für 36 Wochen (mit Pause nach biochemischem Ansprechen, PSA <0,2ng/ml und Rechallenge bei PSA-Progression) mit ADT+Placebo (verblindet) vs. ADT+Enzalutamid (verblindet) vs. Enzalutamid-Monotherapie (nicht verblindet).
Die Hinzugabe von Enzalutamid zur ADT verlängerte signifikant das metastasenfreie Überleben (MFS). Nach 60 Monaten waren 87% im Arm mit ADT+Enzalutamid metastasenfrei im Vergleich zu 71% im Arm mit ADT+Placebo. In der Analyse des sekundären Endpunktes MFS bezüglich ADT+Placebo vs. Enzalutamid war Enzalutamid überlegen. Die Daten des Gesamtüberlebens (OS) sind noch unreif, die Interimsanalyse zeigte einen Trend zu einem positiven Ergebnis beim Gesamtüberleben (OS). Im Arm mit Enzalutamid-Monotherapie war eine Verbesserung der sexuellen Aktivität, jedoch nicht der Libido, zu sehen, und ein signifikant vermehrtes Auftreten von Gynäkomastie (45%). Patienten mit den Einschlusskriterien der EMBARK-Studie bzgl. der Hinzugabe von Enzalutamid zur ADT sind noch zu evaluieren («off-label», noch keine Zulassung). Eine Enzalutamid-Monotherapie kann im Falle einer Ablehnung der ADT oder bei Kontraindikation für die ADT in Betracht gezogen werden.
mCRPC: 177Lutetium-PSMA-617 im Docetaxel-naiven Setting
Die Radioligandentherapie mit 177Lutetium-PSMA-617 ist auf Basis der Daten der Phase-III-Studie VISION2 bei Patienten, die mit einem ARTA («androgen receptor targeted treatment») und Docetaxel vorbehandelt sind, im Setting des metastastasierten kastrationsresistenten Prostatakarzinoms (mCRPC) seit 2023 zugelassen.
Die Phase-III-Studie PSMAfore, deren aktualisierter primärer Endpunkt radiografisches Überleben (rPFS) und deren zweite OS-Interimsanalyse am ESMO-Kongress 2023 präsentiert wurden, untersuchte Patienten im Setting präDocetaxel-Gabe nach Versagen eines ARTA. Patienten, die in einer 68Ga-PET-PSMA-CT für eine 177-Lutetium-PSMA-617-Therapie kandidierten, wurden in eine Therapie mit 177-Lutetium-PSMA-617 vs. Wechsel auf einen zweiten ARTA (Enzalutamid oder Abirateron) randomisiert.3 Die Studie randomisierte über 468 Patienten in diese beiden Arme mit dem rPFS als primärem Endpunkt.
Ein Cross-over in den experimentellen Arm war bei radiografischer Progression nach der zweiten ARTA-Verabreichung erlaubt, dies erfolgte bei 84% der Patienten. Der primäre Endpunkt rPFS wurde erreicht. 177-Lutetium-PSMA-617 verdoppelte das rPFS von sechs Monaten (Wechsel auf zweiten ARTA) auf zwölf Monate. Die zweite Interimsanalyse (adaptiert auf Cross-over) bzgl. des OS zeigte keinen signifikanten Unterschied zwischen den beiden Therapiearmen, die OS-Daten sind allerdings noch unreif. Das Sicherheitsprofil von 177-Lutetium-PSMA-617 war sehr günstig, Nebenwirkungen waren vor allem Anämie und Mundtrockenheit.
Derzeit ist noch unklar, ob es zu einer Zulassung im Prä-Docetaxel-Setting nach Versagen eines ARTA kommen wird. Der primäre Endpunkt rPFS ist sicher ein schwacher Endpunkt, sowie auch der Vergleichsarm des Wechsels auf einen zweiten ARTA schwach ist.
Urothelkarzinom
Neoadjuvante Chemotherapie beim muskelinvasiven Urothelkarzinom
Eine neoadjuvante Chemotherapie bei Cisplatin-fitten Patienten ist seit Langem Standard beim muskelinvasiven Urothelkarzinom mit zwei potenziellen Schemata, vier Zyklen Cisplatin/Gemcitabin oder viermal ddMVAC (hochdosiertes Methotrexat, Vinblastin, Doxorubicin und Cisplatin) mit G-CSF(Granulozyten-Kolonie-stimulierende Faktoren)-Prophylaxe.
Die Phase-III-Studie GETUG AFU V05 VESPER versuchte, die Frage zu beantworten, ob ddMVAC dem Cisplatin/Gemcitabin-Schema überlegen ist.4 Der primäre Endpunkt wurde bereits im September 2021 berichtet, mit einem signifikanten rPFS-Vorteil für ddMVAC gegenüber Cisplatin/Gemcitabin.5 Am ASCO-Meeting 2023 wurden die OS-Daten präsentiert. Die neoadjuvante Therapie mit ddMVAC zeigte einen signifikanten Benefit in der OS-Rate nach fünf Jahren (66% vs. 57%) gegenüber Cisplatin/Gemcitabin.
Eine Subgruppenanalyse der kumulativen Cisplatin-Dosis in beiden Schemata zeigte, dass vier volle Zyklen ddMVAC den sechs Zyklen im Ergebnis wahrscheinlich äquivalent sind. Daher ist im Alltag die bereits etablierte Gabe von vier Zyklen ddMVAC neoadjuvant mit primärer G-CSF-Prophylaxe zu bevorzugen.
Metastasiertes Urothelkarzinom: Standard-of-Care-Wechsel
Für mehrere Jahrzehnte war eine platinbasierte Chemotherapie in der Erstlinientherapie des metastasierten Urothelkarzinoms der primäre Standard. Die Kombination mit dem Antikörper-Wirkstoff-Konjugat Enfortumab Vedotin (EV) und Pembrolizumab zeigte in der Phase-III-Studie EV-302 einen beeindruckenden OS-Vorteil gegenüber dem bisherigen Standard Platin+Gemcitabin (±Avelumab-Erhaltungstherapie).6
Das mediane Gesamt-OS konnte auf fast drei Jahre verlängert werden und die Studie schreibt Geschichte, da sich damit sofort ein neuer «Standard of Care» (SOC) in der Erstlinientherapie etabliert hat (jedoch ohne Zulassung). Ebenfalls positiv ist die Studie CheckMate901 ausgefallen, die die Hinzugabe von Nivolumab (max. zwei Jahre) zum Standard Cisplatin+Gemcitabin (max. sechs Zyklen) untersuchte.7 Die Studie erreichte ebenfalls die dualen primären Endpunkte rPFS und OS (median 21,7 vs. 18,9 Monate; HR: 0,78; 95% CI: 0,63–0,96). Diese Triplett-Kombination ist ebenfalls eine Alternative, jedoch exklusiv für Patienten, die für eine Therapie mit Cisplatin geeignet sind. Insgesamt, jedoch ohne Kopf-an-Kopf-Vergleich, ist numerisch beim OS die Studie mit EV+Pembrolizumab überlegen und der neue Standard.
Nierenzellkarzinom
Einzug einer neuen Substanzklasse: Anti-HIF-2 alpha Belzutifan
Die Phase-II-Studie LITESPARK-005 beim mit TKI und IO vorbehandelten metastasierten klarzelligen Nierenzellkarzinom (mccRCC) untersuchte die Wirksamkeit von Belzutifan gegenüber dem mTOR-Inhibitor Everolimus.8 Der koprimäre Endpunkt rPFS wurde erreicht. OS-Daten sind noch abzuwarten, weil noch unreif.
Mit dieser positiven Studie könnte die Substanz Belzutifan Einzug in die Behandlung des mccRCC finden. Sie ist von der FDA schon zugelassen für die Behandlung von mit dem Von-Hippel-Lindau(VHL)-Syndrom assoziierten Tumoren und rezent auch nach Versagen eines TKI und einer IO auf Basis dieser Phase-II-Studie. Das Nebenwirkungsprofil ist ähnlich dem bei anderen VEGFR-TKI, mit Anämie und Hypoxie als «neuen» Nebenwirkungen, die jedoch gut handhabbar scheinen und keine wesentlichen Therapieabbrüche oder Dosisreduktionen verlangten. Phase-III-Studien in Kombination mit anderen TKI und anti-PDL-Wirkstoffen sind in verschiedenen Therapielinien im Laufen.
Literatur:
1 Freedland SJ et al.: Improved outcomes with Enzalutamide in biochemically recurrent prostate cancer. N Engl J Med 2023; 389(16): 1453-65 2 Sartor O et al.: Lutetium-177–PSMA-617 for metastatic castration-resistant prostate cancer. N Engl J Med 2021; 385(12): 1091-103 3 Sartor O et al.: LBA13: phase III trial of [177Lu]Lu-PSMA-617 in taxane-naive patients with metastatic castration-resistant prostate cancer (PSMAfore). Ann Oncol 2023; 34: S1324-5 4 Pfister C et al.: Perioperative dose-dense methotrexate, vinblastine, doxorubicin, and cisplatin in muscle-invasive bladder cancer (VESPER): survival endpoints at 5 years in an open-label, randomised, phase 3 study. Lancet Oncol 2024; 25(2): 255-645 Pfister C et al.: Dose-dense methotrexate, vinblastine, doxorubicin, and cisplatin or gemcitabine and cisplatin as perioperative chemotherapy for patients with nonmetastatic muscle-invasive bladder cancer: results of the GETUG-AFU V05 VESPER trial. J Clin Oncol 2022; 40(18): 2013-22 6 Powles TB et al.: LBA6 EV-302/KEYNOTE-A39: open-label, randomized phase III study of enfortumab vedotin in combination with pembrolizumab (EV+P) vs chemotherapy (Chemo) in previously untreated locally advanced metastatic urothelial carcinoma (la/mUC). Ann Oncol 2023; 34: S1340 7 Van der Heijden MS et al.: Nivolumab plus gemcitabine–cisplatin in advanced urothelial carcinoma. N Engl J Med 2023; 389(19): 1778-89 8 Albiges L et al.: LBA88: belzutifan vs. everolimus in participants (pts) with previously treated advanced clear cell renal cell carcinoma (ccRCC): randomized open-label phase III LITESPARK-005 study. Ann Oncol 2023; 34: S1329-30
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...