%20Vor%20Therapie.jpg)
Die multimodale Therapie des hepatozellulären Karzinoms
Autorin:
Priv.-Doz. Dr. Sonia Radünz
Leiterin Hepatobiliäre Chirurgie
Klinik für Allgemein-, Viszeral- und Transplantationschirurgie
Universitätsklinikum Essen
E-Mail: sonia.radunz@uk-essen.de
Neue Therapiemodalitäten erweitern das Therapiespektrum beim hepatozellulären Karzinom und verbessern das Ergebnis stadien-übergreifend. Aufgrund der häufig zugrunde liegenden Leberzirrhose mit Einschränkung der Leberfunktion und der großen Bandbreite multimodaler Therapien ist die Vorstellung von Patient:innen mit hepatozellulärem Karzinom in einem interdisziplinären Therapiezentrum vorteilhaft.
Keypoints
-
Limitierend für resezierende, interventionelle und systemische Therapien ist die Leberfunktion.
-
Eine adjuvante Therapie nach chirurgischer Resektion könnte zukünftig einen langfristigen rezidivfreien Verlauf unterstützen.
-
Als „bridge to transplant“ eignen sich insbesondere interventionelle Therapien. Ein gutes Therapieansprechen scheint günstig für einen rezidivfreien Verlauf nach Lebertransplantation.
Das hepatozelluläre Karzinom (HCC) ist die sechsthäufigste Malignomerkrankung und die dritthäufigste malignombedingte Todesursache weltweit. In Deutschland erkranken jährlich ca. 9000 Patient:innen, mit steigender Inzidenz insbesondere unter männlichen Patienten. Aufgrund der Komplexität der Tumorerkrankung wie auch der eingeschränkten Leberfunktion hat sich die Therapie in Zentren, die alle Therapieoptionen anbieten, d.h. chirurgische, interventionelle und systemische Therapien, als erfolgreich erwiesen.
Lebertransplantation
Beim HCC, das sich auf dem Boden einer Leberzirrhose entwickelt, stellt die Lebertransplantation weiterhin die einzige definitive Therapie dar, da hiermit auch das als Präkanzerose zu wertende Gewebe der Zirrhose entfernt wird. Insbesondere in Zeiten des Spender:innenorgan-Mangels steht diese Therapie aber nicht für alle Patient:innen zur Verfügung und es ist eine gezielte Selektion der hierfür am besten geeigneten Patient:innen erforderlich. Zudem besteht ein nicht unerhebliches Risiko für einen Tumorprogress während der Wartezeit auf ein Spender:innenorgan, sodass die Indikation zur überbrückenden Therapie, zur sog. Bridging-Therapie, besteht. Des Weiteren erhofft man sich aus dem Therapieansprechen auf diese Bridging-Therapien Antworten bezüglich der biologischen Aktivität des HCC und des Rezidivrisikos nach Transplantation.
Die chirurgische Resektion, ob konventionell offen-chirurgisch oder minimal invasiv bzw. robotisch, liefert bei geeigneten Patient:innen auch bei Vorhandensein einer Leberzirrhose gute kurz- und langfristige Ergebnisse. Patient:innen mit deutlichen Zeichen einer portalen Hypertension, d.h. Thrombozytenzahl <100000/nl, sind allerdings für eine chirurgische Therapie im Allgemeinen nicht geeignet. Wenn das Resektat ein ungünstiges Tumorstadium mit Nachweis einer mikrovaskulären Gefäßinvasion ergibt, besteht zudem ein hohes Risiko für ein frühzeitiges Rezidiv.
Ablative Verfahren
Etablierte interventionelle Therapien mit guten Therapieerfolgen in der nicht-resektablen Situation wie auch als Bridging-Therapie bis zur Lebertransplantation sind die ablativen Verfahren, d.h. die Radiofrequenzablation (RFA) oder Mikrowellenablation (MWA), und die transarterielle Chemoembolisation (TACE). Limitationen für diese Therapien sind aber die Tumorgröße und -anzahl sowie Zeichen einer dekompensierten Leberzirrhose, wie therapierefraktärer Aszites oder eine Hyperbilirubinämie, oder für die TACE das Vorliegen einer Pfortaderthrombose.
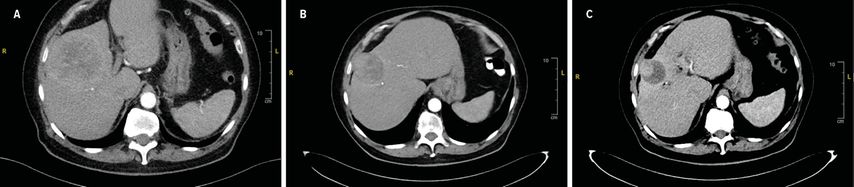
Vorteile der transarteriellen Radioembolisation mit Yttrium-90-markierten Mikrosphären liegen in der Therapie deutlich größerer und vielzähliger Tumoren wie auch in der Anwendbarkeit bei Vorliegen einer Pfortaderthrombose. Wenn der Tumor in der Voruntersuchung hinreichend Technetium-99m-markiertes makroaggregiertes Albumin anreichert und keine relevanten extrahepatischen Shunts detektiert werden, erfolgt die Therapie in den meisten Fällen lobär. Im Vergleich zur TACE konnte in internationalen Studien ein signifikant längeres rezidivfreies Überleben nachgewiesen werden.1,2 Als Bridging-Therapie zeigt sich in monozentrischen deutschen Daten ein vergleichbares Überleben bei deutlich höherer Tumorlast vor Radioembolisation im Vergleich zu TACE-therapierten Patient:-innen.3 Da Yttrium-90 ein reiner Betastrahler mit einer Eindringtiefe von ca. 2,5mm ist, besteht kein wesentliches Risiko für eine über die Leber hinausgehende Gewebeaffektion. Auch ist insofern eine Lebertransplantation prinzipiell zeitnah möglich. Der maximale Therapieeffekt der Radioembolisation zeigt sich jedoch erst im längerfristigen Verlauf von 3 bis zu 6 Monaten mit einer dann auch radiologisch messbaren Größenregredienz des Tumors (Abb. 1). In histopathologischen Proben konnte aber auch in kürzeren Intervallen zwischen Radioembolisation und Explantation häufig bereits eine nahezu vollständige Tumornekrose nachgewiesen werden.4
Abb. 1: 81-jähriger Patient mit einem ausgedehnten HCC, das sowohl über die Arteria hepatica dextra als auch über die Arteria hepatica sinistra versorgt war. Es erfolgte eine Radioembolisation links und rechts in einem Intervall von einem Monat. A: CT Abdomen vor Therapie (Tumordurchmesser 81x81 mm). B: CT Abdomen 3 Monate (Tumordurchmesser 55x60 mm). C: 6 Monate (Tumordurchmesser 44x41 mm) nach Radioembolisation. 7 Monate nach Radioembolisation erfolgte die Resektion von Segment IVb mit Nachweis eines weitgehend nekrotischen, schlecht differenzierten HCC, pT1b L0 V0 Pn0 R0 G3. 5 Jahre Tumornachsorge blieben ohne Rezidivnachweis
Radiotherapie
Die spannendsten Neuerungen in der Therapie des HCC haben sich im Feld der Strahlentherapie und Systemtherapie ergeben. Bei beiden in ihrer konventionellen Form gilt das HCC weiterhin als unzugänglich, aufgrund der relevanten Strahlensensibilität und der fehlenden Chemosensibilität. Mit der Protonentherapie besteht aber die Möglichkeit, eine exakte und hohe Dosis im Zielvolumen zu erreichen und gleichzeitig das übrige Leberparenchym zu schonen. Fraktionierung und geplante Gesamtdosis können in Abhängigkeit von Lagebeziehungen zur Pfortader und zu intestinalen Organen gewählt werden. Hinsichtlich lokaler Tumorkontrolle und Gesamtüberleben zeigt sich die Protonentherapie der RFA gleichwertig.5 In asiatische und nordamerikanische Leitlinien hat die Protonentherapie aufgrund der hohen Effektivität bereits Eingang gefunden. Studien zur Anwendung als Bridging-Therapie vor Transplantation liegen bisher noch nicht vor.
Systemtherapie
Die Optionen der Systemtherapie des HCC waren lange Zeit sehr eingeschränkt und nur mäßig erfolgreich, bei einem relevanten Nebenwirkungsprofil mit deutlichem Verlust an Lebensqualität. Bei vielen anderen Malignomen stellte die Therapie mit Immun-Checkpoint-Inhibitoren, die entweder auf den Regelkreis des programmierten Zelltod-1 (PD-1)- bzw. des Programmierter Zelltod-Liganden 1 (PD-L1) oder des zytotoxischen T-Lymphozyten-assoziierten Proteins 4 (CTLA-4) abzielen, einen wichtigen Durchbruch dar. Nach initial vielversprechenden Ergebnissen zeigten sich diese Checkpoint-Inhibitoren in der Monotherapie des HCC jedoch als nicht geeignet, mit schlechteren Verläufen im Vergleich zur Therapie mit dem Tyrosinkinase-Inhibitor Sorafenib. Die Kombinationstherapie von Atezolizumab, einem PD-L1 Inhibitor, mit Bevacizumab, einem „Vascular endothelial growth factor“(VEGF)-Inhibitor, hingegen erreichte bei Patient:innen mit inoperablem HCC eine höhere Gesamtüberlebensrate (67,2 vs. 54,6%) und ein längeres progressionsfreies Überleben (6,8 vs. 4,3 Monate) im Vergleich zur Sorafenib-Therapie.6
Somit stellt diese Kombinationstherapie aus AtezolizumabundBevacizumab angesichts der zudem geringeren Nebenwirkungsrate im Vergleich zu Sorafenib eine wirksame neue Erstlinien-Behandlungsoption für das HCC im Spätstadium dar. In vorläufigen Untersuchungsergebnissen zeigt diese Kombinationstherapie auch erstmals einen Erfolg einer systemischen adjuvanten Therapie nach R0-Resektion bzw. RFA mit kompletter Remission. Im Vergleich zur Kohorte, die lediglich der strukturierten Nachsorge zugeführt wurde, konnte ein signifikant längeres rezidivfreies Überleben erreicht werden.
Für eine multimodale Therapie, die letztlich auf eine Lebertransplantation abzielt, erscheint die Therapie mit Checkpoint-Inhibitoren aber nicht geeignet. Aufgrund der T-Zell-Aktivierung besteht ein relevantes Risiko für eine (fulminante) Transplantatabstoßung. Bisher finden sich in der Literatur nur Einzelfallbeschreibungen bzw. kleine Fallserien von insgesamt ca. 50 publizierten Fällen. In 25% dieser Fälle trat bei Lebertransplantation nach Therapie mit Checkpoint-Inhibitoren eine Transplantatabstoßung auf, die in über 50% zum Transplantatverlust führte. Es wird eine Therapiepause von ca. 8 Wochen, entsprechend ca. zwei Halbwertszeiten der gängigen Checkpoint-Inhibitoren, vor Transplantation diskutiert. Die aktuelle Datenlage unterstützt dies aber nicht, da in Einzelfällen auch nach mehrmonatiger Therapiepause vor Transplantation eine fulminante frühzeitige Transplantatabstoßung aufgetreten ist.
Fazit
Es bestehen verschiedene interventionelle Therapieverfahren des HCC, die auch kurativ intendiert, als Bridging-Therapie zur Resektion oder Transplantation, angewendet werden können. Wenn die Leberfunktion ein resezierendes Vorgehen erlaubt, kann hierunter insbesondere in Kombination mit einer adjuvanten Systemtherapie ein sehr gutes onkologisches Ergebnis erreicht werden. Mit heutigem Kenntnisstand scheint eine Therapie mit Checkpoint-Inhibitoren bei Transplantationskandidat:innen aufgrund des Risikos für eine therapierefraktäre Transplantatabstoßung aber nicht gerechtfertigt.
Literatur:
1 Salem R et al.: Gastroenterology 2016; 151(6): 1155-63.e2 2 Dhondt E et al.: Radiology 2022; 303(3): 699-710 3 Benko T et al.: Eur J Med Res 2022; 27(1): 74 4 Radunz S et al.: Annals Transplant 2017; 22: 215-21 5 Kim TH et al.: J Hepatol 2021; 74(3): 603-12 6 Finn RS et al.: N Engl J Med 2020; 382(20): 1894-905
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...