Systemtherapie des metastasierten hellzelligen Nierenzellkarzinoms – die Qual der Wahl
Autoren:
Dr. med. Stefanie Aeppli
Oberärztin, Klinik für Medizinische Onkologie und Hämatologie, Kantonsspital St. Gallen
PD Dr. med. Christian Rothermundt
Leitender Arzt, Klinik für Medizinische Onkologie und Hämatologie, Kantonsspital St. Gallen
Korrespondenz:
E-Mail: stefanie.aeppli@kssg.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Bereits seit einigen Jahren sind die Immuncheckpoint-Inhibitoren (ICI) ein fester Bestandteil der Therapie des metastasierten Nierenzellkarzinoms. Zunächst hatten sie Eingang in die Zweitlinienbehandlung gefunden, mittlerweile sind sie als Teil der Erstlinientherapie etabliert. Bald stehen vier verschiedene ICI-Tyrosinkinase-Inhibitor(TKI)-Kombinationen zur Verfügung sowie eine ICI-ICI-Kombination. Die Herausforderung besteht darin, aus dieser Palette von Kombinationen die für den individuellen Patienten geeignete Therapie und den geeigneten Zeitpunkt auszuwählen.
Keypoints
-
In der Erstlinientherapie des metastasierten hellzelligen Nierenzellkarzinoms stehen bald vier Kombinationstherapien zur Auswahl: Ipilimumab/Nivolumab, Pembrolizumab/Axitinib, Nivolumab/Cabozantinib und Pembrolizumab/Lenvatinib.
-
Alle Studien zeigten einen Vorteil gegenüber Sunitinib, wobei sich die Studien im Studiendesign, in der Studienpopulation und teilweise auch in den gewählten Endpunkten unterscheiden.
-
Meist qualifizieren die Patienten für mehrere Therapieoptionen.
-
Die Schwierigkeit besteht in der Wahl des geeignetsten Therapieschemas und Zeitpunktes der Therapieeinleitung.
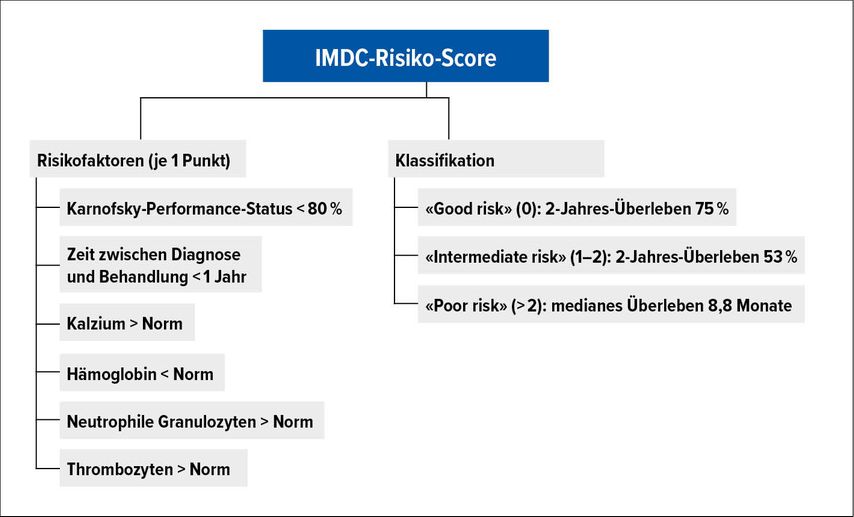
IMDC-Risikoklassifizierung
Der IMDC(International Metastatic Renal Cell Cancer Database Consortium)-Risiko-Score sollte bei jedem Patienten bei Diagnosestellung eines metastasierten Nierenzellkarzinoms berechnet werden, da es sich hierbei weiterhin um einen wichtigen prognostischen und auch prädiktiven Parameter handelt.1 Jeweils einen Punkt addiert man für: Karnofsky-Performance-Status <80%, Zeit zwischen Diagnosestellung und Beginn der Systemtherapie <1 Jahr, Hämoglobin unter dem Normwert, neutrophile Granulozyten über dem Normwert, Thrombozyten über dem Normwert und Kalzium über dem Normwert. Es können hiermit drei prognostische Gruppen unterschieden werden: «favourable risk» (0 Punkte), «intermediate risk» (1–2 Punkte) und «poor risk» (≥3 Punkte) (Abb. 1). Der Score wurde im Zeitalter der Tyrosinkinase-Inhibitoren entwickelt und validiert. Damals zeigte sich ein mittleres Überleben der «Favourable risk»-Gruppe von 43,2 Monaten, von 22,5 Monaten für «Intermediate risk»- und 7,8 Monaten für «Poor risk»-Patienten. Die IMDC-Datenbank ist weiterhin aktiv und beinhaltet >11000 Patienten aus 15 Ländern. Auch die Entscheidung bezüglich einer primären, zytoreduktiven Nephrektomie wird vorwiegend anhand des IMDC-Risiko-Scores gefällt.2 Im Rahmen der CARMENA-Studie wurden die Daten jedoch nur bei Patienten mit einer TKI-Behandlung prospektiv erhoben. Bei Patienten mit «intermediate» (ab 2 Punkten) und «poor risk» steht aktuell die systemische Therapie im Vordergrund.
Aktive Überwachung
In einer kleinen, prospektiven Phase-II-Studie konnte gezeigt werden, dass nicht alle Patienten mit neu diagnostiziertem, metastasiertem Nierenzellkarzinom umgehend eine Systemtherapie benötigen.3 Bei einer selektionierten Patientengruppe (IMDC 0–1 Punkte und max. 2 Organe mit Metastasen) liegt die Wahrscheinlichkeit, nach 12 Monaten weiterhin keine Systemtherapie zu benötigen, bei 80%. Werden diese Vorgaben nicht erfüllt, sinkt diese Wahrscheinlichkeit relevant ab und liegt nur noch bei 30%. Die mediane Zeit bis zum Beginn einer Systemtherapie betrug 14,9 Monate. In einer kürzlich publizierten Kohortenstudie der IMDC-Datenbank wurde das Metastasierungsmuster von 10105 Patienten analysiert, davon 9252 Patienten mit hellzelligem Nierenzellkarzinom.4 Metastasen in endokrinen Organen (Pankreas, Schilddrüse, Nebenniere) scheinen dabei prognostisch günstig zu sein, wobei Metastasen in Pleura, Gehirn, Leber und Knochen mit einem kurzen mittleren Gesamtüberleben vergesellschaftet sind.
Systemtherapie
In den folgenden Abschnitten werden die verschiedenen Möglichkeiten der Erstlinientherapie des metastasierten hellzelligen Nierenzellkarzinoms detailliert beschrieben.
Ipilimumab/Nivolumab
Mit der CheckMate-214-Studie hat die Immuntherapie Einzug in die erste Therapielinie des metastasierten hellzelligen Nierenzellkarzinoms gehalten.5 Durch die Kombination von Ipilimumab und Nivolumab konnte bei Patienten mit IMDC «intermediate» und «poor risk» eine signifikante Verlängerung des Gesamtüberlebens (OS) gegenüber Sunitinib gezeigt werden (OS-Rate nach 42 Monaten: 52% vs. 39%, HR: 0,66 [0,55–0,8]). Die Überlebenskurve zeigt zudem ein Plateau, was auf eine langfristige Tumorfreiheit hindeutet. Die Ansprechrate (Overall Response Rate, ORR) liegt bei 42%, wobei 10% der Patienten eine komplette Remission (CR) erreichen. Problematisch ist, dass bei 20% der Patienten die Krankheit nicht auf diese Therapiekombination anspricht und sich bisher keine prädiktiven Marker klar etablieren konnten. In der Subgruppenanalyse scheinen Patienten mit «programmed death-ligand 1» (PD-L1) ≥1% mehr von der Immuntherapie zu profitieren als bei negativem PD-L1-Status. Die Studie war aber hierfür nicht gepowert, sodass hierzu keine abschliessende Aussage gemacht werden kann.
In der Studie kam es bei 46% zu schwereren Nebenwirkungen (CTCAE-Grad 3–4), wobei diese Rate unter Sunitinib sogar bei 63% lag. In der Immuntherapie-Gruppe benötigten 35% aller Patienten, die an einer Immuntherapie-assoziierten Nebenwirkung litten, hoch dosierte Steroide (≥40mg Prednison oder Äquivalent). Wichtig zu bemerken ist, dass die Dosis von Ipilimumab beim metastasierten Nierenzellkarzinom nur 1mg/kg Körpergewicht beträgt, im Unterschied zur Behandlung des metastasierten Melanoms (Ipilimumab 3mg/kg Körpergewicht).
Die Kombination mit Ipilimumab und Nivolumab ist durch die Swissmedic bei Patienten mit IMDC «intermediate» und «poor risk» zugelassen, aber noch nicht auf der Spezialitätenliste (SL) gelistet.
In einer retrospektiven Analyse der CheckMate-214-Studie wurde die therapiefreie Zeit nach Behandlungsstopp evaluiert. Hierbei zeigte sich, dass 320 Patienten (75%) die Therapie mit Ipilimumab und Nivolumab beendeten und 359 (85%) Patienten die Therapie mit Sunitinib. Meistens kam es wegen Krankheitsprogredienz (Nivolumab und Ipilimumab 42%; Sunitinib 58%) oder wegen Toxizität (Nivolumab und Ipilimumab 23%; Sunitinib 11%) zum Therapieabbruch. Anschliessend gab es eine therapiefreie Zeit, welche nach Ipilimumab und Nivolumab statistisch signifikant länger war als nach Sunitinib (p<0,0001): 18 Monate nach Stopp von Ipilimumab und Nivolumab waren 19% ohne weiterführende Behandlung und nur 4% nach Sunitinib.6 Unter Ipilimumab und Nivolumab hatten 156 Patienten eine partielle Remission (PR) erreicht, von diesen standen 28 (17,9%) noch unter Behandlung, 67 (42,9%) hatten die Therapie unterbrochen und keine weiter Systemtherapie erhalten, 61 Patienten (39,1%) erhielten eine neue Systemtherapie. Von den 163 Patienten mit PR unter Sunitinib waren 9 (5,5%) weiterhin unter dieser Behandlung, 39 (23,9%) benötigten keine weitere Behandlung.7
Pembrolizumab/Axitinib
In der KEYNOTE-426-Studie wurde die Kombination von Pembrolizumab und Axitinib gegenüber Sunitinib untersucht.8 Es konnte eine signifikante Verlängerung des progressionsfreien Überlebens (15,7 vs. 11,1 Monate, HR: 0,688 [0,58–0,80]) und des Gesamtüberlebens gezeigt werden (OS-Rate nach 36 Monaten: 63% vs. 54%, HR: 0,73 [0,60–0,88]). Patienten aller IMDC-Risikogruppen wurden in diese Studie eingeschlossen und bezüglich des primären Endpunkts analysiert. Eine Subgruppenanalyse der «Favourable risk»-Patienten konnte jedoch bisher weder einen Vorteil in Bezug auf das progressionsfreie Überleben (PFS) noch auf das OS zeigen. Da es sich insgesamt um eine prognostisch günstige Gruppe handelt, ist zum aktuellen Zeitpunkt unklar, ob dieser Vorteil erst im Verlauf zu sehen sein wird oder ob bei dieser Patientengruppe ggf. keine ICI-Therapie notwendig ist. Die Tatsache, dass es auch bei der «Favourable risk»-Gruppe zu einer CR-Rate von 11% kommt, was als Surrogatmarker für ein langfristiges Ansprechen zählen kann, spricht hingegen wieder für den Einsatz eines ICI in der Erstlinienbehandlung. Hier ist das letzte Wort noch nicht gesprochen.
Die ORR liegt bei Analyse aller Risikogruppen bei 60%, die Rate an kompletten Remissionen beträgt vergleichbar mit der rein ICI-haltigen Therapie 10%. Hervorzuheben ist, dass nur 11% der Patienten auf diese Kombinationstherapie direkt eine Krankheitsprogredienz erleben und somit die primäre Kontrollrate der Erkrankung besser ist als bei der ICI-ICI-Kombination. Aussagen bezüglich Plateau-Bildung können noch nicht gemacht werden.
Immuntherapien und TKI zeigen ein überlappendes Nebenwirkungsspektrum, zum Beispiel gastrointestinale Nebenwirkungen. Die Zuordnung von Toxizitäten kann daher unter Umständen schwierig sein, ist aber für das Management von grosser Bedeutung: ICI-Nebenwirkungen werden im Grunde immer mit dem Einsatz von Kortikosteroiden behandelt, TKI-Nebenwirkungen müssen durch Therapiepausen und andere medikamentöse oder supportive Massnahmen beeinflusst werden. Durch die kurze Halbwertszeit von Axitinib (2,5–6,1 Stunden) ist die Unterscheidung jedoch häufig innerhalb von wenigen Tagen möglich. Konsensusempfehlungen helfen beim Vorgehen in unklaren Situationen.9
Die Kombination mit Pembrolizumab und Axitinib ist durch die Swissmedic zugelassen, aber noch nicht SL-gelistet.
Cabozantinib/Nivolumab
Die CheckMate-9ER-Studie kombinierte den ICI Nivolumab mit dem TKI Cabozantinib. Cabozantinib wurde in einer Dosis von 40mg verabreicht, was einer tieferen Dosis entspricht als in der Monotherapie.10 Die Studie zeigte ebenfalls einen signifikanten Vorteil für das PFS (16,6 vs. 8,3 Monate; HR: 0,51 [0,41–0,64]) und OS gegenüber Sunitinib (OS 12 Monate 85,7% vs. 75,6%; HR: 0,6 [0,4–0,89]). Die ORR von 56% ist mit denen der anderen Kombinationstherapien vergleichbar, ebenso die Rate an CR mit 8%. Beeindruckend ist die geringe Anzahl von Patienten, die nicht von dieser Therapie profitieren (5,6%).
Die Kombinationstherapie ist durch die FDA und EMA zugelassen, eine Zulassung in der Schweiz liegt noch nicht vor.
Pembrolizumab/Lenvatinib
In der CLEAR-Studie wurde die äusserst potente Kombination von Pembrolizumab und Lenvatinib gegenüber Sunitinib untersucht.11 Das PFS ist mit knapp 24 Monaten knapp doppelt so lange wie mit den bisherigen ICI-TKI-Kombinationen (23,9 Monate vs. 9,2 Monate, HR: 0,39 [0,32–0,49]). Das OS unter Lenvatinib und Pembrolizumab war ebenfalls signifikant länger als unter Sunitinib (OS 24 Monate 79% vs. 70%, HR: 0,66 [0,49–0,88]).
Die ORR ist mit 71% sehr hoch und auch die CR-Rate von 16% beeindruckt. Nur 5,3% der Patienten sprechen nicht auf diese Kombination an. Diese Vorteile gehen jedoch mit relevanten Nebenwirkungen einher: Die Rate an schwereren Nebenwirkungen (CTCAE-G3–5) liegt bei 82%, knapp 70% der Patienten mussten die Dosis von Lenvatinib reduzieren.
Die Therapiekombination hat noch keine Zulassung.
Zusammenfassung
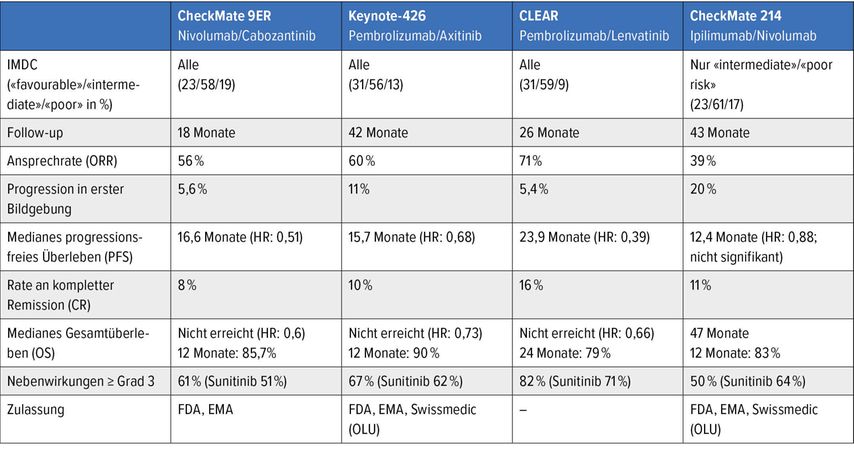
In den vergangenen drei Jahren wurden die beschriebenen Studien publiziert und haben die Behandlung des metastasierten hellzelligen Nierenzellkarzinoms markant verändert. Alle Studien habe als Vergleichsarm den TKI Sunitinib gewählt. Ein direkter Vergleich der Studien muss immer unter Vorbehalt gemacht werden (Tab. 1). Die Studien unterscheiden sich relevant in den Studiendesigns, den Studienpopulationen und teilweise auch in den gewählten Endpunkten. Für den klinischen Alltag ist keine der Kombinationstherapien in der Schweiz kassenpflichtig, sodass jeweils ein Kostengutsprachegesuch im Sinne eines Off-label Use nach KVV 71a–d eingeholt werden muss. Für individuelle Patienten kommen meistens mehrere und manchmal auch alle Kombinationen in Betracht. Einige Punkte können jedoch helfen, in die eine oder andere Richtung zu tendieren. Patienten mit sehr hoher Tumorlast und/oder symptomatischer Erkrankung, die eine Progression nicht tolerieren könnten, sollten eher eine TKI-ICI-Kombination erhalten. Bei Patienten mit geringer Tumorlast, die einen Progress tolerieren könnten, kann eine ICI-ICI-Kombination evaluiert werden, mit dem Fokus einer langfristigen Tumorkontrolle (Abb. 2).
Tab. 1: Übersicht über die wichtigsten Studien in der Erstlinienbehandlung des metastasierten hellzelligen Nierenzellkarzinoms
Auch eine TKI-Monotherapie steht theoretisch weiterhin als Option zur Verfügung. Die Daten aller vier Kombinationsstudien sind jedoch kongruent und überzeugend, sodass es sich zunehmend um vereinzelte Patienten handeln wird. Die Therapiewahl sollte individuell mit und für den Patienten gewählt werden.
Literatur:
1 Heng DY et al.: External validation and comparison with other models of the International Metastatic Renal-Cell Carcinoma Database Consortium prognostic model: a population-based study. Lancet Oncol 2013; 14(2): 141-8 2 Méjean A et al.: Sunitinib alone or after nephrectomy in metastatic renal-cell carcinoma. N Engl J Med 2018; 379(5): 417-27 3 Rini BI et al.: Active surveillance in metastatic renal-cell carcinoma: a prospective, phase 2 trial. Lancet Oncol 2016; 17(9): 1317-24 4 Dudani S et al.: Evaluation of clear cell, papillary, and chromophobe renal cell carcinoma metastasis sites and association with survival. JAMA Netw Open 2021; 4(1): e2021869 5 Motzer RJ et al.: Nivolumab plus ipilimumab versus sunitinib in advanced renal-cell carcinoma. N Engl J Med 2018; 378(14): 1277-90 6 McDermott DF et al.: Treatment-free interval (TFI) following discontinuation of first-line nivolumab plus ipilimumab (N+I) or sunitinib (S) in patients (Pts) with advanced renal cell carcinoma (aRCC): CheckMate 214 analysis. Ann Oncol 2018; 29(Suppl_8): viii309 7 Albiges L et al.: Nivolumab plus ipilimumab versus sunitinib for first-line treatment of advanced renal cell carcinoma: extended 4-year follow-up of the phase III CheckMate 214 trial. ESMO Open 2020; 5(6): e001079 8 Rini BI, Plimack ER et al.: Pembrolizumab plus axitinib versus sunitinib for advanced renal-cell carcinoma. N Engl J Med 2019; 380(12): 1116-27A 9 Grünwald V et al.: Axitinib plus immune checkpoint inhibitor: evidence- and expert-based consensus recommendation for treatment optimisation and management of related adverse events. Br J Cancer 2020; 123(6): 898-904 10 Choueiri TK et al.: Nivolumab plus cabozantinib versus sunitinib for advanced renal-cell carcinoma. NEngl J Med 2021; 384(9): 829-41 11 Motzer R et al.: Lenvatinib plus pembrolizumab or everolimus for advanced renal cell carcinoma. N Engl J Med 2021; 384(14): 1289-300 12 Heng et al.: „New and Updated Pivotal Trials of Single Agent and Combination Immunocheckpoint Blockers in Bladder and Kidney Cancers“. ASCO-Meeting 2020
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...