Systemtherapie des cholangiozellulären Karzinoms
Autorin:
Prim. Priv.-Doz. Dr. Birgit Grünberger
Abteilungsvorstand
Abteilung für Innere Medizin,
Hämatologie und intern. Onkologie
Landesklinikum Wiener Neustadt
E-Mail:
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Cholangiozelluläre Karzinome (CCC) – auch maligne biliäre Tumoren genannt – sind nach dem hepatozellulären Karzinom die zweithäufigsten Lebertumoren, zählen aber mit 0,5–1% aller Neoplasien zu den seltenen Tumoren. Das CCC umfasst das intra- und das extrahepatale Gallengangskarzinom sowie das Gallenblasenkarzinom. Die Inzidenz der intrahepatalen cholangiozellulären Karzinome hat in Österreich sowohl bei den Männern als auch Frauen zugenommen, die der extrahepatischen dagegen hat abgenommen.
Keypoints
-
Nach wie vor ist die einzige kurative Therapieoption beim Gallenwegskarzinom die chirurgische Entfernung des Tumors.
-
Patienten sollte nach erfolgter kurativer Resektion eine adjuvante Therapie mit Capecitabin für 6 Monate angeboten werden.
-
Im fortgeschrittenen Stadium gilt die Kombination von Gemcitabin und Cisplatin nach wie vor als Standard-Erstlinientherapie.
-
Eine molekulare Analyse des Tumors sollte bei allen Patienten im fortgeschrittenen Stadium durchgeführt werden. Mit den Daten aus ClarIDHY und FIGHT-202 kann nun bei Patienten mit fortgeschrittenen biliären Tumoren und entsprechenden Mutationen eine zielgerichtete Therapie mit Ivosidenib bzw. Pemigatinib nach Versagen der Erstlinie angeboten werden.
Nach wie vor ist die einzige kurative Therapieoption die komplette chirurgische Resektion. Sie ist aber nur sinnvoll, wenn eine R0-Resektion erzielt werden kann. Dadurch kann eine 5-Jahres-Überlebensrate – abhängig von Lokalisation und Stadium – von 20–50% erzielt werden.1 Allerdings sind leider bei Diagnosestellung bereits ca. 75% der Tumoren lokal fortgeschritten oder metastasiert, weswegen (zumindest primär) keine kurative Resektion durchgeführt werden kann.
Bis vor wenigen Jahren lagen lediglich zwei relevante Phase-III-Studien im Erstliniensetting vor. Mittlerweile sind aber einige Studien, sowohl im adjuvanten Bereich als auch in der Zweitlinie, dazugekommen. Vor allem die Daten der zielgerichteten Therapien zeigen vielversprechende Ergebnisse.
Adjuvante Therapie
Mit der BILCAP-Studie liegt nach wie vor das einzige positive Phase-III-Ergebnis einer adjuvanten Therapie vs. Observation vor.2 Hier konnte durch die postoperative Behandlung mit Capecitabin für 8 Zyklen eine signifikante Verlängerung des Gesamtüberlebens (OS) erzielt werden.
Dem stehen zwei negative Studien (Prodige-12-Accord, BCAT) gegenüber, die beide Gemcitabin entweder alleine oder in Kombination mit Oxaliplatin im Therapiearm vs. alleinige Nachsorge enthalten haben.3,4
Mit Spannung werden die Daten der adjuvanten Studie ACTICCA erwartet. Hier wurde ursprünglich Gemcitabin/Cisplatin vs. alleinige Nachsorge untersucht, nach Bekanntwerden der BILCAP-Daten wurde der Nachsorgearm allerdings auf Capecitabin geändert. Und es gab noch ein Amendment: Patienten mit R1-Resektion erhalten nun noch zusätzlich eine Radiatio, welche in Woche 18 startet.
Systemische Therapie für das fortgeschrittene bzw. metastasierte cholangiozelluläre Karzinom
In der Erstlinie ist (noch) immer die Kombination Cisplatin/Gemcitabin Standard: Sollte eine systemische Therapie hinsichtlich des Allgemeinzustands, der Laborwerte und auch der Komorbiditäten möglich sein, so ist seit dem Jahr 2009 eine Kombinationschemotherapie mit Cisplatin und Gemcitabin als Standardtherapie definiert.
Die ABC-02-Studie, die erste prospektive Phase-III-Studie in der systemischen Behandlung des CCC in der Erstlinie, inkludierte 410 Patienten, die entweder eine Kombination von Cisplatin mit Gemcitabin oder eine Gemcitabin-Monotherapie erhielten.5 Mit der Kombinationstherapie konnte eine signifikante Verlängerung des Gesamtüberlebens von 8,1 auf 11,7 Monate erreicht werden, und dies ohne Zunahme von schwerwiegender Übelkeit, Erbrechen oder Nierenfunktionsstörungen.
Patienten mit reduziertem Allgemeinzustand kann eine Monotherapie mit Gemcitabin angeboten werden, bei eingeschränkter Nierenfunktion kann statt Cisplatin Oxaliplatin eingesetzt werden.
ABC-06-Studie
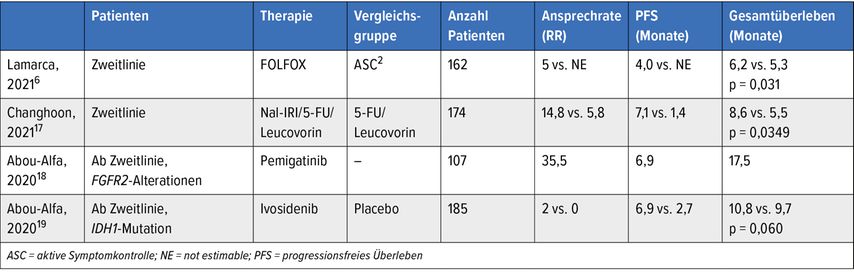
Im Jahr 2019 wurde beim Jahreskongress der American Society for Clinical Oncology (ASCO) die erste randomisierte Phase-III-Studie in der Zweitlinie bei dieser Tumorentität vorgestellt (ABC-06-Studie).6 Patienten, die mit Gemcitabin/Cisplatin vorbehandelt wurden, wurden in einem 1:1-Design entweder in Arm A (aktive Symptomkontrolle = ASC) oder in Arm B (ASC + mFOLFOX) randomisiert.
Der primäre Endpunkt konnte erreicht werden: Das mediane Gesamtüberleben konnte von 5,3 Monaten unter ASC auf 6,2 Monate im Arm B mit einer HR von 0,69 signifikant verlängert werden.
Auch die Rate des 12-Monats-Gesamtüberlebens konnte von 11,4% auf 25,9% erhöht werden. Dies gilt auch für Patienten, die platinrefraktär waren.
NIFTY-Studie
Beim heurigen ASCO wurde eine weitere Zweitlinien-Chemotherapie-Studie vorgestellt, die NIFTY-Studie.7 In dieser erhielten Patienten mit metastasiertem Gallengangskarzinom (inkl. Gallenblasenkarzinom) nach Progress in der Erstlinie mit Gemcitabin und Cisplatin entweder 5-FU/LV oder dieses in Kombination mit Nal-IRI (nanoliposomales pegyliertes Irinotecan). Primärer Endpunkt war das progressionsfreie Überleben.
Nach einem medianen Follow-up von 11,8 Monaten zeigte sich durch die Zugabe von nal-IRI eine deutliche Verlängerung des progressionsfreien Überlebens (PFS) von 1,4 Monaten auf 7,1 Monate mit der Kombinationstherapie. Auch das Gesamtüberleben konnte durch die Zugabe von Nal-IRI statistisch signifikant verlängert werden (8,6 vs. 5,5 Monate, HR: 0,68; 95% CI: 0,48–0,98; p=0,349). Die Ansprechrate konnte ebenfalls deutlich erhöht werden (19,3% vs. 2,3%).
Damit liegen nun zwei sehr gute Therapieoptionen für Patienten mit biliären Tumoren vor, für die eine zielgerichtete Therapie nicht infrage kommt.
NIFE-Studie
Die Kombination von Nal-IRI mit 5-FU wurde nun auch in der Erstlinie getestet. In der randomisierten, multizentrischen Phase-II-NIFE-Studie wurde der Stellenwert von Nal-IRI/5-FU/Leucovorin gegenüber dem Standard Cisplatin/Gemcitabin untersucht.8
Der primäre Endpunkt der Studie war das progressionsfreie Überleben nach vier Monaten. Dieses lag im experimentellen Arm bei 51% und somit wurde der primäre Endpunkt erreicht. Das mediane progressionsfreie Überleben lag bei 5,98 Monaten mit Nal-IRI/5-FU, mit Gemitabin/Cisplatin bei 6,87 Monaten.
Interessant sind die Daten der Subgruppenanalysen. Hier zeigte sich sowohl das mediane PFS als auch das mediane OS bei Patienten mit extrahepetalem cholangiozellulärem Karzinom im Nal-IRI/5-FU im Gegensatz zum Standardarm deutlich verlängert: Das mediane PFS lag bei 9,59 Monaten (vs. 1,76 Monate mit Gemcitabin/Cisplatin), das mediane OS bei 18,23 Monaten (vs. 6,34 Monate). Diese Beobachtung sollte unbedingt in weiteren Studien untersucht werden.
Molekulare Therapien
Nach vielen gescheiterten Versuchen durch zielgerichtete Therapien, sowohl als Monotherapie als auch in Kombination, auch bei malignen biliären Tumoren einen Erfolg zu erzielen, wurden erstmals beim Kongress der European Society of Medical Oncology (ESMO) 2019 zwei Studien vorgestellt, die einen Benefit zeigen konnten. Von beiden Studien gab es heuer ein Update.
Die meisten Studien, die bis 2019 durchgeführt wurden, waren allerdings ohne primäre molekulare Diagnostik durchgeführt worden. Die bis dahin größte und einzige Phase-III-Studie mit einer zielgerichteten Therapie war die Kombination von Gemcitabin und Oxaliplatin plus/minus Erlotinib.9 Hier konnte keine Verlängerung des medianen Gesamtüberlebens gezeigt werden (9,5 vs. 9,5 Monate).
Auch die primär sehr vielversprechende Kombinationstherapie mit Gemcitabin/Oxaliplatin und Cetuximab bei 30 Patienten konnte in einer größeren Phase-II-Studie nicht bestätigt werden.10,11
Häufige Mutationen
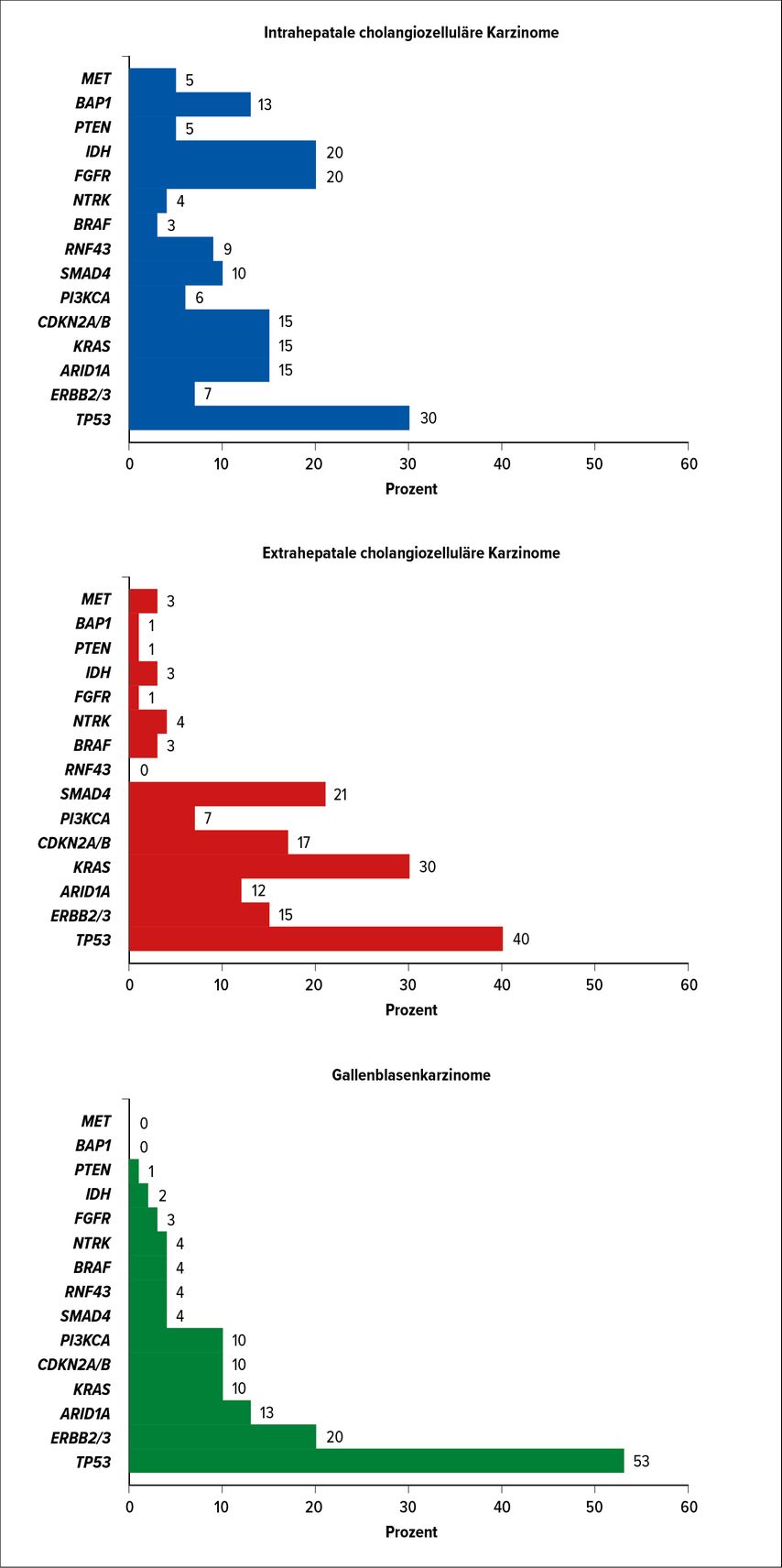
Mittlerweile weiß man, dass es zwei Mutationen gibt, die vor allem beim intrahepatalen Gallengangskarzinom gehäuft vorkommen und die anscheinend auch gute Therapieziele darstellen.
Die IDH1-Mutation lässt sich bei ca 20% der intrahepatalen CCC, eine FGFR2-Mutation bei ca 15% nachweisen. Weiters lassen sich BRAF-, IDH2- und PI3CA-Mutationen beim intrahepatalen CCC nachweisen, allerdings nicht in der Häufigkeit wie IDH1 oder FGFR.
Beim extrahepatalen Cholangiokarzinom und dem Gallenblasenkarzinom findet sich diese genannten Mutationen selten, dafür zeigt sich vermehrt HER2-Positivität (Abb. 1)
ClarIDHY-Studie
Ein vielversprechender Therapieansatz liegt bei Vorliegen der Mutation von IDH1 vor. Ivosidenib, ein selektiver oraler IDH1-Inhibitor, wurde in der ClarIDHy-Studie untersucht. In einer randomisierten, doppelblinden Phase-III-Studie wurde Ivosidenib vs. Placebo bei Patienten mit fortgeschrittenem cholangiozellulärem Karzinom und einer IDH1-Mutation untersucht.12 Die Patienten mussten mindestens eine vorangegangene Therapie (Gemictabin- oder 5-FU-haltig) erhalten haben, in einem guten Allgemeinzustand sein und eine durch Next-Generation Sequencing nachgewiesene IDH1-Mutation haben. Die Randomisierung wurde in einem 2:1-Design durchgeführt, wobei die Patienten im experimentellen Arm 500mg Ivosidenib/Tag erhielten. Ein Cross-over war bei Progress erlaubt. Der primäre Endpunkt war das progressionsfreie Überleben. Die finalen Daten wurden heuer beim ASCO vorgestellt.
Die Patientencharakteristika waren in beiden Armen ausgewogen. Etwas mehr als die Hälfte der Patienten hatten eine Vortherapie erhalten, 47,6% im Ivosidenib-Arm bzw. 45,9% im Placeboarm hatten bereits zwei Therapielinien erhalten. Im experimentellen Arm hatten 113 Patienten (89,7%) ein intrahepatales cholangiozelluläres Karzinom und 5 Patienten (4%) ein extrahepatales CCC, im Placeboarm lag die Verteilung bei 95,1% und 1,6%. Hinsichtlich des Allgemeinzustandes waren etwas mehr Patienten mit einem Performance Score von 1 in der Placebogruppe (67,2% vs. 59,5%).
Das progressionsfreie Überleben war im Ivosidenib-Arm fast verdoppelt und lag bei 2,7 Monaten unter Ivosidenib vs. 1,4 Monate im Placeboarm (HR: 0,37, p<0,001). Auch die Krankheitskontrollrate war im experimentellen Arm mit 53% vs. 28% im Placeboarm deutlich höher.
In der finalen Analyse des Gesamtüberlebens zeigte sich eine nicht signifikante Verlängerung von 7,5 Monaten im Placeboarm auf 10,3 Monate mit Ivosidenib. Allerdings wurden 57% der Patienten im Placeboarm bei Progredienz auf Ivosidenib eingestellt; bei Patienten, die kein Cross-over hatten, lag das mediane Überleben bei lediglich 5,1 Monaten (HR: 0,49, p<0,0001)
Ivosidenib war im Allgemeinen gut verträglich, wobei Nebenwirkungen ≥Grad 3 bei 46% der Patienten im experimentellen Arm und 36% im Placeboarm beschrieben wurden. Es zeigte sich unter den Nebenwirkungen eine Zunahme der Diarrhöen unter Ivosidenib von 15% im Placeboarm auf 30,6%, von Übelkeit auf 35,5% (25,4% im Placeboarm) und Husten trat bei 20,7% der Patienten im Ivosidenib-Arm vs. 8,5% im Placeboarm auf. Weiters konnte eine Zunahme von Müdigkeit, adominellen Schmerzen, Aszites und Anämie beobachtet werden. Es kam zu keinen therapieassoziierten Todesfällen.
Mit Spannung werden die Daten von Studien mit Ivosidenib in der Erstlinie (auch in Kombination mit Cisplatin/Gemcitabin) erwartet.
FIGHT-202
Eine weitere Substanz hat sich mittlerweile als erfolgreich in der Behandlung des CCC erwiesen: Pemigatinib, ein selektiver FGFR-Inhibitor.
In FIGHT-202, einer Phase-II-Studie, wurde die Wirksamkeit von Pemigatinib bei Patienten untersucht, die bereits zuvor aufgrund eines lokal fortgeschrittenen oder metastasierten malignen biliären Tumors mindestens eine Systemtherapie erhalten haben und einen dokumentierten FGF/FGFR-Status vorweisen konnten.13
Auch von dieser Studie gab es heuer ein Update beim ASCO, mit dem Augenmerk auf Patienten in der Kohorte A (107 Patienten mit FGFR2-Fusionen oder -Rearrangements). Die Patienten erhielten 13,5mg Pemigatinib einmal täglich oral über einen 21-Tage-Zyklus (zwei Wochen Einnahme gefolgt von einer Woche Pause) bis zur Progression oder bis zu inakzeptablen Toxizität. Primärer Endpunkt war das radiologische Ansprechen, sekundäre Endpunkte waren die Tiefe des Ansprechens, die Krankheitskontrolle, das progressionsfreie Überleben sowie das Gesamtüberleben und die Sicherheit der Therapie. 61% bzw. 39% hatten 1 bzw. ≥2 vorangegangene Therapielinien.
Das Gesamtansprechen (ORR) lag in der aktuellen Analyse unter Pemigatinib bei 37%; davon 4 komplette Remissionen, die Krankheitskontrolle lag bei 82,4% und die mediane Ansprechdauer bei 8,1 Monaten. Das mediane progressionsfreie Überleben lag bei 7 Monaten, das mediane Gesamtüberleben bei 17,5 Monaten. Bei Patienten, die angesprochen hatten, lag das Gesamtüberleben sogar bei 30,1 Monaten.
Pemigatinib war prinzipiell gut verträglich. Die häufigsten Nebenwirkungen waren Hyperphosphatämie (56%; Grad ≥3: 0%), Alopezie (59%; 0%), Diarrhö (53%; 4%), Fatigue (46%; 5%), Nausea (43%; 3%) und Dysgeusie (48%; 0%), eine Netzhautablösung wurde bei 4% der Patienten beobachtet (Grade ≥3: 1%).
Pemigatinib ist mittlerweile zugelassen und kann somit bei Patienten mit einer FGFR2-Fusion/Rearrangement ab der Zweitlinie eingesetzt werden.
Fazit und Ausblick
Die Wirksamkeit von weiteren FGFR-Inhibitoren wird gerade in Studien getestet. Die ersten Resultate bestätigen die Wirkung dieser Substanz bei Patienten mit biliären Tumoren. Mit Spannung werden auch hier Erstliniendaten erwartet.
Neben IDH1- sowie FGFR2-Inhibitiongibt es auch erste vielversprechende Therapieansätze mit einer HER2-Blockade, da bei 10–27% der extrahepatischen Gallengangs- und Gallenblasenkarzinome eine Überexpression von HER2/neu gezeigt werden konnte,14 sowie bei BRAF-mutierten Patienten (bei ca. 5% der Patienten) mit einer Kombination aus einem MEK- und BRAF-Inhibitor.15
Zusammenfassend kann gesagt werden, dass eine Mutationsanalyse bei allen Patienten mit malignen biliären Tumoren bei der Diagnose eines fortgeschrittenem Stadiums durchgeführt werden sollte. Mit den Daten aus ClarIDHY und FIGHT-202 kann nun Patienten mit fortgeschrittenen biliären Tumoren und entsprechenden Mutationen eine zielgerichtete Therapie nach Versagen der Erstlinie angeboten werden.
Wir können mit Zuversicht den Ergebnissen der Studien, die diese Therapien in der Erstlinie untersuchen oder auch in Kombinationen einsetzen, entgegensehen.
Literatur:
1 Blechacz B: Gut Liver 2017; 11(1): 13-26 2 Primrose JN et al.: Lancet Oncol 2019; 20(5): 663-73 3 Edeline J et al.: JClin Oncol 2019; 37(8): 658-67 4 Ebata T et al.: Br J Surg 2018; 105(3): 192-202 5 Valle J et al.: N Engl J Med 2010; 362(14): 1273-81 6 Lamarca A et al.: Lancet Oncol 2021; 22690-701 7 Changhoon Y et al.: Lancet Oncol 2021; 22(11): 1560-72 8 Perkhofer L et al.: Ann Oncol 2021; 32 (5_suppl): S1283-S1346 9 Lee J et al.: Lancet Oncol 2012; 13(2): 181-8 10 Grünberger B et al.: Lancet Oncol 2010; 11: 1142-8 11 Malka D et al.: Lancet Oncol 2014; 15: 819-28 12 Abou-Alfa et al.: J Clin Oncol 2021; 39(15_suppl): 4069 13 Abou-Alfa et al.: J Clin Oncol 2021; 39(15_suppl): 4086 14 Hainsworth JD et al.: J Clin Oncol 2018; 36(6): 536-42 15 Wainberg Z et al.: J Clin Oncol 2019; 37(4_suppl): 187 16 Lamarca A et al.: JHepatol 2020; 73(1): 170-85 17 Changhoon Y et al.: J Clin Oncol 2021; 39(15_suppl): 4006-4006 18 18 Abou-Alfa GK et al.: Lancet Oncol 2020; 21: 796-807 19 Abou-Alfa GKet al.: Lancet Oncol 2020; 21: 671-84
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...